紫莖澤蘭透皮劑的制備工藝優化及其臨床殺螨效果觀察
王柳杰,房春林,古小彬,謝 躍,楊光友,*
(1.四川農業大學 動物醫學院,四川 成都611130; 2.成都農業科技職業學院 畜牧獸醫分院,四川 成都 611130)
動物螨病是主要由疥螨科、癢螨科、蠕形螨科和皮刺螨科等螨類寄生于動物體表或表皮內所引起的傳染性寄生蟲病。螨病能夠引起動物生產性能和產品質量的下降,嚴重時導致出現大量死亡[1]。化學類殺螨藥物為目前國內外防治動物螨病的主力,包括有機磷殺蟲劑、有機氯殺蟲劑、大環內酯類殺蟲劑、除蟲菊和擬除蟲菊酯類殺蟲劑。這類藥物雖然殺螨效果好,但存在毒性高、殘留時間長、環境污染大和長期使用可產生耐藥性等問題[2]。植物源的天然藥物具有對人畜低毒、對非靶標生物比較安全、對環境壓力比較小,且不易產生殘留和耐藥性等特點[3-5];因此,從天然植物中提取出高效、低毒、低殘留的殺螨物質及有效殺螨活性成分,對動物螨病的防控具有重要意義。
紫莖澤蘭(Eupatoriumadenophorum)屬菊目菊科(Compositae)澤蘭屬(Eupatorim)多年生草本植物,原產美洲的墨西哥至哥斯達黎加一帶,它具有超凡的繁殖能力和密集成片取得種群優勢的生物學特性。作為一種重要的外來有害入侵植物,已在我國重慶、四川、貴州、云南、西藏、廣西、河北、臺灣等地迅速傳播,給當地生態平衡帶來巨大威脅。近年來,隨著對紫莖澤蘭防控與利用研究的不斷深入,已發現紫莖澤蘭可作為開發植物源性天然藥物的原料,不僅可以變害為寶,有效地控制這一有害雜草的蔓延,而且還能克服化學藥物的環境毒性、殘留和耐藥性等缺點。研究報道,紫莖澤蘭的提取物不僅可以用來殺滅蚜蟲、抑制蛾蟲產卵、治療二斑葉螨病和柑橘全爪螨病、殺滅倉庫害蟲等農業害蟲[6-9],還可以用于治療動物球蟲病、線蟲病、伊氏錐蟲病等寄生蟲病[10-12]。本課題組在前期研究中發現,紫莖澤蘭的醇和醚提取物對危害動物的蜱、疥螨、癢螨和足螨具有較好的殺蟲活性[13-18]。為了進一步對紫莖澤蘭進行生產開發利用,特開展紫莖澤蘭源外用殺螨液提取工藝、制劑及臨床殺螨效果觀察與研究。
1 材料與方法
1.1 試驗材料
1.1.1供試動物
自然感染螨病的家兔,即癢螨兔30只,雌雄各半;疥螨兔26只,雌雄各半;平均體質量2.3 kg,購自成都市都江堰某兔場。成年、健康、皮膚無損傷的清潔級家兔24只,雌雄各半,體質量2.4~2.8 kg,購自成都達碩試驗動物有限公司。實驗動物生產許可證號:SCXK(川)2015—030。
1.1.2供試植物及試劑
紫莖澤蘭2016年采自四川省攀枝花市。紫莖澤蘭素A(9-羰基-10,11-去氫澤蘭酮,euptox A)標準品,購自上海遠慕生物科技有限公司,純度95%,5 mg。99.7%無水乙醇,分析純;甲醇,色譜純;水,娃哈哈純凈水。
1.2 試驗方法
以主要殺螨活性成分紫莖澤蘭素A為考查指標,以乙醇體積分數、料液比、提取次數、提取時間為考查因素,利用單因素試驗確定因素水平,以L9(34)正交試驗確定紫莖澤蘭乙醇提取的最佳工藝條件。
(1)紫莖澤蘭植株的處理。將采集來的紫莖澤蘭植株帶回四川農業大學動物寄生蟲病研究中心實驗室自然陰干,為了進一步烘干,把陰干后的植株放在50 ℃的電熱恒溫鼓風干燥箱中至恒重,用粉碎機粉碎到50~200目,所得植物粉用密封袋密封,避光處保存備用。
(2)標準品溶液的制備。紫莖澤蘭素A標準品5 mg置于50 mL容量瓶中,用甲醇進行溶解,稀釋至刻度,搖勻作為母液,即配成溶液濃度為0.1 mg·mL-1的紫莖澤蘭素A標準品溶液,保存在4 ℃冰箱中備用。
(3)樣品溶液的制備。精密稱取粉碎的紫莖澤蘭植物粉末10.0 g置于500 mL圓底燒瓶中,加一定濃度和體積的乙醇溶液,利用冷凝回流裝置恒溫水浴一定時間,自然冷卻后經2 770g離心5 min過濾,收集濾液之后,利用旋轉蒸發儀65 ℃水浴減壓蒸餾濃縮到50 mL,得生藥濃度為0.2 g·mL-1,備用。
(4)樣品中紫莖澤蘭素A含量的測定。測定樣品紫莖澤蘭素A含量的HPLC條件:流動相為甲醇∶水=55∶45(體積比),流速1.0 mL·min-1,進樣量20.0 μL,檢測波長255 nm,190~400 nm波段全掃描,Cosmosil C18色譜柱(250 mm×4.6 mm,5.0 μm),柱溫 30 ℃。測定方法:分別精密吸取標準品溶液與稀釋后的樣品溶液各20.0 μL,利用液相色譜儀測定。
1.3 單因素試驗設計
1.3.1乙醇體積分數對紫莖澤蘭素A提取率的影響
取5份10.0 g的紫莖澤蘭植物粉末,放入圓底燒瓶中,分別加入體積分數為50%、65%、75%、85%、95%的乙醇150 mL,在98 ℃恒溫水浴下冷凝回流1 h,自然冷卻后,2 770g離心5 min過濾,把濾液收集到圓底燒瓶中,65 ℃水浴旋轉蒸發儀減壓蒸餾濃縮至50 mL。分別從中取200 μL用對應濃度的乙醇稀釋3倍后進樣,稀釋后的樣品按照1.2節的色譜條件進行測定,提取率分別為0.114%、0.156%、0.174%、0.176%、0.187%。由此得知,紫莖澤蘭素A提取率隨著乙醇體積分數的增加而升高。
1.3.2提取時間對紫莖澤蘭素A提取率的影響
取4份10.0 g的紫莖澤蘭植物粉末,放入圓底燒瓶中,加入體積分數為75%的乙醇150 mL,分別在98 ℃恒溫水浴下冷凝回流提取0.5、1.0、1.5、2.0 h。自然冷卻后,接下來的步驟同上。稀釋3倍后進行測定,提取率分別為0.167%、0.172%、0.177%、0.188%。由此得知,紫莖澤蘭素A提取率隨著提取時間的延長而升高。
1.3.3料液比對紫莖澤蘭素A提取率的影響
取4份10.0 g的紫莖澤蘭植物粉末,放入圓底燒瓶中,分別加入體積分數為75%的乙醇100 mL(料液比1∶10)、150 mL(料液比1∶15)、200 mL(料液比1∶20)、300 mL(料液比1∶30)。在98 ℃恒溫水浴下冷凝回流 1 h,自然冷卻后,同上操作,稀釋3倍后進行測定,提取率分別為0.056%、0.094%、0.097%、0.110%。由此得知,紫莖澤蘭素A提取率隨著料液比的減小而升高。
1.3.4提取次數對紫莖澤蘭素A提取率的影響
取3份10.0 g的紫莖澤蘭植物粉末,放入圓底燒瓶中,分別加入體積分數為75%的乙醇150 mL,在98 ℃恒溫水浴下分別冷凝回流1次、2次、3次,每次1 h。合并每次冷凝回流溶液自然冷卻后,同上操作,稀釋3倍后進行測定,提取率分別為0.103%、0.114%、0.151%。由此得知,紫莖澤蘭素A提取率隨著提取次數的增加而升高。
1.4 正交試驗設計
參考單因素試驗結果,從實際生產成本考慮,設計正交試驗表(表1)。
1.5 試驗藥液制備
按照正交試驗最佳提取工藝條件制得紫莖澤蘭的乙醇提取液,以制劑中是否加入促透劑氮酮(azone)來作為本次臨床殺螨效果的評估。依照初步篩選處方(5%氮酮、15%吐溫-80、50%丙三醇、30%酒精)對紫莖澤蘭植株乙醇提取液進行溶解,在4 ℃冰箱中靜置48 h后過濾,制得生藥含量分別為1.0、0.5 g·mL-1(質量體積比,下同)樣品液備用;不含氮酮組藥液以等體積0.9%生理鹽水代替氮酮進行溶解,同樣方法在4 ℃冰箱中靜置48 h后過濾,制得生藥含量分別為1.0、0.5 g·mL-1樣品液備用。
1.6 皮膚安全性試驗
1.6.1皮膚急性毒性試驗
按照郝光榮[19]介紹的方法分組與處理。取皮膚無損傷、體質量相近、健康狀況好的家兔12只,雌雄各半,隨機分成3組:A組,加氮酮1.0 g·mL-1;B組,未加氮酮;C組,空白對照組(0.9%生理鹽水)。在給藥之前的24 h,采用機械方法給家兔背部脊柱兩側10 cm×5 cm區域進行對稱剪毛,并且利用脫毛劑(8%硫化鈉)來脫毛。試驗前注意檢查去過毛的皮膚是否完整,受傷了的皮膚不能用來做完整皮膚的試驗。
表1L9(34)正交試驗因素水平
Table1Factor level design of L9 (34) orthogonal test
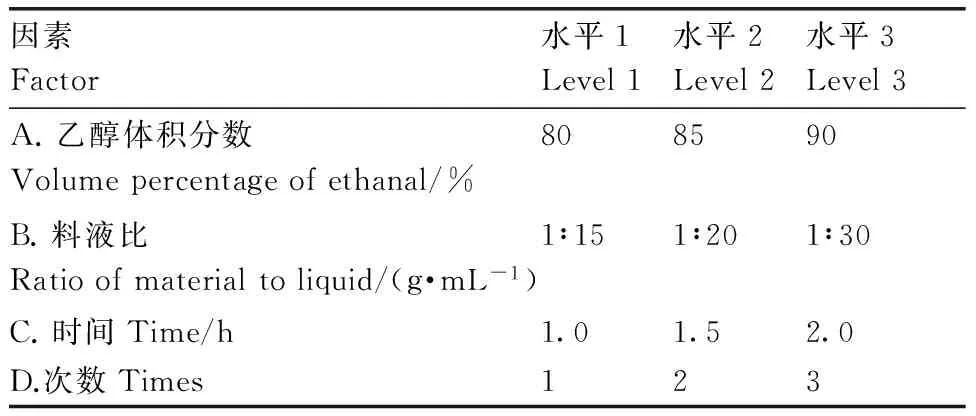
因素Factor水平1Level1水平2Level2水平3Level3A.乙醇體積分數Volumepercentageofethanal/%808590B.料液比Ratioofmaterialtoliquid/(g·mL-1)1∶151∶201∶30C.時間Time/h1.01.52.0D.次數Times123
A、B組家兔給予相應殺螨液3 mL·只-1,C組家兔給予0.9%生理鹽水3 mL·只-1。試驗過程中,將藥物均勻涂擦家兔背部的脫毛區域,涂藥后區域立即用濕巾、消毒紗布和無刺激性膠布固定。停用藥之后的24 h,利用溫水洗去殘留的藥物,洗掉藥物之后1 h及1~7 d,每天觀察并且記錄家兔整體狀況,包括體質量、四肢活動、飲食與糞便、毛發、皮膚、呼吸、眼與黏膜等有沒有中毒的表現,以及死亡情況等。如果殺螨液完整皮膚組無毒性反應,則用75%(體積分數)醫用酒精對家兔右側脫毛區域進行消毒,用于制作破損皮膚,用16號滅菌針頭在消過毒的區域內劃“#”,只損傷到表皮不損傷到真皮,以有少量血滲出來為度,馬上在破損皮膚部位涂擦殺螨液。具體操作方法、用藥劑量及觀察指標同完整皮膚組,試驗過程中要進行3個組的相互對照比較。如果過程中有動物出現死亡,應及時進行尸體解剖檢查。當存在肉眼觀察能見的病變時,應該進行病理組織學相關檢查[20]。
1.6.2皮膚刺激性試驗
依據參考文獻[21]進行分組與處理。取試驗家兔12只,雌雄各半,按照隨機數字將它們分為2組:第一組是完整皮膚組,第二組是破損皮膚組,每組6只,編號1~12來進行標記。脫毛法同皮膚急性毒性試驗。第2組家兔用酒精消毒后,在右側皮膚用滅菌16號針頭進行“#”字劃
破,以皮膚有血滲出為度,破損的區域面積為5 cm×4 cm,劃痕之間的距離為0.5 cm。
采用同體左右側自身對照法,每組家兔右側脫毛涂擦生藥含量為1.0 g·mL-1添加透皮劑殺螨液3 mL,作為對照,給予左側脫毛區涂擦0.9%生理鹽水3 mL,用濕巾、消毒紗布和無刺激性膠布固定,每天擦藥一次,連著擦藥5 d,在最后一次擦藥后24 h利用溫水洗去殘留的藥物,洗掉藥物之后1、24、48、72 h用肉眼觀察受藥部位的皮膚有沒有紅斑、水腫等情況。按照刺激反應的評分標準(表2),分別對完整皮膚和破損皮膚的刺激強度進行評價:總分值0~0.49為無刺激;總分值0.50~2.99為輕刺激;總分值3.00~5.99為中刺激;總分值6.00~8.00為強刺激[22]。
1.7 臨床治療試驗
參照Perrucci等[23]、Walton等[24]的方法進行試驗。
兔癢螨病組試驗。將30只試驗家兔隨機分成6組:4個外用殺螨液(涂擦)治療試驗組分別為含紫莖澤蘭生藥1.0、0.5 g·mL-1加氮酮組和紫莖澤蘭生藥1.0 g·mL-1、0.5 g·mL-1未加氮酮組,每組試驗動物各6只;陽性藥物對照組(含伊維菌素0.2 mg),試驗動物3只;空白對照組(0.9%生理鹽水),試驗動物3只。
兔疥螨病組試驗。將26只試驗家兔隨機分成6組,除外用殺螨液(涂擦)治療試驗組每組動物各5只外,其余動物分組和處理均與兔癢螨病組相同。
伊維菌素,按照0.2 mg·kg-1(以體質量計)皮下注射,每隔6 d一次,連用2次。藥液試驗組:耳道采用滴入法,足爪患部先剪去被毛,棉花蘸取藥液涂擦;耳緣及嘴鼻等其他患部直接涂藥,每隔6 d一次,連用2次。生理鹽水組:直接用0.9%生理鹽水進行涂擦,每隔6 d一次,連用2次。
表2皮膚刺激性反應評分標準
Table2Parameters used to evaluate clinical response score of skin irritation intensity
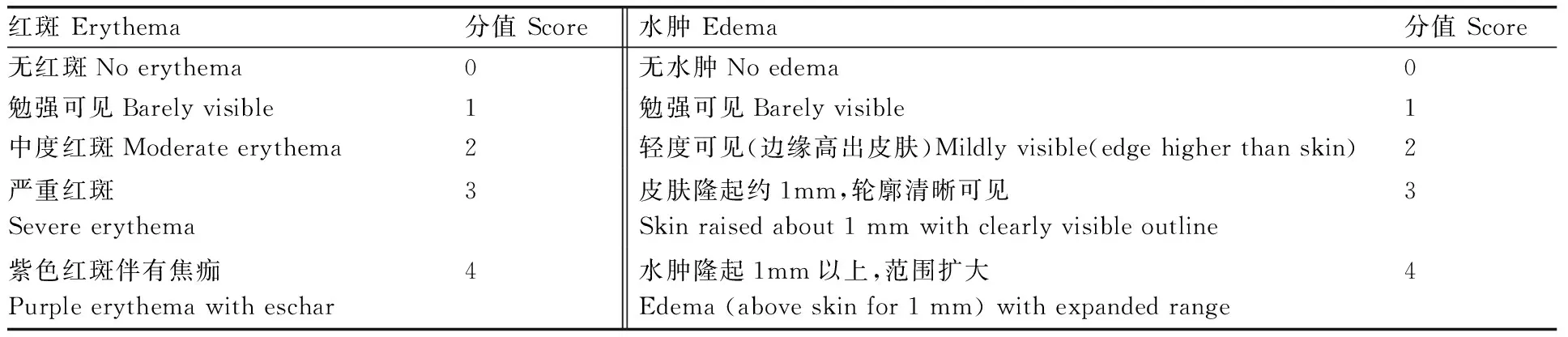
紅斑Erythema分值Score水腫Edema分值Score無紅斑Noerythema0無水腫Noedema0勉強可見Barelyvisible1勉強可見Barelyvisible1中度紅斑Moderateerythema2輕度可見(邊緣高出皮膚)Mildlyvisible(edgehigherthanskin)2嚴重紅斑Severeerythema3皮膚隆起約1mm,輪廓清晰可見Skinraisedabout1mmwithclearlyvisibleoutline3紫色紅斑伴有焦痂Purpleerythemawitheschar4水腫隆起1mm以上,范圍擴大Edema(aboveskinfor1mm)withexpandedrange4
于試驗開始的第0、3、7、14、30天,收集痂皮,根據鏡檢螨的存在情況計算治愈率。顯微鏡觀察時,有螨蟲顯示陽性,沒有螨蟲顯示陰性。按照相關文獻的方法[25-27],計算每個治療組的治療效果(螨病治愈率)。
癢螨病組(左)和疥螨病組(右)療效等級評分判定見表3。
1.8 數據分析
采用SAS軟件進行數據分析[28]。
2 結果與分析
2.1 紫莖澤蘭外用殺螨液提取工藝優化
從表4可以得出,各因素對紫莖澤蘭素A提取率的影響從高到低依次為A(提取濃度)>C(提取時間)>D(提取次數)>B(料液比),最佳工藝為A3B2C1D3,即乙醇體積分數95%,料液比1∶20(g·mL-1),提取時間1 h,提取次數3次,提取率約為0.281%。
表3臨床評估感染程度與恢復描述等級評分
Table3Parameters used to evaluate score of clinical infection and recovery degree
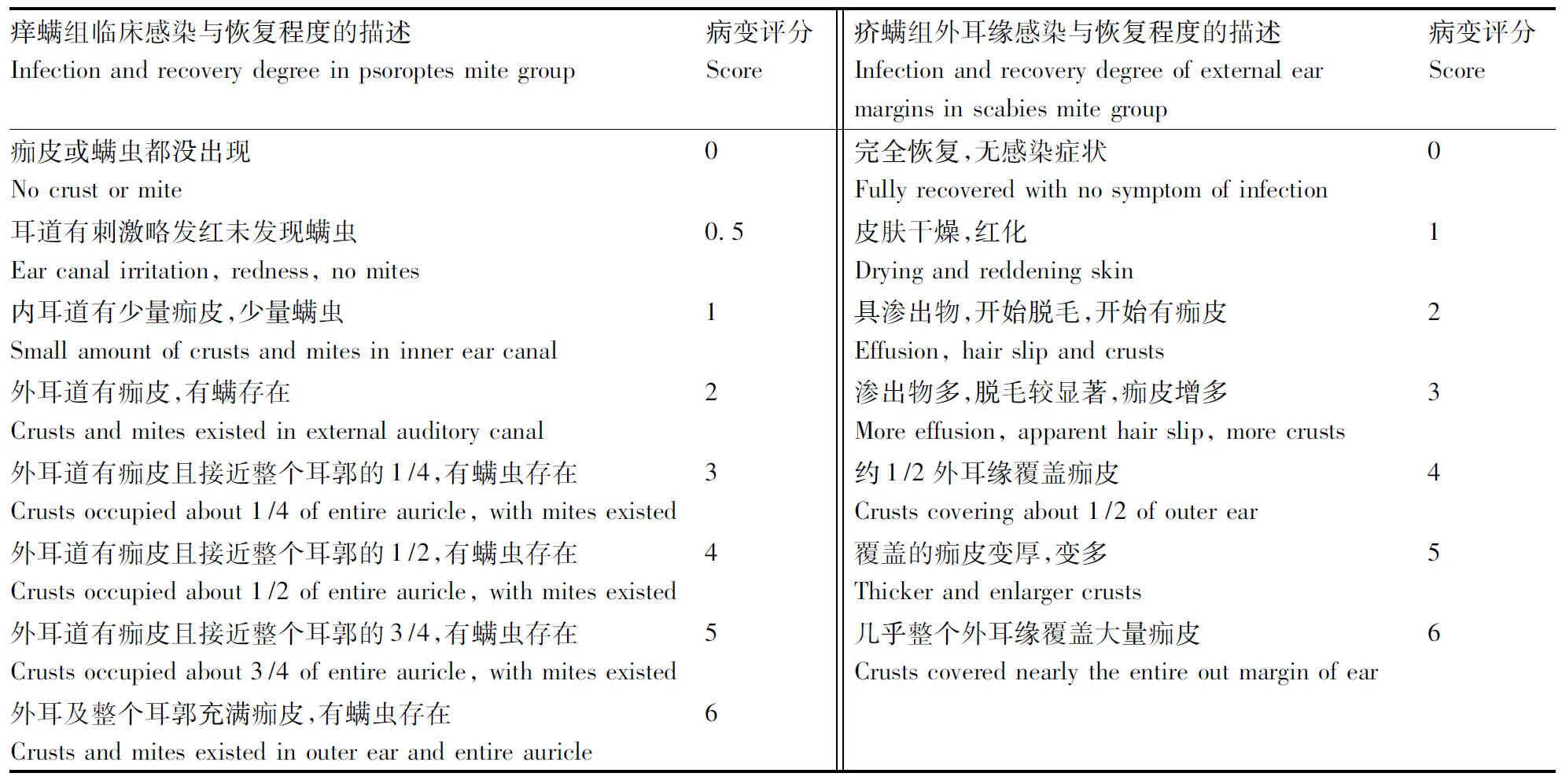
癢螨組臨床感染與恢復程度的描述Infectionandrecoverydegreeinpsoroptesmitegroup病變評分Score疥螨組外耳緣感染與恢復程度的描述Infectionandrecoverydegreeofexternalearmarginsinscabiesmitegroup病變評分Score痂皮或螨蟲都沒出現Nocrustormite0完全恢復,無感染癥狀Fullyrecoveredwithnosymptomofinfection0耳道有刺激略發紅未發現螨蟲Earcanalirritation,redness,nomites0.5皮膚干燥,紅化Dryingandreddeningskin1內耳道有少量痂皮,少量螨蟲Smallamountofcrustsandmitesininnerearcanal1具滲出物,開始脫毛,開始有痂皮Effusion,hairslipandcrusts2外耳道有痂皮,有螨存在Crustsandmitesexistedinexternalauditorycanal2滲出物多,脫毛較顯著,痂皮增多Moreeffusion,apparenthairslip,morecrusts3外耳道有痂皮且接近整個耳郭的1/4,有螨蟲存在Crustsoccupiedabout1/4ofentireauricle,withmitesexis-ted3約1/2外耳緣覆蓋痂皮Crustscoveringabout1/2ofouterear4外耳道有痂皮且接近整個耳郭的1/2,有螨蟲存在Crustsoccupiedabout1/2ofentireauricle,withmitesexis-ted4覆蓋的痂皮變厚,變多Thickerandenlargercrusts5外耳道有痂皮且接近整個耳郭的3/4,有螨蟲存在Crustsoccupiedabout3/4ofentireauricle,withmitesexis-ted5幾乎整個外耳緣覆蓋大量痂皮Crustscoverednearlytheentireoutmarginofear6外耳及整個耳郭充滿痂皮,有螨蟲存在Crustsandmitesexistedinouterearandentireauricle6
表4正交試驗設計及結果
Table4Orthogonal test design and result
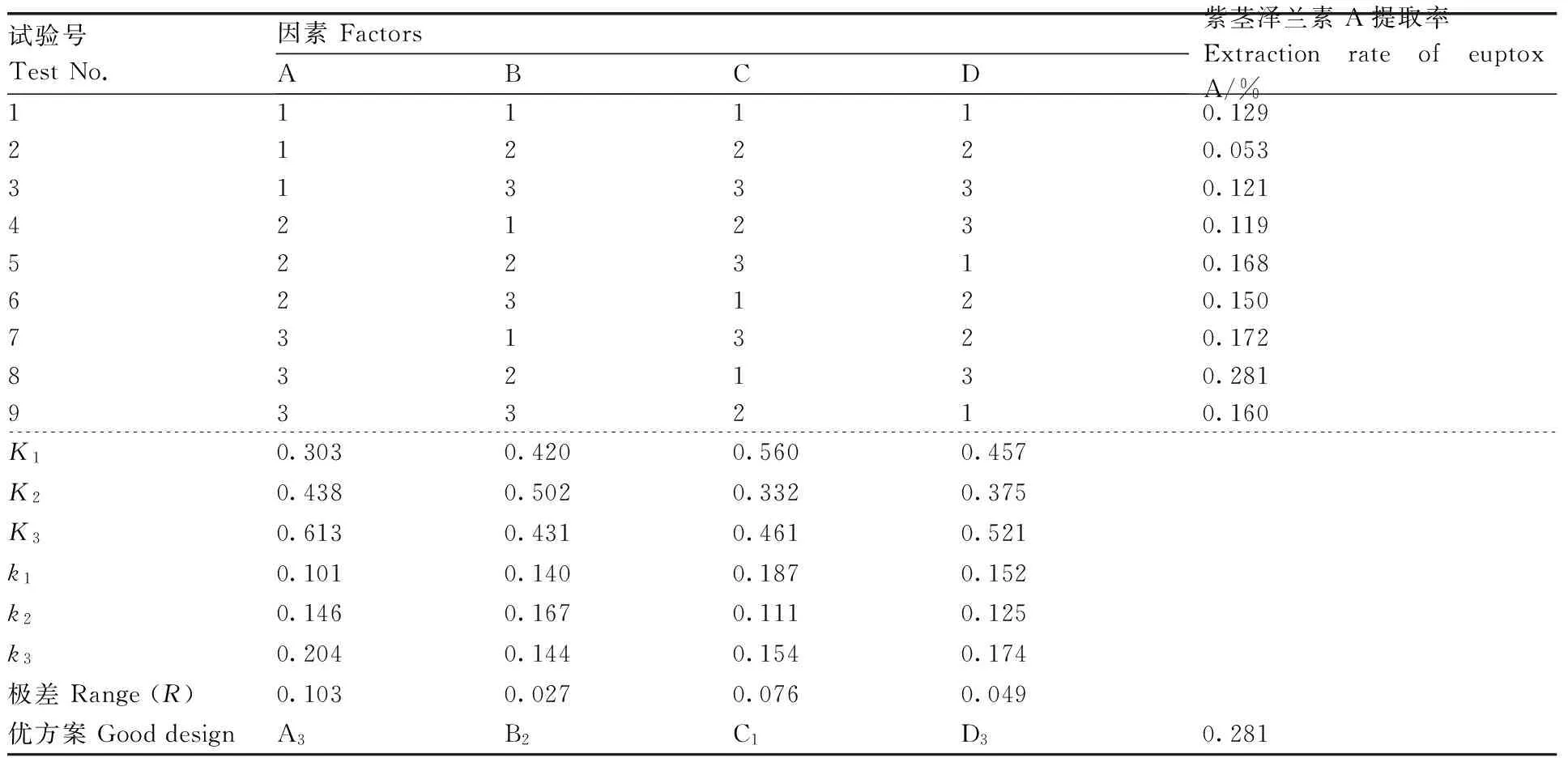
試驗號TestNo.因素FactorsABCD紫莖澤蘭素A提取率ExtractionrateofeuptoxA/%111110.129212220.053313330.121421230.119522310.168623120.150731320.172832130.281933210.160K10.3030.4200.5600.457K20.4380.5020.3320.375K30.6130.4310.4610.521k10.1010.1400.1870.152k20.1460.1670.1110.125k30.2040.1440.1540.174極差Range(R)0.1030.0270.0760.049優方案GooddesignA3B2C1D30.281
2.2 皮膚安全性試驗
2.2.1皮膚急性毒性試驗
在試驗的14 d內,與C組(對照組)相比,A組和B組在涂擦殺螨液后,完整皮膚組家兔四肢活動自如,皮毛光澤正常,飲食、尿液和糞便、眼與黏膜、呼吸方面無明顯變化,精神狀況沒有不正常,也未出現中毒現象,更沒有發生死亡。破損皮膚組在試驗的7 d之內,A組和B組也未出現中毒癥狀,和C組相比,體質量無顯著差異(P>0.05)(表5)。試驗結果初步證實,皮膚接觸此殺螨液并不會產生急性毒性作用。
2.2.2皮膚刺激性試驗
完整皮膚組家兔涂擦透皮殺螨液后無任何異常出現,破損皮膚組涂擦透皮殺螨液后,給藥處有輕微紅斑,輕微水腫,為輕度刺激級別。但在洗去藥物72 h 后,紅斑及水腫現象消失,初步證明透皮殺螨液未對皮膚造成不可逆損傷。根據試驗結果分析:紫莖澤蘭提取的殺螨液對完整皮膚家兔除在1 h內有輕度刺激外,之后再無刺激性,而對于破損皮膚組則在 1~72 h為輕度刺激性,之后再無刺激性(表6、表7)。
2.3 臨床治療效果
2.3.1癢螨病組
從癢螨病組治療統計結果(表8)可知,A組治療3 d,與其他藥液治療組相比治愈率有顯著(P<0.05)提升。治療7 d后,治愈率即達到100%。
2.3.2疥螨病組
從疥螨病組治療統計結果(表9)可知,A組治療3、7 d,與其他藥液治療組相比治愈率有顯著(P<0.05)提升。治療7 d,治愈率即達100%。
3 討論
紫莖澤蘭的化學成分種類很多,分離出來的化學成分已達100余種,主要為半萜類、甾體類、黃酮類、單萜類、苯丙素類、三萜類6大類及其衍生物。利用紫莖澤蘭提取物進行兔疥螨、兔癢螨、牛足螨、長角血蜱(硬蜱科)的臨床試驗,證實紫莖澤蘭粗提物對它們有極強的殺滅作用[13-18],并成功地鑒別出了主要殺螨活性單體為9-羰基-10,11-去氫澤蘭酮(紫莖澤蘭素A,Euptox A)。紫莖澤蘭素A對疥螨和癢螨的離體和在體殺滅都表現出很好的活性。對紫莖澤蘭素A在紫莖澤蘭體內的分布及積累動態進行研究發現,紫莖澤蘭葉片醇提物具有抑菌、抗病毒、殺蟲活性。經過進一步篩選,明確了紫莖澤蘭倍半萜成分和以紫莖澤蘭素A為主的澤蘭酮衍生物是主要的殺蟲活性成分[29-33]。選取紫莖澤蘭素A作為考查指標對提取工藝進行篩選,可以更好地反映提取物的殺螨活性。
表5皮膚急性毒性試驗對家兔體質量的影響
Table5Effect of acute toxicity test on rabbit body weight

kg
表6完整皮膚組刺激性試驗結果
Table6Results of irritation test of complete skin group
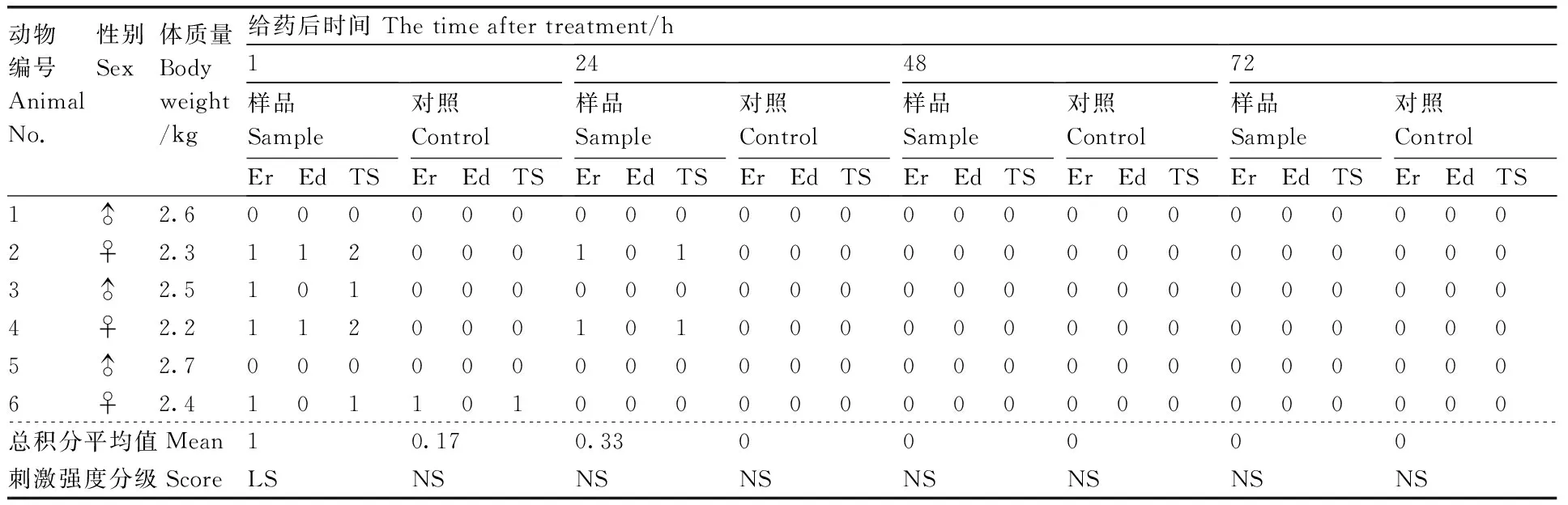
動物編號AnimalNo.性別Sex體質量Bodyweight/kg給藥后時間Thetimeaftertreatment/h1樣品SampleErEdTS對照ControlErEdTS24樣品SampleErEdTS對照ControlErEdTS48樣品SampleErEdTS對照ControlErEdTS72樣品SampleErEdTS對照ControlErEdTS1♂2.60000000000000000000000002♀2.31120001010000000000000003♂2.51010000000000000000000004♀2.21120001010000000000000005♂2.70000000000000000000000006♀2.4101101000000000000000000總積分平均值Mean10.170.3300000刺激強度分級ScoreLSNSNSNSNSNSNSNS
Er,紅斑;Ed,水腫;TS,總分;♂,雄;♀,雌;LS,輕刺激;NS,無刺激。下同。
Er, Erythema; Ed, Edema; TS, Total score; ♂, Male; ♀, Female; LS, Light stimulation; NS, No stimulation. The same as below.
表7破損皮膚組刺激性試驗結果
Table7Results of irritation test of damaged skin group
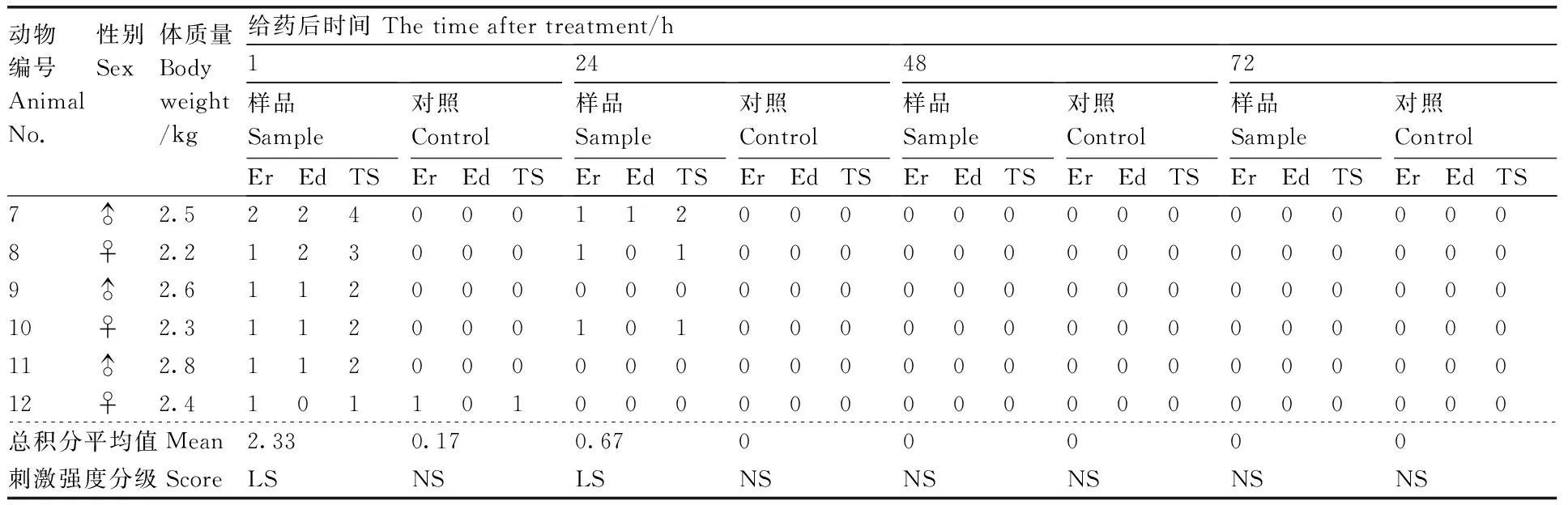
動物編號AnimalNo.性別Sex體質量Bodyweight/kg給藥后時間Thetimeaftertreatment/h1樣品SampleErEdTS對照ControlErEdTS24樣品SampleErEdTS對照ControlErEdTS48樣品SampleErEdTS對照ControlErEdTS72樣品SampleErEdTS對照ControlErEdTS7♂2.52240001120000000000000008♀2.21230001010000000000000009♂2.611200000000000000000000010♀2.311200010100000000000000011♂2.811200000000000000000000012♀2.4101101000000000000000000總積分平均值Mean2.330.170.6700000刺激強度分級ScoreLSNSLSNSNSNSNSNS
表8耳道感染與治療恢復后的評分等級統計結果
Table8Clinical score of infection and degree of recovery for ears
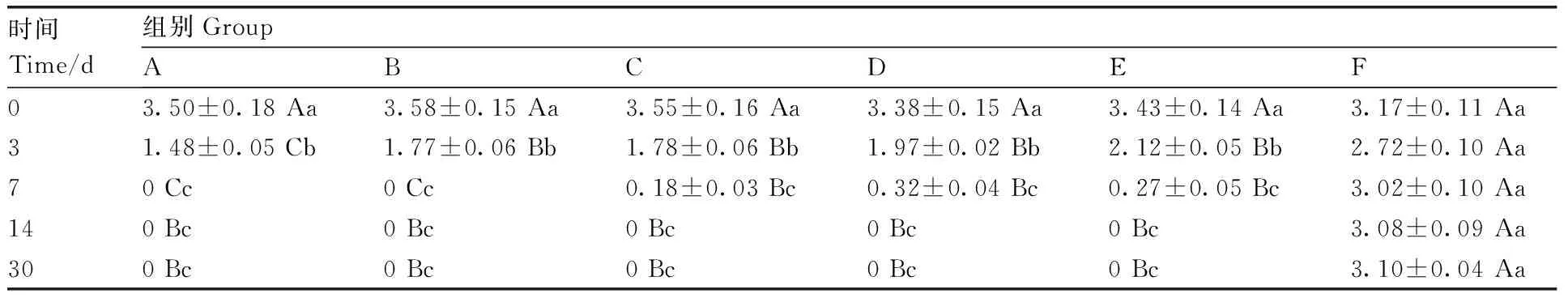
時間Time/d組別GroupABCDEF03.50±0.18Aa3.58±0.15Aa3.55±0.16Aa3.38±0.15Aa3.43±0.14Aa3.17±0.11Aa31.48±0.05Cb1.77±0.06Bb1.78±0.06Bb1.97±0.02Bb2.12±0.05Bb2.72±0.10Aa70Cc0Cc0.18±0.03Bc0.32±0.04Bc0.27±0.05Bc3.02±0.10Aa140Bc0Bc0Bc0Bc0Bc3.08±0.09Aa300Bc0Bc0Bc0Bc0Bc3.10±0.04Aa
同行(列)數據后無相同大(小)寫字母的表示差異顯著(P<0.05)。下同。
Data followed by different uppercase (lowercase letters) within the same row (column) indicated significant difference (P<0.05). The same as below.
表9疥螨外耳緣部位感染與治療恢復后的評分等級統計結果
Table9Clinical score of infection and degree of recovery of external ear margins in rabbits
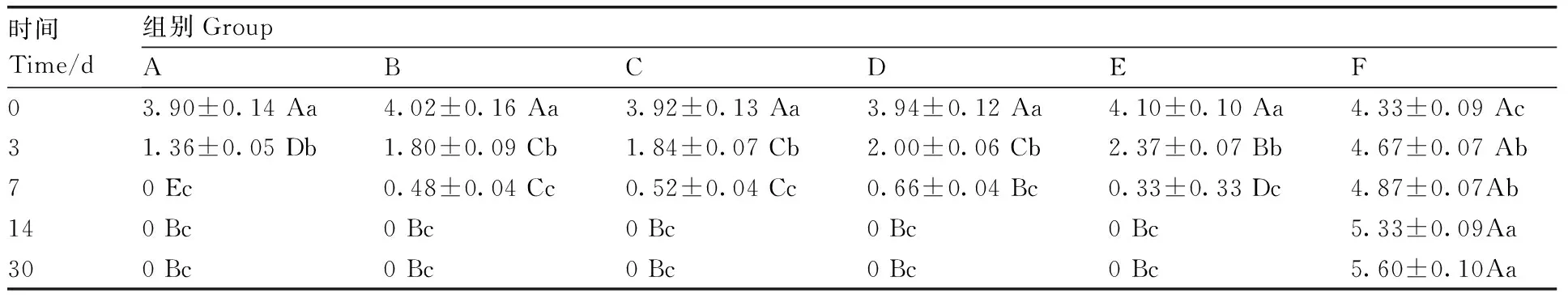
時間Time/d組別GroupABCDEF03.90±0.14Aa4.02±0.16Aa3.92±0.13Aa3.94±0.12Aa4.10±0.10Aa4.33±0.09Ac31.36±0.05Db1.80±0.09Cb1.84±0.07Cb2.00±0.06Cb2.37±0.07Bb4.67±0.07Ab70Ec0.48±0.04Cc0.52±0.04Cc0.66±0.04Bc0.33±0.33Dc4.87±0.07Ab140Bc0Bc0Bc0Bc0Bc5.33±0.09Aa300Bc0Bc0Bc0Bc0Bc5.60±0.10Aa
以往利用高效液相色譜法測定紫莖澤蘭提取液中紫莖澤蘭素A含量的研究報道[30,32-33]中,對于流動相的配比沒有統一明確的結果。本試驗在1.0 mL·min-1流速下,對甲醇∶水(體積比)分別為60∶40、55∶45、50∶50情況下的流動相進行了考查,發現當流動相中甲醇∶水(體積比)=55∶45、流速1.0 mL·min-1洗脫時,色譜峰分離較好,峰形對稱較好,基線平穩,且出峰時間合適。
本研究還對提取溶劑進行了考查。在紫莖澤蘭殺蟲活性的提取溶劑研究中,采用乙醇、石油醚、乙酸乙酯、甲醇等的報道很多[30,34],其中,乙醇提取最常見。從生產成本低和提取溶劑安全性等方面考慮,用乙醇進行提取最合理。從正交試驗結果可知,采用乙醇回流法對紫莖澤蘭中殺螨活性成分進行提取,提取濃度和提取時間對紫莖澤蘭素A提取率的影響較大,提取次數和料液比的影響相對較小。以紫莖澤蘭素A為指標,采用回流提取方法對紫莖澤蘭外用殺螨液進行提取的最佳工藝為:乙醇體積分數95%,料液比1∶20(g·mL-1),每次提取時間1 h,提取次數3次,考查指標提取率為0.281%。該工藝簡單、經濟、可行。
螨類寄生于動物的皮膚表面、表皮及毛囊與皮脂腺內,經皮給藥途徑是動物螨病的治療方式之一。氮酮是目前公認的一種較好的透皮吸收促透劑,它的使用濃度低、促透效果好、無毒、無刺激,能促進大多數疏水性和親水性化合物的透皮吸收。它主要通過加速角質層類脂流動和溶解皮膚的類脂增加藥物透皮吸收,被廣泛應用于外用制劑研究中[35-38]。本試驗首次在紫莖澤蘭的乙醇提取液中加入透皮制劑氮酮,并進行臨床殺螨對比試驗,結果表明,加入氮酮組的臨床治療效果優于未加氮酮組,并且在用藥第3天加氮酮高劑量組(A組)不論是兔癢螨病還是兔疥螨病,治療效果均比其他組好,試驗結果差異顯著。本研究中,皮膚刺激和毒性試驗的結果顯示,氮酮對家兔沒有造成任何危害,尤其是臨床殺螨效果最好的加氮酮高劑量組,對完整皮膚組的靶動物也沒有表現出危害,在破損皮膚組中,外用殺螨液對靶動物有輕度的刺激作用,但也只是在72 h內,72 h之后刺激逐漸消失,并且殺螨液也沒有表現出對破損皮膚組靶動物的毒性作用,更沒有引起破損皮膚因細菌感染引起的膿腫等現象。
參考文獻(References):
[1]張吉麗,李冰,張繼瑜. 動物抗寄生蟲藥物的研究與應用進展[J]. 黑龍江畜牧獸醫,2016,17(9):74-79.
ZHANG J L, LI B, ZHANG J Y. Progress in research and application of animal antiparasitic drugs[J].HeilongjiangAnimalscienceandVeterinaryMedicine, 2016, 17(9):74-79.(in Chinese with English abstract)
[2]王建芬,丁雙陽,王曉琳. 含氟殺蟲劑類農藥的殘留檢測分析研究進展[J]. 中國農學通報,2016,32(2):68-72.
WANG J F, DING S Y, WANG X L. Research progress of analytical and detection methods of fluorine-containing pesticides residues[J].ChineseAgriculturalScienceBulletin, 2016, 32(2):68-72.(in Chinese with English abstract)
[3]邵仁志,劉小安,孫蘭,等. 中國植物源農藥的研究進展[J]. 湖北農業科學,2017,56(8):1401-1405.
SHAO R Z, LIU X A, SUN L, et al. Progresses in botanical pesticides in China[J].HubeiAgriculturalSciences, 2017, 56(8):1401-1405.(in Chinese with English abstract)
[4]程茂高,喬卿梅,魏志華,等. 中藥材倉儲害蟲及其綠色防控技術研究進展[J]. 中藥材,2016,39(8):1917-1921.
CHENG M G, QIAO Q M, WEI Z H, et al. Research progress of Chinese herbal medicine storage pests and green control technology[J].JournalofChineseMedicinalMaterials, 2016, 39(8):1917-1921.(in Chinese)
[5]趙鴻崢,駱驕陽,劉秋桃,等. 藥用植物揮發油驅蚊作用的研究進展[J]. 中國中藥雜志,2016,41(1):28-34.
ZHAO H Z, LUO J Y, LIU Q T, et al. Study on essential oils of medicinal plants in insect repellen[J].ChinaJournalofChineseMateriaMedica, 2016, 41(1):28-34.(in Chinese with English abstract)
[6]REN Q, CAO L Z, SU J W, et al. Volatile emissions from the invasive weedEupatoriumadenophoruminduced byAphisgossypiifeeding and methyl jasmonate treatment[J].WeedScience, 2010, 58(3):252-257.
[7]SHARMA S, MEHTA P K. Evaluation of plant extracts on the oviposition deterrent and adult emergence activities of diamondback moth (Pluiellaxylostella)[J].Pestology. 2006, 30(8):11-13.
[8]劉燕萍, 高平, 潘為高,等. 紫莖澤蘭等幾種植物提取物對兩種農業害螨的毒力作用研究[J]. 四川大學學報(自然科學版),2004, 41(1):212-215.
LIU Y P, GAO P, PAN W G, et al. Effect of several plant extracts onTetranychusucticaeandPanoychus[J].JournalofSichuanUniversity(NaturalScienceEdition), 2004, 41 (1):212-215.(in Chinese with English abstract)
[9]李云壽,鄒華英,佴注,等. 紫莖澤蘭精油各餾分對4種倉庫害蟲的殺蟲活性[J]. 西南農業大學學報(自然科學版),2000,22(4):331-332.
LI Y S, ZOU H Y, NAI Z, et al. Isecticidal acivity of different fractions of essential oils extracted fromEupatoriumadeophorumagainst 4 species of stored grain insects[J].JournalofSouthwestUniversity(NaturalScienceEdition), 2000, 22(4):331-332.(in Chinese with English abstract)
[10]YANG J F, WANG R Q, LV R, et al. Anticoccidial activity ofEupatoriumadenophorumextracts against chicken coccidian oocysts[J].JournalofAnimalandVeterinaryAdvances, 2012, 11(8):1255-1257.
[11]趙平,王榮瓊,楊曉乾,等. 恒溫條件下紫莖澤蘭花、葉提取液對馬圓線蟲蟲卵的孵化試驗[J]. 山東畜牧獸醫,2010,31(11):2-3.
ZHAO P, WANG R Q, YANG X Q, et al. The effect of Eupatorium adenophorum flower and leaf extract on hatching the eggs ofCaenorhabditiselegansunder the condition of constant temperature[J].ShandongJournalofAnimalScienceandVeterinaryMedicine, 2010, 31(11):2-3.(in Chinese)
[12]SHABA P, PANDEY N N, SHARMA O P, et al. Therapeutic activity of methanolic extract ofEupatoriumadenophorumleaves againstTrypanosomaEvansi[J].InternationalJournalofBasicandAppliedMedicalSciences, 2012, 2(1):77-82.
[13]NONG X, FANG C L, WANG J H, et al. Acaricidal activity of extract fromEupatoriumadenophorumagainst thePsoroptescuniculiandSarcoptesscabieiinvitro[J].VeterinaryParasitology, 2012, 187(1/2):345-349.
[14]NONG X, REN Y J, WANG J H, et al. Clinical efficacy of botanical extracts fromEupatoriumadenophorumagainst theSarcoptesscabiei(Sarcoptidae∶Sarcoptes) in rabbits[J].VeterinaryParasitology, 2013, 195(1/2):157-164.
[15]NONG X, REN Y J, WANG J H, et al. Clinical efficacy of botanical extracts fromEupatoriumadenophorumagainst the scab mite,Psoroptescuniculi[J].VeterinaryParasitology, 2013, 192(1/3):247-252.
[16]NONG X, LI S H, WANG J H, et al. Acaricidal activity of petroleum ether extracts fromEupatoriumadenophorumagainst the ectoparasitic cattle mite,Chorioptestexanus[J].ParasitologyResearch, 2014, 113(3):1201-1207.
[17]NONG X, TAN Y J, WANG J H, et al. Evaluation acaricidal efficacy of botanical extract fromEupatoriumadenophorumagainst the hard tickHaemaphysalislongicornis(Acari:Ixodidae)[J].ExperimentalParasitology, 2013, 135(3):558-563.
[18]NONG X, CHEN F Z, YANG Y J, et al. Aphicidal activity of an ageraphorone extract fromEupatoriumadenophorumagainstPseudoregmabambucicola(Homoptera: Aphididae, Takahashi)[J].JournalofInsectScience, 2015, 15(1):81.
[19]郝光榮. 實驗動物學[M]. 2版. 上海:第二軍醫大學出版社,2001:184-185.
[20]中華人民共和國衛生部藥政局. 中藥新藥研究指南(藥學、藥理學、毒理學)[M]. 北京:人民出版社,1994:209-212.
[21]國家食品藥品監督局. 中藥、天然藥藥物研究技術指導原則[M]. 北京:中國醫藥科技出版社,2005:108.
[22]于泓. 皮膚醫學美容學[M]. 北京:中國醫學科技出版社,1997:78-81.
[23]PERRUCCI S, FLAMINI G, CIONI P L, et al.Invitroandinvivoefficacy of extracts ofArtemisiaverlotorumagainstPsoroptescuniculi[J].VeterinaryRecord, 2001, 148(26):814-815.
[24]WALTON S F, CURRIE B J. Problems in diagnosing scabies, a global disease in human and animal populations[J].ClinicalMicrobiologyReviews, 2007, 20(2):268-279.
[25]TABASSAM S M, IQBAL Z, JABBAR A, et al. Efficacy of crude neem seed kernel extracts against natural infestation ofSarcoptesscabieivar.ovis[J].JournalofEthnopharmacology, 2008, 115(2):284-287.
[26]GLANTZ S A. Statistica per discipline biomediche[M]. 5th rev. Milan, Italy: McGraw-Hill, 2003.
[27]RIM I S, JEE C H. Acaricidal effects of herb essential oils againstDermatophagoidesfarinaeandD.pteronyssinus(Acari: Pyroglyphidae) and qualitative analysis of a herbMenthapulegium(pennyroyal)[J].KoreanJournalofParasitology, 2006, 44(2):133-138.
[28]SAS INSTITUTE INC. Base SAS 9.4 Procedures Guide: Statistical Procedures[M]. Cary, NC, USA: SAS Institute Inc, 2014.
[29]OELRICHS P B, CALANASAN C A, MACLEOD J K, et al. Isolation of a compound fromEupatoriumadenophorum, (Spreng.) [Ageratinaadenophora, (Spreng)] causing hepatotoxicity in mice[J].NaturalToxins, 1995, 3(5):350-354.
[30]白潔,曹坳程,郭美霞,等. 紫莖澤蘭9-羰基-10,11-去氫澤蘭酮分布積累動態[J]. 植物學報,2011,46(4):470-475.
BAI J, CAO A C, GUO M X, et al. Identification of 9-oxo-10,11-dehydroagerophorone inEupatoriumadenophorumby high performance liquid chromatography[J].ChineseBulletinofBotany, 2011, 46(4):470-475.(in Chinese)
[31]NONG X, LI S H, CHEN F Z, et al. Isolation and identification of acaricidal compounds inEupatoriumadenophorum,petroleum ether extract and determination of their acaricidal activity againstPsoroptescuniculi[J].VeterinaryParasitology, 2014, 203(1/2):197-202.
[32]HU Y, LIAO F, HU Y, et al. Clinical efficacy of 9-oxo-10,11-dehydroageraphorone extracted fromEupatoriumadenophorumagainstPsoroptescuniculiin rabbits[J].BMCVeterinaryResearch, 2014, 10:970.
[33]LIAO F, HU Y, TAN H, et al. Acaricidal activity of 9-oxo-10, 11-dehydroageraphorone extracted fromEupatoriumadenophorumin vitro[J].ExperimentalParasitology, 2014, 140(1):8-11.
[34]姜少娟,陳豪,李飛. 紫莖澤蘭不同溶劑提取物的抑菌活性[J]. 江蘇農業科學,2013,41(7):124-126.
JIANG S J, CHEN H, LI F. Antibacterial activity of different solvent extracts fromEupatoriumadenophorum[J].JiangsuAgriculturalSciences, 2013, 41(7):124-126.(in Chinese)
[35]LEE P J, LANGER R, SHASTRI V P. Novel microemulsion enhancer formulation for simultaneous transdermal delivery of hydrophilic and hydrophobic drugs[J].PharmaceuticalResearch, 2003, 20(2):264-269.
[36]李國鋒,陳業豪,劉立捷,等. 角質層與活性皮膚層對硝酸異山梨醋透皮吸收的影響[J]. 中國藥師,2002,5(4):199-201.
LI G F, CHEN Y H, LIU L J, et al. Influence of stratum corneum and viable layer of skin on the iransdermal absorption of isosorbide dinitrate[J].ChinaPharmacist, 2002, 5(4):199-201.(in Chinese with English abstract)
[37]曹允,王黎霞,雷莉輝,等. 透皮貼劑在獸藥制劑領域的研究進展[J]. 黑龍江畜牧獸醫,2016(21):70-72.
CAO Y, WANG L X, LEI L H, et al. Research progress of transdermal patches in veterinary drug preparations[J].HeilongjiangAnimalScienceandVeterinaryMedicine, 2016(21):70-72.(in Chinese)
[38]王銳,郭俊華,張遠丹. 皮酚體外透皮吸收研究[J]. 中草藥,2000,31(1):42-44.
WANG R, GUO J H, ZHANG Y D. In vitro study on the transdermal absorption of paeonol[J].ChineseTraditionalandHerbalDrugs, 2000, 31(1):42-44.(in Chinese)
[39]TSAI Y H, LEE K F, HUANG Y B, et al.Invitropermeation and in vivo whitening effect of topical hesperetin microemulsion delivery system[J].InternationalJournalofPharmaceutics, 2010, 388(1/2):257-262.
[40]MOGHIMIPOUR E, SALIMI A, KARAMI M, et al. Preparation and characterization of dexamethasone microemulsion based on pseudoternary phase diagram[J].JundishapurJournalofNaturalPharmaceuticalProducts, 2013, 8(3):105-112.

