海參硫酸軟骨素的熒光標記方法
王 俊,吳反修,常耀光,*,陳 豐,續曉琪
海參硫酸軟骨素(sea cucumber chondroitin sulfates,CHS)是海參體壁的主要組成物質之一,屬于類硫酸軟骨素,具有硫酸軟骨素骨架,但與其他動物組織來源的硫酸軟骨素不同,CHS的結構中還含有硫酸酯化的L-巖藻糖支鏈,是一種新穎的多糖結構[1]。CHS已被證實具有多種生理調節功能,包括抗凝血[2-3]、抗血栓[4]、降血糖[5-7]、抗腫瘤[8]及抗胃潰瘍[9]等,在功能食品開發方面展現出良好的應用潛力[10-12]。多糖類物質普遍缺乏特異的發光或發色基團,這為深入研究多糖的吸收代謝、生理功能機理、生物分子間相互作用等科學問題帶來阻礙[13]。這一情況同樣存在于CHS的研究中。對多糖進行特異性標記是克服上述問題的有效策略,目前常用的標記方法包括同位素標記法、熒光標記法等幾類。相比于同位素標記法,熒光標記法能夠避免放射性危害,且標記產物亦具有良好的檢測靈敏度及特異性[14]。韓章潤等[15]對鯊魚頭骨來源的硫酸軟骨素進行熒光標記,并利用標記產物成功研究了該糖與蛋白質的相互作用。苗本春等[16]實現了海洋硫酸多糖911的熒光標記,并將熒光標記物作用于淋巴細胞和巨噬細胞,以尋找海洋硫酸多糖911的抗體。胡錦珍等[17]用異硫氰酸熒光素對殼聚糖進行標記,通過測定熒光標記物經小鼠口服后在體內各組織中的分布及排泄情況,研究了殼聚糖在動物體內的藥物代謝動力學。
關于CHS的熒光衍生尚鮮見文獻報道。多糖熒光標記需根據多糖的結構特征合理選擇或設計熒光染料及衍生方法。常見的多糖衍生熒光染料包括6-氨基熒光素(6-aminofluorescein,FA)、異硫氰酸熒光素、異硫氰酸羅丹明B等,可以用于連接熒光染料的多糖結構基團包括羥基、氨基、羧基、半縮醛基等,衍生方法包括溴化氰活化法[18-19]、末端還原胺化反應[20-21]、碳酰化反應法[22-24]、1-乙基-3-(3-二甲基氨丙基)-碳化二亞胺/N-羥基琥珀酰亞胺偶聯法[15]、二甲基亞砜/二月桂酸二丁基錫法[25-28]等。溴化氰活化法針對羥基進行衍生,對于多糖類化合物有較好的普適性,且具有操作過程簡單、省時等優點;FA作為熒光素類染料中重要的熒光探針之一,具有高選擇性、高穩定性和高靈敏性的優點。
本研究擬利用溴化氰活化法對CHS的羥基進行活化衍生,進而嘗試以FA對CHS進行標記。通過薄層色譜法(thin layer chromatograph,TLC)及串聯有熒光檢測器與示差檢測器的凝膠排阻高效液相色譜(high performance size exclusion chromatograph coupled with florescence detector and refractive index detector,HPSEC-FLD-RID)對衍生標記前后的多糖進行分析,判斷標記的效果;利用HPSEC-FLD-RID、離子色譜及傅里葉變換紅外光譜,分析標記前后多糖化學組成及結構的變化;進一步考察不同pH值及NaCl濃度環境中標記產物的熒光強度及穩定性,以探討標記產物的適用范圍,旨在實現CHS的熒光標記,以期為該多糖的吸收代謝過程、功能機理、生物分子間相互作用等進一步研究提供有力工具。
1 材料與方法
1.1 材料與試劑
鮮活仿刺參(Apostichopus japonicas)購于青島南山水產市場;CHS按照Xu Xiaoqi等[29]的方法進行提取,海參體壁勻漿后以木瓜蛋白酶進行蛋白酶解,向蛋白酶解液中加入氯化十六烷基吡啶沉淀粗多糖,粗多糖經Express-Ion D離子交換樹脂分離后得到純化的CHS組分。
G60F254硅膠板 德國Merck有限公司;Express-Ion D離子交換樹脂 英國Whatman公司;Sephadex G25凝膠填料美國GE公司;6-氨基熒光素 上海Aladdin有限公司;Dextran系列分子質量標準品(5、12、50、148、410、670、1 400 kDa) 美國Sigma公司;其他試劑購于國藥集團化學試劑有限公司。
1.2 儀器與設備
Nicolet iS10傅里葉變換紅外光譜儀 美國Thermo公司;ICS-2000離子色譜儀 美國Dionex公司;1260高效液相色譜儀 美國Agilent公司;TSK-gel Super AWM-H色譜柱(150 mm×6.0 mm) 日本Tosoh公司;Sephadex G25色譜柱、?KTA prime plus蛋白純化系統 美國GE公司;ALPHA 1-4LD冷凍干燥機 德國Christ公司;F-4600熒光光譜儀 日本日立有限公司;KQ-250DE數控超聲波清洗機 昆山市超聲儀器有限公司;GIS-2008數碼凝膠成像儀 天能科技(上海)有限公司。
1.3 方法
1.3.1 CHS的熒光衍生
以FA為熒光染料,通過共價衍生的方式對CHS進行熒光標記,反應條件及試劑比例如下:將4.0 mL CHS溶液(25 mg/mL)與875 μL溴化氰溶液(85 mg/mL)混合,以0.2 mol/L NaOH溶液調節混合液pH值至11.0,25 ℃振蕩下活化反應15 min,之后超聲處理5 min;利用Sephadex G25色譜柱將反應液中的緩沖液置換為0.2 mol/L pH 8.0 Na2B4O7-H3BO3緩沖液,后續加入17.5 mg FA固體試劑,溶解后25 ℃避光反應12 h;利用Sephadex G25色譜柱將反應物中的緩沖液置換為水,以脫除反應物中的游離FA及鹽,產物真空冷凍干燥后避光保存用于后續分析,記為CHS-FA[30]。
以TLC分析CHS及CHS-FA,從而判斷熒光標記是否成功。TLC分析采用G60F254預制硅膠板,展開劑為正丙醇-水溶液(3∶1,V/V),展開后利用凝膠成像儀在365 nm波長紫外光源的照射下采集熒光信號。
以HPSEC-FLD-RID對比分析CHS及CHS-FA,進一步確證熒光標記的效果。高效液相色譜儀測定條件如下[31-32]:色譜柱為TSK-gel Super AWM-H(150 mm×6.0 mm);流動相為0.2 mol/L NaCl;流速為0.6 mL/min;柱溫30 ℃;熒光檢測器激發波長設為495 nm,發射波長設為520 nm。
以pH 8.0的50 mmol/L Na2HPO4-NaH2PO4緩沖液(含0.1 mol/L NaCl)將FA與CHS-FA樣品分別配制成2 μmol/L和0.1 mg/mL的溶液,利用熒光分光光度計的3D掃描模式對CHS-FA及FA進行全波長掃描,確定CHS-FA最佳激發波長與發射波長,波譜掃描范圍:激發波長450~550 nm,發射波長450~600 nm。
熒光標記物CHS-FA的標記度定義為單位物質量的多糖標記物中含有的FA的物質的量,按照下式進行計算。

式中:CHS-FA中FA的物質的量以CHS-FA在激發波長495 nm和發射波長520 nm處的熒光值進行定量,物質溶解于pH 8.0的50 mmol/L Na2HPO4-NaH2PO4緩沖液(含0.1 mol/L NaCl)中,以FA為標準品制作標準曲線。CHS-FA物質的量以其還原端物質的量表征,還原端的物質的量測定采用3,5-二硝基水楊酸法。
1.3.2 衍生前后樣品的化學組成及結構分析
依據高效凝膠排阻色譜法的原理,根據HPSEC-FLD-RID譜圖中CHS及CHS-FA的洗脫時間計算其分子質量,利用系列分子質量的Dextran標準品(5、12、50、148、410、670、1 400 kDa)建立分子質量與洗脫時間的標準曲線。
以離子色譜法測定衍生前后多糖的SO42-含量[33]。取待測樣品減壓干燥1 d,稱量2~5 mg于安瓿瓶中,加入1 mL 2 mol/L三氟乙酸并封口,于110 ℃下水解10 h。水解完畢后80 ℃揮干三氟乙酸,以超純水定容到25 mL,0.45 μm微孔濾膜過濾后準備上樣。以離子色譜儀測定樣液中的SO42-含量:色譜柱為Ionpac AS11-HC(250 mm×4 mm);保護柱為Ionpac AG11-HC(50 mm×4 mm);柱溫為30 ℃;抑制器為ASRSULTRAⅡ陰離子抑制器(抑制電流50 mA);檢測器為電導檢測器;淋洗液為20 mmol/L KOH溶液;流速1.2 mL/min。以無水NaSO為標準品建立標準曲線標定S24的量,樣品SO24-含量以多糖中SO24-的質量分數表征。
利用傅里葉變換紅外光譜法對衍生前后多糖的結構信息進行對比分析,取1 mg干燥的樣品與KBr均勻混合并壓制成片,以傅里葉變換紅外光譜進行分析,光譜儀參數如下:掃描范圍400~4 000 cm-1,掃描次數64 次,分辨率4.0。
1.3.3 環境因素對CHS-FA熒光強度的影響
將CHA-FA分別溶解于pH 2~12的緩沖液中(pH 2~6使用50 mmol/L Na2HPO4-C6H8O7緩沖液,pH 7~8使用50 mmol/L Na2HPO4-NaH2PO4緩沖液,pH 9~10使用50 mmol/L甘氨酸-NaOH緩沖液,pH 11~12使用50 mmol/L Na2HPO4-NaOH緩沖液),質量濃度為0.01 mg/mL。測定不同pH值條件下CHS-FA的熒光強度(激發波長495 nm、發射波長520 nm),以此考察環境pH值對標記產物熒光強度的影響。樣品在室溫下貯存7 d,每隔24 h進行取樣,測定熒光強度隨時間變化的情況,并利用TLC及HPSEC-FLD-RID對貯存終點樣品進行分析,以考察不同pH值條件下CHS-FA熒光的穩定性。
向CHS-FA溶液(0.01 mg/mL,溶于pH 8.0的50 mmol/L Na2HPO4-NaH2PO4緩沖液)中加入NaCl,調節溶液NaCl濃度為0~2 mol/L,測定不同條件下CHS-FA的熒光強度(激發波長495 nm、發射波長520 nm),以考察NaCl濃度對標記產物熒光強度的影響。樣品在室溫下貯存7 d,每隔24 h進行取樣,測定熒光強度隨時間變化的情況,并利用TLC及HPSEC-FLD-RID對貯存終點樣品進行分析,進而考察不同NaCl濃度條件下CHS-FA熒光的穩定性。
1.4 統計分析
實驗及測試均進行3 次或以上,結果以 ±s表示。實驗數據處理采用SPSS 16.0分析軟件,顯著性差異分析采用Duncan’s ANOVA檢測,以P<0.05作為顯著性差異的判斷標準。
2 結果與分析
2.1 CHS-FA的制備

圖1 CHS及熒光標記反應產物CHS-FA的TLC分析Fig. 1 TLC analysis of fluorescence-labeled CHS and CHS-FA
相對于衍生前多糖CHS,衍生產物CHS-FA的得率為(62.3±4.9)%。TLC分析表明(圖1),未經熒光衍生的原始CHS未表現出熒光,證實其本身缺乏熒光基團;衍生產物CHS-FA呈現可見的熒光,表明經衍生反應后的多糖衍生產物帶有熒光發色物質;同時,CHS-FA的熒光集中在TLC原點位置,與CHS高分子質量多糖的分子特征相符合,并與游離FA熒光染料的遷移率有明顯差異,證明CHS-FA中的熒光物質并非游離FA而是與CHS形成共價結合。TLC分析結果初步證明CHS熒光標記成功。

圖2 CHS及CHS-FA的HPSEC-FLD-RID分析色譜圖Fig. 2 HPSEC-FLD-RID spectra of CHS and CHS-FA

圖3 CHS-FA和FA的3D全波長掃描圖Fig. 3 3D scanning spectra of CHS-FA and FA
如HPSEC-FLD-RID圖譜(圖2)所示,CHS未見熒光信號而標記產物CHS-FA展現出清晰的熒光信號峰;CHS-FA熒光檢測器信號及示差檢測器信號的洗脫時間相符,表明熒光基團與CHS發生結合。上述結果進一步確證熒光衍生過程可賦予CHS熒光發色基團,即成功實現了CHS的熒光標記。
CHA-FA呈現出典型的熒光光譜特性(圖3)。CHS-FA在激發波長為495 nm、發射波長為520 nm的條件下熒光強度最大(圖3A),熒光染料FA的最佳激發波長為490 nm、發射波長為520 nm(圖3B),兩者熒光光譜特征相似。

標記產物CHS-FA的標記度為4.4±0.3,即經衍生后每分子CHS約含4.4分子FA。Glabe等[30]利用FA標記硫酸軟骨素,其標記度為2.9;在Arnosti等[34]研究中,1分子硫酸軟骨素可被1.5分子FA所標記。依據參考文獻[30,34]判斷,CHS的標記度水平合理。標記度過低,標記物的熒光強度不足,不利于后續的觀察分析。而標記度過高,可能導致標記物的結構特征發生明顯變化,從而改變原有功能,為功能機理研究、構效關系研究等帶來干擾。基于此背景,本研究進一步研究了FA衍生對CHS結構的影響。
2.2 熒光衍生對CHS化學組成及結構的影響
如HPSEC-FLD-RID分析色譜圖(圖2B)所示,熒光標記前后的多糖在凝膠排阻色譜柱上的洗脫時間未發生明顯變化,根據洗脫時間計算CHS及CHS-FA的分子質量,測得CHS的分子質量為(58.0±5.2)kDa,CHS-FA的分子質量為(59.4±2.8)kDa,兩者間不存在顯著的統計學差異。上述結果表明,衍生標記前后CHS的分子質量無顯著變化,CHS在衍生過程中未發生明顯降解。根據FA分子的分子質量及CHS-FA的標記率進行理論計算,FA的引入將增加CHS分子質量約1.5 kDa,僅為原始CHS分子質量的2.6%,與實際測定的結果基本吻合。
CHS中富含SO42-,屬于硫酸多糖的一種。現有研究充分表明SO42-對硫酸多糖的空間結構、物化特性(如水溶性、負電性等)以及生理調節功能等分子特征發揮著至關重要的作用,SO42-的脫落可導致某些硫酸多糖喪失抗癌及抗凝血功能[35-36]。利用離子色譜法測得CHS的SO42-質量分數為(22.17±2.41)%,CHS-FA的SO42-質量分數為(22.30±1.48)%,兩者間不存在顯著的統計學差異,表明熒光標記過程中SO42-未發生脫落。
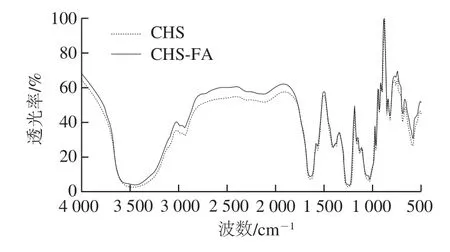
圖4 CHS及CHS-FA紅外光譜圖Fig. 4 Infrared spectra of CHS and CHS-FA
紅外光譜是確認已知化合物結構、比對化合物結構信息的可靠手段。CHS及CHS-FA的紅外光譜圖,其峰形基本相同(圖4),尤其在“指紋區”即500~1 800 cm-1范圍內,譜線基本重疊,表明CHS-FA保持了CHS的結構特征。這一觀察結果與上述分子質量、SO42-的對比分析結果相吻合。然而,FA苯環骨架在1 600 cm-1及1 500 cm-1的振動峰(骨架伸縮振動)等結構特征[37]卻不明顯,可能由于FA基團的量在CHS-FA中不占優勢,導致FA的特征譜帶響應較弱,結構信息被多糖所掩蓋,這一現象與上述CHS-FA標記度的測定結果相吻合。結構是生物大分子展現特定物化特性、發揮生理功能的基礎,CHS在衍生過程中結構特征未發生顯著變化,這有利于后續將CHS-FA應用于CHS的生理功能、消化吸收代謝、相互作用等領域的研究。
2.3 環境因素對CHS-FA熒光強度的影響
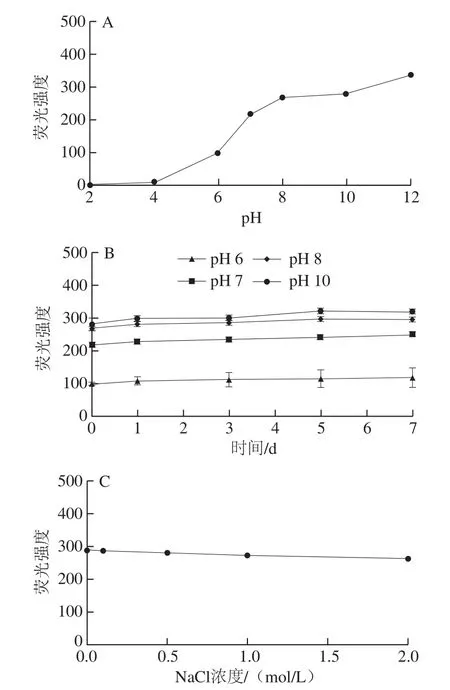

圖5 不同pH值及NaCl濃度對CHS-FA的熒光強度及熒光穩定性的影響Fig. 5 Fluorescence intensity and stability of CHS-FA under different pH and NaCl concentrations
對不同pH值下CHS-FA的熒光強度測定結果表明,隨著溶液pH值的升高,CHS-FA的熒光強度逐漸增大。在中性及堿性的溶液環境中,CHS-FA展現出較強的熒光信號(圖5A),且在7 d內無顯著變化(圖5B)。但在酸性環境(pH≤6)中熒光強度相對較弱。上述結果與文獻報道的pH值對熒光素及其衍生物(FA即是一種熒光素衍生物)的影響結果相一致[38]。熒光素類化合物對pH值變化敏感,當溶液pH值升高時,熒光素及其衍生物的熒光強度增強,原因是熒光素及熒光素衍生物為有機弱酸,當溶液的pH值升高,該弱酸的分子向相應的離子型體轉化,電子構型的改變進而增強了熒光強度[38]。
隨著NaCl濃度的升高,CHS-FA的熒光強度有所降低,但降低的幅度相對有限,當溶液NaCl濃度為2 mol/L時,CHS-FA的熒光強度為0 mol/L NaCl下的91.0%;且在NaCl濃度小于等于1 mol/L的范圍內,CHS-FA的熒光強度無顯著差別,僅存在數值上的差異。在考察的各NaCl濃度下,CHS-FA的熒光強度7 d內均無顯著變化,展現出良好的穩定性。并且,與新鮮配制的CHS-FA溶液(0.01 mg/mL,溶于pH 8.0的50 mmol/L Na2HPO4-NaH2PO4緩沖液)相比,各pH值及NaCl濃度條件下放置7 d后的樣品其TLC及HPSEC-FLD-RID未發生變化,表明在各條件下,CHS-FA未發生降解。
上述結果綜合表明,CHS-FA適用于中性及堿性條件下的熒光觀察及存放,且受NaCl濃度的影響小,提示CHS-FA具有較寬的應用范圍。
3 結 論
本研究成功實現了CHS的熒光標記,證實以FA為熒光染料并配合溴化氫活化法是對CHS進行熒光衍生的有效方式。標記產物CHS-FA標記度為4.4,其最佳熒光激發波長為495 nm、發射波長為520 nm,與FA的特征波長基本相符。分子質量測定、SO24-質量分數測定及傅里葉變換紅外光譜比較分析的結果表明,標記前后多糖的化學組成及結構特征未發生明顯變化。標記產物在中性及堿性環境中展現出較強的熒光強度及穩定性,溶液環境中的NaCl對CHS-FA的影響有限。CHS熒光標記產物的成功制備為今后研究CHS的吸收代謝、功能機理及分子相互作用提供了良好工具,有利于CHS的后續深入研究及進一步開發利用。
參考文獻:
[1] MYRON P, SIDDIQUEE S, AZAD S A. Fucosylated chondroitin sulfate diversity in sea cucumbers: a review[J]. Carbohydrate Polymers,2014, 112(21): 173-178. DOI:10.1016/j.carbpol.2014.05.091.
[2] CHEN S G, HU Y Q, YE X Q, et al. Sequence determination and anticoagulant and antithrombotic activities of a novel sulfated fucan isolated from the sea cucumber Isostichopus badionotus[J]. Biochimica et Biophysica Acta, 2012, 1820(7): 989-1000. DOI:10.1016/j.bbagen.2012.03.002.
[3] LUO L, WU M Y, XU L, et al. Comparison of physicochemical characteristics and anticoagulant activities of polysaccharides from three sea cucumbers[J]. Marine Drugs, 2013, 11(2): 399-417.
[4] POMIN V H. Holothurian fucosylated chondroitin sulfate[J]. Marine Drugs, 2014, 12(1): 232-254.
[5] CHEN S G, LI G Y, WU N, et al. Sulfation pattern of the fucose branch is important for the anticoagulant and antithrombotic activities of fucosylated chondroitin sulfates[J]. Biochimica et Biophysica Acta, 2013,1830(4): 3054-3066. DOI:10.1016/j.bbagen.2013.01.001.
[6] HU S W, CHANG Y G, WANG J F, et al. Fucosylated chondroitin sulfate from sea cucumber in combination with rosiglitazone improved glucose metabolism in the liver of the insulin-resistant mice[J]. Bioscience,Biotechnology, and Biochemistry, 2013, 77(11): 2263-2268. DOI:10.1271/bbb.130529.
[7] 胡世偉, 王靜鳳, 王玉明, 等. 海地瓜巖藻糖基化海參硫酸軟骨素對Ⅱ型糖尿病小鼠胰島素抵抗改善作用的研究[J]. 中國海洋藥物,2014(1): 58-64. DOI:10.13400/j.cnki.cjmd.2014.01.010.
[8] 徐雷雷, 王靜鳳, 李輝, 等. 巖藻糖基化海參硫酸軟骨素抑制腫瘤血管新生作用的研究[J]. 中國海洋藥物, 2012(4): 14-19. DOI:10.13400/j.cnki.cjmd.2012.04.010.
[9] 劉艷青, 李國云, 高焱, 等. 海參硫酸軟骨素對大鼠酒精性胃潰瘍的保護作用[J]. 食品科學, 2011, 32(19): 201-204.
[10] LIU X X, HAO J J, SHAN X D, et al. Antithrombotic activities of fucosylated chondroitin sulfates and their depolymerized fragments from two sea cucumbers[J]. Carbohydrate Polymers, 2016, 152: 343-350.DOI:10.1016/j.carbpol.2016.06.106.
[11] HU X Q, TAO N P, WANG X C, et al. Marine-derived bioactive compounds with anti-obesity effect: a review[J]. Journal of Functional Foods, 2016, 21: 372-387. DOI:10.1016/j.jff.2015.12.006.
[12] SULERIA H A R, GOBE G, MASCI P, et al. Marine bioactive compounds and health promoting perspectives; innovation pathways for drug discovery[J]. Trends in Food Science & Technology, 2016, 50: 44-55. DOI:10.1016/j.tifs.2016.01.019.
[13] 唐惠玲, 陳濤, 王瑩, 等. 蟲草多糖熒光標記的方法學研究[J].藥學與臨床研究, 2010, 18(3): 279-281. DOI:10.3969/j.issn.1673-7806.2010.03.025.
[14] 呂志華. 海洋多糖藥物PS916的熒光標記及其藥代動力學研究[D].青島: 中國海洋大學, 2008: 25-32.
[15] 韓章潤, 王玉峰, 劉鑫, 等. 糖胺聚糖的熒光標記及其與硫酸軟骨素抗體的相互作用[J]. 分析化學, 2011, 39(9): 1352-1357. DOI:10.3724/SP.J.1096.2011.01352.
[16] 苗本春, 耿美玉, 李靜, 等. 海洋硫酸多糖911免疫增強作用的探討[J]. 中國海洋藥物, 2002, 21(5): 1-4. DOI:10.3969/j.issn.1002-3461.2002.05.001.
[17] 胡錦珍, 張家驪, 程沁園, 等. 殼聚糖在小鼠體內的組織分布與排泄[J]. 食品與生物技術學報, 2009, 28(5): 611-615. DOI:10.3321/j.issn:1673-1689.2009.05.006.
[18] ARNOSTI C, KEITH S C, BLOUGH N V. Application of fluorescence spectroscopic techniques and probes to the detection of biopolymer degradation in natural environments[J]. Marine Chemistry, 2000,71(3/4): 321-330. DOI:10.1016/S0304-4203(00)00061-X.
[19] 郝冉, 王正明, 查學強, 等. 霍山石斛多糖的腸黏膜免疫調節活性及在小腸中的吸收分布[J]. 食品科學, 2014, 35(9): 256-259.DOI:10.7506/spkx1002-6630-201409050.
[20] 丁濤. 灰樹花多糖的FITC熒光標記及Caco-2細胞模型對其的吸收與轉運研究[D]. 徐州: 江蘇師范大學, 2014: 19-20.
[21] 李福川, 耿美玉, 李英霞, 等. 海洋硫酸多糖911的熒光標記研究[J].高等學校化學學報, 2002, 23(9): 1704-1708. DOI:10.3321/j.issn:0251-0790.2002.09.011.
[22] 陳忱, 蔡慧珍, 唐華麗, 等. 枸杞多糖的組成分析及其熒光標記研究[J].時珍國醫國藥, 2014(10): 2312-2315.
[23] 范妮, 薛偉明. 殼聚糖熒光標記反應研究[J]. 云南大學學報(自然科學版), 2010, 32(1): 77-81.
[24] 賀繼東, 夏文水. 異硫氰酸熒光素標記殼聚糖的研究[J]. 安徽農業科學, 2007, 35(34): 10939-10940. DOI:10.3969/j.issn.0517-6611.2007.34.001.
[25] HEILIG A, G?GGERLE A, HINRICHS J. Multiphase visualisation of fat containing β-lactoglobulin-κ-carrageenan gels by confocal scanning laser microscopy, using a novel dye, V03-01136, for fat staining[J].Food Science & Technology, 2009, 42(2): 646-653. DOI:10.1016/j.lwt.2008.08.006.
[26] MATIGNON A, MOULIN G, BAREY P, et al. Starch/carrageenan/milk proteins interactions studied using multiple staining and confocal laser scanning microscopy[J]. Carbohydrate Polymers, 2014, 99(1): 345-355.DOI:10.1016/j.carbpol.2013.09.002.
[27] Nú?EZ-SANTIAGO M C, TECANTE A, GARNIER C, et al. Rheology and microstructure of κ-carrageenan under different conformations induced by several concentrations of potassium ion[J]. Food Hydrocolloids, 2011, 25(1): 32-41. DOI:10.1016/j.foodhyd.2010.05.003.
[28] PERRECHIL F A, CUNHA R L. Stabilization of multilayered emulsions by sodium caseinate and κ-carrageenan[J]. Food Hydrocolloids, 2013,30(2): 606-613. DOI:10.1016/j.foodhyd.2012.08.006.
[29] XU Xiaoqi, XUE Changhu, CHANG Yaoguang, et al. Conformational and physicochemical properties of fucosylated chondroitin sulfate from sea cucumber Apostichopus japonicus[J]. Carbohydrate Polymers, 2016,152: 26-32. DOI:10.1016/j.carbpol.2016.06.061.
[30] GLABE C G, HARTY P K, ROSEN S D. Preparation and properties of fluorescent polysaccharides[J]. Analytical Biochemistry, 1983, 130(2):287-294.
[31] 羅立. 當歸多糖ASP1體內外特異性肝靶向研究[D]. 武漢: 華中科技大學, 2012: 28-29.
[32] 蘇玲, 胡靜, 李雨婷, 等. 樹舌熒光多糖的制備及在小鼠脾淋巴細胞中的定位[J]. 中國農業大學學報, 2013, 18(1): 147-152.
[33] 李國云, 尹利昂, 陳士國, 等. 海參多糖硫酸根含量的離子色譜法測定及其差異分析[J]. 食品工業科技, 2011, 32(7): 403-406.DOI:10.13386/j.issn1002-0306.2011.07.023.
[34] ARNOSTI C. Fluorescent derivatization of polysaccharides and carbohydrate-containing biopolymers for measurement of enzyme activities in complex media[J]. Journal of Chromatography B, 2003,793(1): 181-191. DOI:10.1016/S1570-0232(03)00375-1.
[35] MARUYAMA T, TOIDA T, IMANARI T, et al. Conformational changes and anticoagulant activity of chondroitin sulfate following its O-sulfonation[J]. Carbohydrate Research, 1998, 306(1/2): 35-43.DOI:10.1016/S0008-6215(97)10060-X.
[36] 閆亞美, 冉林武, 劉蘭英, 等. 硫酸酯化多糖生物活性及其構效關系研究進展[J]. 安徽農業科學, 2009, 37(24): 11374-11375. DOI:10.3969/j.issn.0517-6611.2009.24.017.
[37] 潘惠英, 葛鳳燕, 陳立功. 氨基熒光素的合成、分離和表征[J]. 應用化學, 2006, 23(2): 193-197. DOI:10.3969/j.issn.1000-0518.2006.02.018.
[38] 鄧櫻花, 曾琴. 熒光素及其衍生物的熒光性質研究[J]. 華中師范大學學報(自然科學版), 2010, 44(3): 443-447.

