蒸制過程中大菱鲆肌肉理化特性、組織結(jié)構(gòu)及蛋白特性變化
傅新鑫,王 垚,李德陽,姜鵬飛,劉文濤,梁 峻,祁立波,董秀萍,*
加熱是肉類加工和食用的主要方式,適當(dāng)?shù)臒崽幚砜梢再x予產(chǎn)品良好的色澤,并且可以殺滅微生物,提升產(chǎn)品品質(zhì)。傳統(tǒng)的加熱方式有蒸、煮、微波、烘烤等,不同的加熱方式會(huì)對(duì)肌肉品質(zhì)造成不同的影響。Yarmand等[1]研究烤、燉、微波加熱的方式對(duì)駱駝肉品質(zhì)的影響,發(fā)現(xiàn)微波方式下肌肉的剪切力最大,燉的方式對(duì)肌束膜的損傷最嚴(yán)重。García-Segovia等[2]研究牛肉在常壓、真空低溫、真空蒸煮等條件下的品質(zhì)變化,發(fā)現(xiàn)不同處理?xiàng)l件下的牛肉組織結(jié)構(gòu)變化明顯不同。董志儉等[3]研究南美白對(duì)蝦在蒸制過程中水分和質(zhì)構(gòu)的變化,發(fā)現(xiàn)蝦肉蒸制不同時(shí)間其質(zhì)構(gòu)明顯不同,自由水的損失會(huì)影響質(zhì)構(gòu)的變化。可見,不同來源的肌肉需要選擇適宜的加工方式和加工條件,才能最大限度地保持其營(yíng)養(yǎng)、口感和外觀。
大菱鲆(Scophthalmus maximus L.)屬硬骨魚綱,鰈形目,鲆科,菱屬,主要養(yǎng)殖區(qū)域集中于山東、遼寧、河北等沿海地區(qū)。近年來,隨著養(yǎng)殖技術(shù)日趨成熟,養(yǎng)殖產(chǎn)量逐漸攀升,2015年我國(guó)鲆魚養(yǎng)殖產(chǎn)量高達(dá)13萬 t。目前,專家學(xué)者對(duì)大菱鲆的研究主要集中在基因[4-5]、疾病[6-7]、育種[8]、優(yōu)化養(yǎng)殖[9]、飼料配比[10-11]等方面,主要著眼點(diǎn)仍在于如何擴(kuò)大養(yǎng)殖產(chǎn)量,推進(jìn)養(yǎng)殖技術(shù)的發(fā)展,對(duì)于加工利用的研究相對(duì)較少。部分學(xué)者研究了油炸工藝[12]和熏制工藝[13]下大菱鲆魚肉感官的變化情況,以及腌制工藝[14]下其理化指標(biāo)的變化情況。吳瓊等[15]開展了不同熟化方式(烤制、油炸、微波、蒸制、真空隔水加熱)對(duì)大菱鲆質(zhì)量損失率、色度、質(zhì)構(gòu)、組織結(jié)構(gòu)、感官影響的對(duì)比研究,發(fā)現(xiàn)蒸制是最適合大菱鲆的加工方式,但尚未系統(tǒng)考察蒸制時(shí)間對(duì)大菱鲆品質(zhì)的影響。還有一些學(xué)者研究了鯉魚[16]、金槍魚[17]、武昌魚[18]等在蒸制過程中的品質(zhì)變化,但不同品種的魚在蒸制過程中的品質(zhì)變化及最適宜的加工條件也不盡相同。大菱鲆作為高蛋白低脂肪的優(yōu)質(zhì)海魚,富含氨基酸、維生素和礦物質(zhì),且肉質(zhì)鮮美,口感嫩滑,適宜的加工方式和條件有利于保留營(yíng)養(yǎng)物質(zhì),降低由于蛋白質(zhì)變性、脂肪酸降解等導(dǎo)致的肌肉加工品品質(zhì)的劣化。因此,本研究考察大菱鲆肌肉蒸制過程中理化指標(biāo)、組織結(jié)構(gòu)、蛋白特性的變化,探尋適宜的加工條件,為大菱鲆的精深加工和中餐工業(yè)化利用提供參考和理論依據(jù)。
1 材料與方法
1.1 材料與試劑
大菱鲆原料魚購于遼寧省大連市長(zhǎng)興水產(chǎn)市場(chǎng),魚體長(zhǎng)(37.2±1.7)cm,質(zhì)量(962.3±78.7)g。活魚采用碎冰覆蓋方式運(yùn)送至實(shí)驗(yàn)室,打頭致死,取上背部肌肉,去皮待用。
考馬斯亮藍(lán)G250 索萊寶科技有限公司;牛血清白蛋白 瑞士Fluka公司;氯胺T(分析純) 天津市光復(fù)精細(xì)化工研究所;高氯酸(優(yōu)級(jí)純) 天津政成化學(xué)制品有限公司;對(duì)二甲基氨基苯甲醛(分析純) 天津傲然精細(xì)化工研究所;VG染液 北京雷根生物技術(shù)有限公司;超微量ATP酶(Ca2+Mg2+)試劑盒、總巰基試劑盒 南京建成生物工程研究所;其他試劑均為國(guó)產(chǎn)分析純。
1.2 儀器與設(shè)備
TA.XT質(zhì)構(gòu)儀 英國(guó)Stable Micro Systems公司;UltraScan PRO測(cè)色儀 美國(guó)HunterLab公司;TP1020自動(dòng)脫水機(jī)、RM2245石蠟包埋機(jī)、EG1150C石蠟切片機(jī)德國(guó)Leica公司;冷凍離心機(jī) 美國(guó)Thermo Fisher公司;M200酶標(biāo)定量測(cè)定儀 瑞士Tecan Infinite公司。
1.3 方法
1.3.1 蒸制方法
沿大菱鲆主骨方向,將去皮魚片切成1.5 cm×1.5 cm×1.0 cm規(guī)格的魚塊,置于玻璃皿中,覆蓋保鮮膜,于充滿蒸汽的蒸鍋中分別加熱2、4、6、8、10 min,迅速放入冰盒中冷卻10 min后取出,測(cè)試相關(guān)指標(biāo)。
1.3.2 肌原纖維蛋白相對(duì)提取率
分別稱取新鮮及蒸制后的大菱鲆魚肉2 g,參照Niamnuy[19]和藍(lán)尉冰[20]等的方法提取肌原纖維蛋白。參照袁道強(qiáng)等[21]的方法測(cè)定蛋白濃度。以新鮮大菱鲆肉的提取率為100%,計(jì)算蒸制后大菱鲆魚肉肌原纖維蛋白的相對(duì)提取率。
1.3.3 失水率及質(zhì)量損失率
參照孫麗等[17]的方法測(cè)定魚塊的蒸制失水率及質(zhì)量損失率,參照Dong Xiuping等[22]的方法測(cè)定樣品的水分含量,質(zhì)量損失率按式(1)計(jì)算,失水率按式(2)計(jì)算。
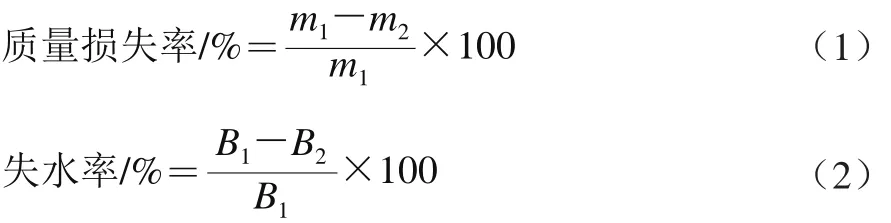
式中:m1為試樣蒸制前質(zhì)量/g;m2為試樣蒸制后質(zhì)量/g;B1為未蒸制試樣水分含量/(g/100 g);B2為蒸制后試樣水分含量/(g/100 g)。
1.3.4 粗脂肪含量的測(cè)定
根據(jù)GB/T 5009.6—2003《食品中脂肪的測(cè)定》方法測(cè)定[23]。
1.3.5 羥脯氨酸含量測(cè)定
取1 mL蒸制流失液,參照ISO 3496標(biāo)準(zhǔn)[24]繪制羥脯氨酸標(biāo)準(zhǔn)曲線,按照羅鳳連等[25]的方法對(duì)蒸制流失液進(jìn)行測(cè)定。
1.3.6 色度測(cè)定
使用色度測(cè)試儀檢測(cè)新鮮及蒸制不同時(shí)間魚塊,使用中孔徑反射進(jìn)行測(cè)定,測(cè)試近骨一端,采用三點(diǎn)測(cè)試法進(jìn)行測(cè)試,觀察L*、a*及b*值的變化。L*表示亮度,L*值為正值表示顏色偏白,L*值為負(fù)值表示顏色偏黑。C*按公式(3)計(jì)算。

式中:a*表示紅綠值,a*值為正值表示顏色偏紅色,a*值為負(fù)值表示顏色偏綠色;b*表示黃藍(lán)值,b*值為正值表示顏色偏黃色,b*值為負(fù)值表示顏色偏藍(lán)色;C*表示顏色的深淺,C*值越大表示顏色越深,反之,表示顏色越淺。
1.3.7 質(zhì)構(gòu)特性測(cè)定
1.3.7.1 剪切力測(cè)定
探頭型號(hào)HDP/BS,測(cè)試前速率1 mm/s,測(cè)試中速率1 mm/s,測(cè)試后速率10 mm/s,數(shù)據(jù)收集由計(jì)算機(jī)軟件完成。
1.3.7.2 質(zhì)構(gòu)測(cè)試
探頭型號(hào)P50,測(cè)試前速率2 mm/s,測(cè)試中速率1 mm/s,測(cè)試后速率1 mm/s,壓縮程度60%,時(shí)間間隔5 s,壓縮2 次,數(shù)據(jù)收集由計(jì)算機(jī)軟件完成。
1.3.8 蛋白相對(duì)含量測(cè)定
采用考馬斯亮藍(lán)染色法進(jìn)行十二烷基硫酸鈉-聚丙烯酰胺凝膠電泳(sodium dodecyl sulfate-polyacrylamide gelelectrophoresis,SDS-PAGE),使用分離膠質(zhì)量分?jǐn)?shù)為12%,濃縮膠質(zhì)量分?jǐn)?shù)為5%。上樣后先采用8~15 mA電泳電流,樣品進(jìn)入濃縮膠后提高到15~30 mA,電泳時(shí)間2 h左右。電泳完畢后,染色,脫色,直至有清晰的條帶出現(xiàn)后,使用凝膠成像儀分析結(jié)果。
1.3.9 魚塊組織結(jié)構(gòu)觀察
參照劉世新[26]的方法制作石蠟組織切片。將處理后的肌肉切成0.5 cm×0.5 cm×0.2 cm的小塊,依次進(jìn)行固定、梯度乙醇脫水、透明、浸蠟、包埋、切片、展片、撈片、脫蠟等步驟。
采用苦味酸-酸性品紅染色法,基本步驟為將復(fù)紅染液和PA溶液按1∶9(V/V)的比例混合后染色組織切片7 min,然后用去離子水沖洗,用濾紙吸干載玻片上組織塊周圍的水分,再依次放入無水乙醇、二甲苯中各浸泡10 min,組織塊晾干后置于光學(xué)顯微鏡下觀察并拍照。
1.3.10 魚塊Ca2+Mg2+-ATPase活力測(cè)定
按照超微量ATP酶(Ca2+Mg2+)試劑盒說明書進(jìn)行測(cè)定。
1.3.11 魚塊總巰基含量測(cè)定
按照總巰基試劑盒說明書進(jìn)行測(cè)定。
1.4 數(shù)據(jù)處理
采用SPSS 19.0中One-way ANOVA 模型進(jìn)行顯著性分析。
2 結(jié)果與分析
2.1 蒸制不同時(shí)間大菱鲆魚塊理化特性的變化
2.1.1 蒸制不同時(shí)間大菱鲆魚塊理化指標(biāo)含量的變化
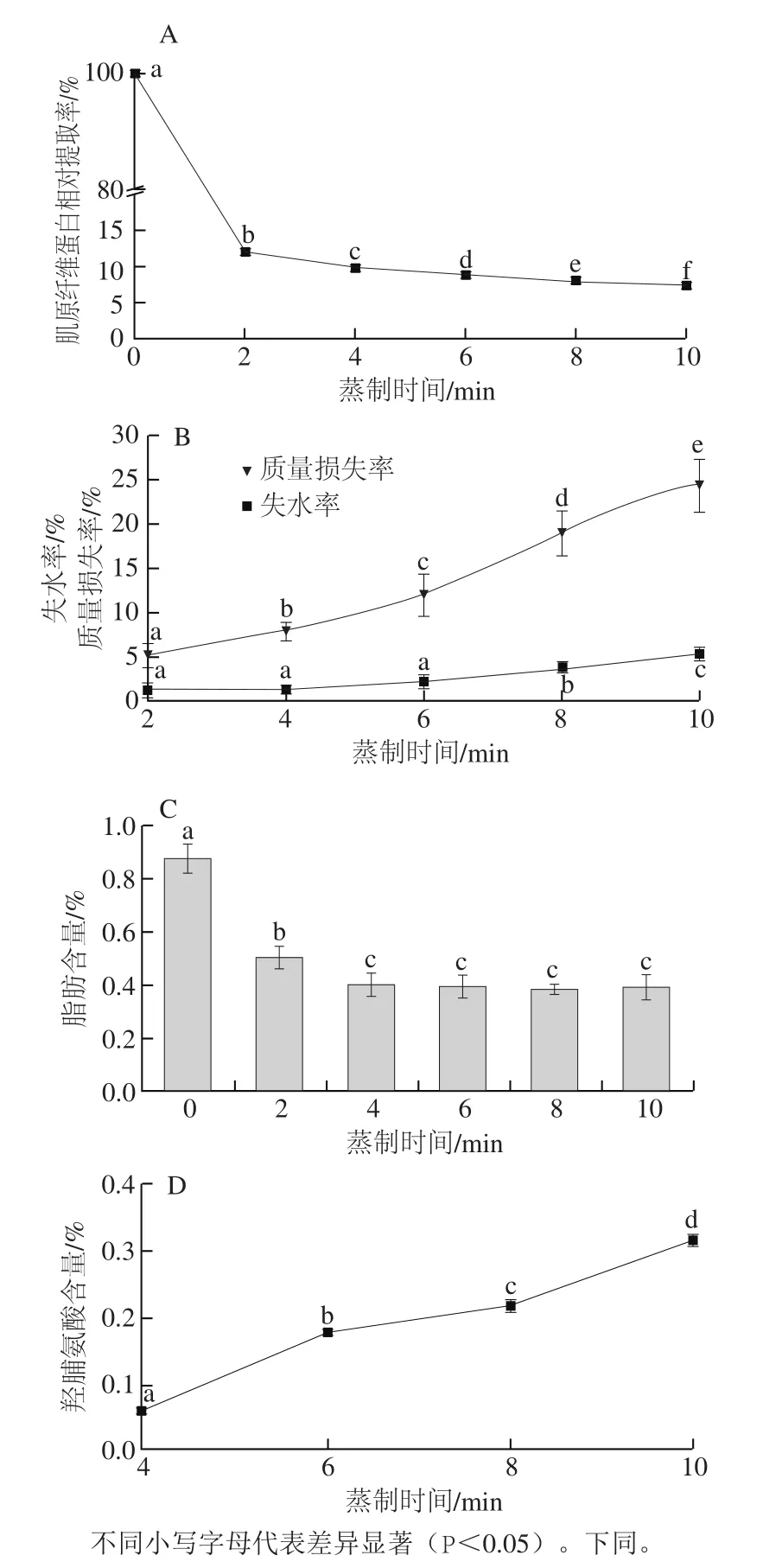
圖1 蒸制過程中大菱鲆魚塊肌原纖維蛋白相對(duì)提取率(A)、失水率和質(zhì)量損失率(B)、脂肪含量(C)及流失液羥脯氨酸含量(D)的變化Fig. 1 Changes in relative extraction rate of myofibrilar protein (A),water loss rate, mass loss rate (B), crude fat (on a wet basis) content (C) in turbot cubes and total thiol group content in exudate (D) during steaming
由圖1A可知,蒸制過程中肌原纖維蛋白相對(duì)提取率不斷降低,蒸制前2 min相對(duì)提取率迅速下降到12%,加熱4 min時(shí)低于10%,此時(shí)魚塊達(dá)到熟化態(tài)[27]。蒸制初期,肌原纖維蛋白由于受熱變性使得肌原纖維蛋白相對(duì)提取率迅速降低,繼續(xù)加熱,肌原纖維蛋白降解加劇,同時(shí)魚塊組織出現(xiàn)變形。隨著蒸制時(shí)間延長(zhǎng),肌束膜受熱破損并逐漸加劇,肌原纖維蛋白從肌纖維間逐漸流失到組織外,這應(yīng)該也是導(dǎo)致肌原纖維蛋白相對(duì)提取率持續(xù)下降的原因。
由圖1B可知,蒸制過程中,大菱鲆魚塊的質(zhì)量損失率和失水率均呈現(xiàn)上升趨勢(shì),其變化速率均先上升再下降,在蒸制8 min時(shí)均達(dá)到最大值,分別為3.62%/min和0.86%/min,整個(gè)蒸制過程中質(zhì)量損失率明顯高于失水率。肌纖維及結(jié)締組織受熱后會(huì)發(fā)生收縮、拉伸變化,從而導(dǎo)致肌肉外形的變化,并伴有汁液流失,且受熱時(shí)間越長(zhǎng),汁液流失越多,外形變化也越大。肌肉受熱過程中流失的汁液中包括水分、變性的蛋白質(zhì)和脂肪[28],因此,質(zhì)量損失率要高于失水率。蒸制初期,魚塊表層蛋白質(zhì)發(fā)生變性,肌原纖維蛋白含量不斷降低,繼續(xù)加熱,魚塊受熱外形發(fā)生變化,縮短了魚塊中心至表面的距離,從而提高了汁液流失速率[17],蒸制至8 min時(shí),魚塊變形最嚴(yán)重,此時(shí)的質(zhì)量損失率和失水率的變化速率也最快。因此,為了避免營(yíng)養(yǎng)的流失及組織形狀變化過大,大菱鲆魚塊的蒸制時(shí)間應(yīng)不超過8 min。
由圖1C可知,新鮮魚塊中脂肪含量較低,僅為(0.88±0.05)%,在蒸制2 min時(shí)顯著降低(P<0.05),蒸制4 min后沒有顯著變化(P>0.05);這可能是由于脂肪受熱到一定程度后同流失液一起流失到組織外,而由于季節(jié)、魚體大小的不同,不同魚塊的脂肪含量也會(huì)有所不同。
由圖1D可知,蒸制過程中,大菱鲆魚塊的蒸制流失液中羥脯氨酸含量不斷升高,羥脯氨酸是膠原蛋白的特異性氨基酸,其含量變化可以反映膠原蛋白的含量變化;因此,隨著蒸制時(shí)間的延長(zhǎng),大菱鲆魚塊的膠原蛋白的流失量在不斷升高。從圖2可以看出,魚塊在蒸制4 min時(shí)其肌束膜緊密程度降低,在蒸制8 min時(shí)肌束膜不斷溶解;因此推測(cè)可能是高溫加熱使結(jié)締組織不斷溶解,導(dǎo)致了魚塊的膠原蛋白不斷變性溶出[29]。
2.1.2 蒸制不同時(shí)間大菱鲆魚塊色度、質(zhì)構(gòu)的變化
由表1可知,與新鮮樣品相比,蒸制2 min時(shí)魚塊的L*值迅速上升,亮度增加,蒸制4 min后變化不大,亮度趨于穩(wěn)定。研究表明,當(dāng)球蛋白構(gòu)象破壞,亞鐵血紅素氧化被取代后,可造成L*值增大[30]。蒸制過程中魚塊的a*值呈現(xiàn)先迅速下降,后趨于平穩(wěn)的趨勢(shì)。研究表明,當(dāng)亞鐵肌紅蛋白被氧化成高鐵肌紅蛋白時(shí),會(huì)導(dǎo)致a*值顯著下降(P<0.05),且熱處理過程導(dǎo)致的VE、色氨酸等營(yíng)養(yǎng)素?fù)p失也會(huì)使肉色度下降[30]。蒸制過程中,魚塊的b*值先升高再降低,其中6 min時(shí)b*值最大,可能因?yàn)槭軣岢跗谥救廴冢瑢?dǎo)致b*值升高,隨著受熱時(shí)間延長(zhǎng),肌纖維蛋白變性收縮,束縛了脂肪,b*值下降[31]。顏色飽和度C*值呈上升趨勢(shì),但變化不顯著(P>0.05),可見加熱有助于加深肉色,使肉顏色更鮮亮,但大菱鲆魚肉是白肉,所以加熱后其主要變化是亮度變化,即肉色變白,而不是飽和度變化,因此飽和度變化不顯著(P>0.05)。
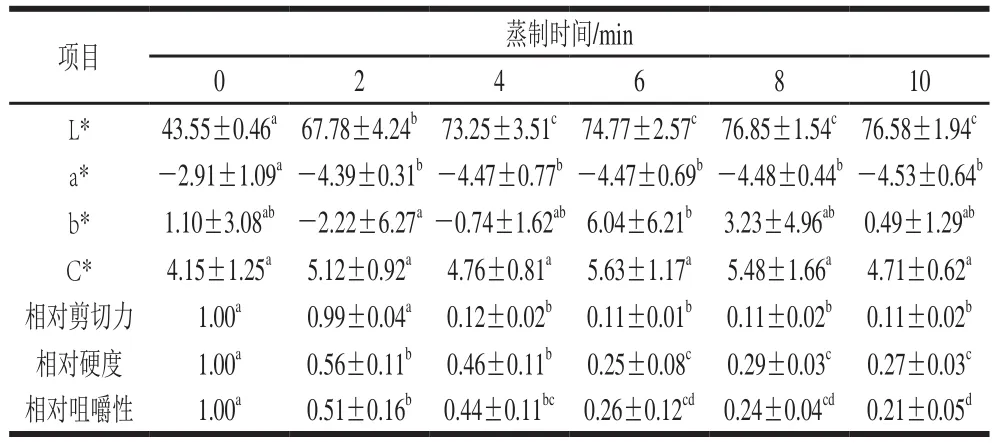
表1 蒸制過程中大菱鲆魚塊色度、質(zhì)構(gòu)的變化Table 1 Changes in color and texture of turbot cubes during steaming
肉制品在加熱過程中,肌原纖維蛋白和結(jié)締組織是影響肉制品剪切力的兩大因素,加熱過程中,二者的張力發(fā)生變化,從而影響剪切力的變化。從表1可以看出,隨著加熱時(shí)間的延長(zhǎng),大菱鲆魚塊的剪切力顯著下降(P<0.05),其中新鮮和蒸制2 min樣品的剪切力沒有顯著性差異(P>0.05),可能是由于蒸制2 min時(shí),魚塊受熱時(shí)間較短,魚塊中心部位的肌肉纖維還沒有熟化,使得魚塊仍保有初始剪切力值。蒸制2~4 min的魚塊剪切力顯著降低(P<0.05),可能是此時(shí)的肌原纖維蛋白含量顯著降低(P<0.05),且肌纖維發(fā)生收縮導(dǎo)致。蒸制4 min后,魚塊剪切力變化不明顯。研究表明,加熱過程中肌肉組織中維系蛋白質(zhì)分子結(jié)構(gòu)的各種共價(jià)鍵和非共價(jià)鍵逐漸出現(xiàn)斷裂,一般在30~32 ℃時(shí),肌原纖維蛋白失去高級(jí)結(jié)構(gòu),開始溶解,在50~60 ℃時(shí),膠原蛋白開始變性,致使膠原纖維收縮,這些蛋白質(zhì)的熱變性會(huì)導(dǎo)致剪切力的變化[32]。
肉的硬度與其肌原纖維蛋白和膠原蛋白的性質(zhì)和比例有關(guān)。大菱鲆魚塊在蒸制過程中硬度和咀嚼性降低,可能是肌原纖維蛋白變性、結(jié)締組織收縮及肌動(dòng)球蛋白脫水收縮共同作用的結(jié)果[33]。
2.2 蒸制不同時(shí)間大菱鲆魚塊組織結(jié)構(gòu)的變化

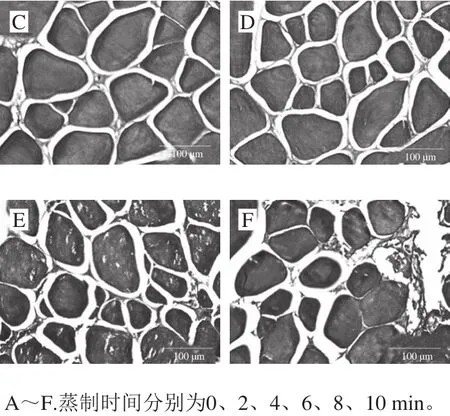
圖2 蒸制過程中大菱鲆魚塊組織結(jié)構(gòu)觀察(200×)Fig. 2 Microstructural change of turbot cubes during steaming (200 ×)
由圖2可知:宰殺后的大菱鲆魚塊的組織略微松散;蒸制2 min,魚塊的肌纖維受熱膨脹,組織緊密程度有所提高,肌束膜完整并緊密地包裹著肌纖維;蒸制4 min時(shí)肌纖維開始收縮,肌束膜連接的緊密程度降低;蒸制6 min時(shí)包裹的肌束膜的緊密性更弱;蒸制8 min時(shí)肌纖維斷裂在橫切面產(chǎn)生孔洞,肌束膜破損,結(jié)締組織液體化,隨水分流出[29];蒸制10 min時(shí)肌束膜破損更加嚴(yán)重。肌束膜的主要成分是膠原蛋白,這與圖1D的流失液羥脯氨酸含量所反映的肌肉膠原蛋白流失含量的變化趨勢(shì)相同。魚塊肌纖維在蒸制4 min時(shí)開始收縮變細(xì),而此時(shí)的魚塊的剪切力也降至較低值,可見肌纖維的直徑對(duì)魚塊的剪切力影響較大。
2.3 蒸制對(duì)大菱鲆魚塊和流失液蛋白質(zhì)的影響
2.3.1 蒸制對(duì)大菱鲆魚塊Ca2+Mg2+-ATPase活力、總巰基含量的影響
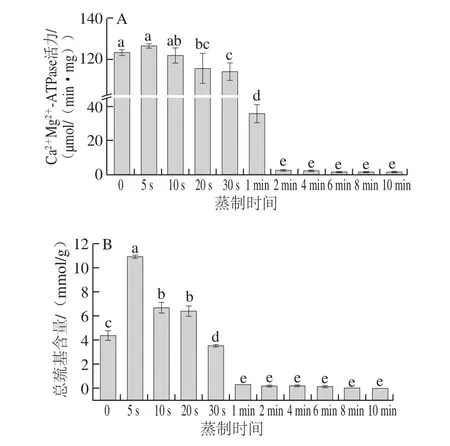
圖3 蒸制不同時(shí)間大菱鲆魚塊Ca2+Mg2+-ATPase活力(A)、總巰基含量(B)的變化Fig. 3 Changes in Ca2+Mg2+-ATPase activity (A) and total sulfhydryl content (B) in turbot cubes during steaming
Ca2+-ATPase是肌球蛋白的活性頭部,其活性的變化可以反映肌原纖維蛋白的變性情況。圖3A中可看出,隨著蒸制時(shí)間的延長(zhǎng),Ca2+Mg2+-ATPase活力先小幅升高然后緩慢下降,蒸制2 min時(shí)酶活力達(dá)到最低點(diǎn)且之后無顯著性變化(P>0.05)。由于蛋白質(zhì)之間存在氫鍵、二硫鍵等作用力,受熱后,維持蛋白質(zhì)構(gòu)象的作用力被破壞,改變了蛋白質(zhì)原有構(gòu)象,進(jìn)一步加熱后,蛋白質(zhì)的活性部位遭到破壞,導(dǎo)致酶活力下降。蒸制5 s時(shí),酶活力略有升高,可能是蛋白質(zhì)構(gòu)象在受熱初期發(fā)生聚集而引起的暫時(shí)性升高[34]。Ogawa等[35]研究鯉魚肌球蛋白熱穩(wěn)定性時(shí),發(fā)現(xiàn)加熱到30 ℃時(shí)鯉魚的肌球蛋白結(jié)構(gòu)開始發(fā)生變化,而大菱鲆魚塊在蒸制30 s時(shí)中心溫度約為55 ℃[36],由于疏水氨基酸和巰基的共同作用,其酶活力開始下降,而蒸制1 min時(shí)中心溫度已高于70 ℃[36],隨后酶活力大幅度下降,說明此時(shí)的肌球蛋白活性頭部已被完全破壞。這與圖1A所示的肌原纖維蛋白相對(duì)提取率的變化趨勢(shì)相同。
由圖3B可以看出,隨著蒸制時(shí)間的延長(zhǎng),總巰基含量先大幅升高后不斷下降,最后趨于穩(wěn)定。這是由于受熱初期,魚塊中蛋白質(zhì)間部分作用力被破壞,暴露了部分活性巰基,使總巰基含量增加,之后由于溫度不斷升高,蛋白質(zhì)發(fā)生交聯(lián),生成二硫鍵,使得總巰基含量減少[34]。潘錦鋒等[34]在研究草魚肌原纖維蛋白熱穩(wěn)定性時(shí)發(fā)現(xiàn)草魚肌肉的總巰基含量在40 ℃開始減少,60~70 ℃大幅降低,而大菱鲆魚塊在蒸制15 s和1 min時(shí),其中心溫度分別達(dá)到39.9 ℃和75.4 ℃[36]。從圖3B可以看出,大菱鲆魚塊的總巰基含量在蒸制10 s后顯著下降(P<0.05),在蒸制1 min時(shí)大幅降低,這與潘錦鋒等[34]的研究結(jié)果一致。
2.3.2 蒸制不同時(shí)間大菱鲆魚塊肌原纖維蛋白和流失液的SDS-PAGE變化
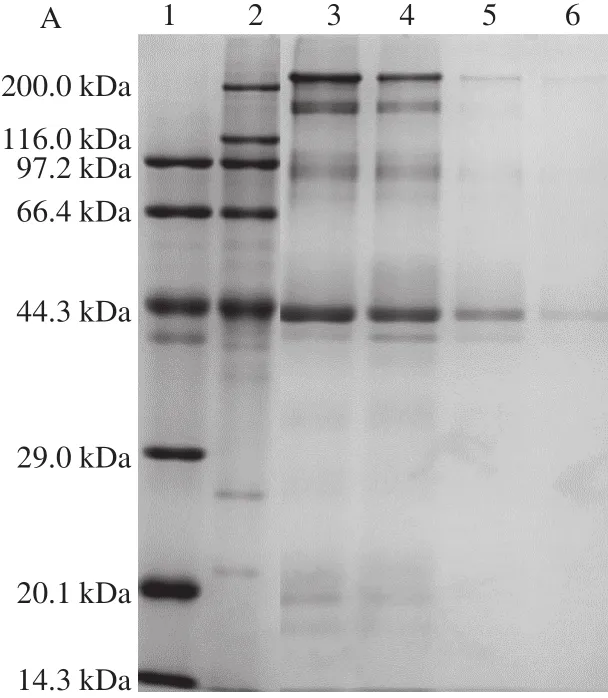
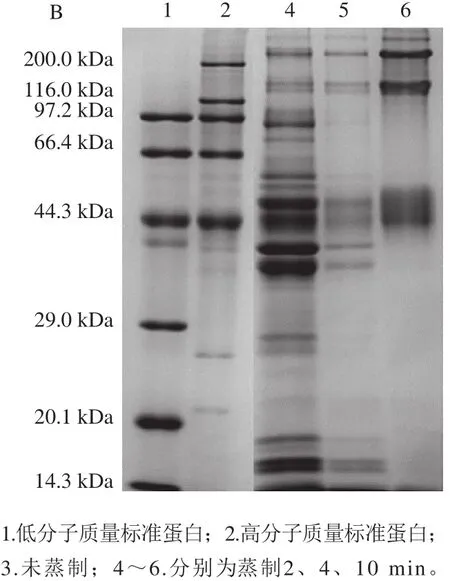
圖4 蒸制不同時(shí)間大菱鲆魚塊的肌原纖維蛋白(A)和流失液(B)的SDS-PAGE圖譜Fig. 4 SDS-PAGE of myofibrilar proteins (A) and exudate (B) in turbot cubes subjected to different steaming times
肌球蛋白是肌原纖維的主要組成部分[37]。如圖4A所示,從未蒸制和蒸制不同時(shí)間的魚塊中提取出的肌原纖維蛋白中,包括兩種主要的蛋白條帶,即肌球蛋白重鏈和肌動(dòng)蛋白。新鮮和蒸制2 min的肌原纖維蛋白的電泳圖譜中隱約看到肌球蛋白輕鏈和一些小分子蛋白;隨著蒸制時(shí)間的延長(zhǎng),魚塊肌原纖維蛋白中的各種蛋白均在減少,部分小分子蛋白消失。加熱過程中,魚塊流失液中的蛋白質(zhì)主要是肌漿蛋白等水溶性蛋白和一些相對(duì)分子質(zhì)量較小的多肽化合物,或肌原纖維蛋白的降解產(chǎn)物及重新聚合的大分子聚合物。由圖4B可以看出,加熱初期,魚塊中低分子蛋白受熱變性發(fā)生降解,蛋白亞基種類較多;進(jìn)一步加熱,低分子蛋白含量減少。條帶6顯示的是蒸制10 min的結(jié)果,低分子蛋白條帶幾乎全部消失,而高分子蛋白條帶明顯變寬且顏色加深,可能是由于隨著蒸制時(shí)間的延長(zhǎng),流失液中的低分子蛋白彼此連接,重新聚集成為高分子蛋白,使高分子蛋白的濃度有所增加,或是低分子蛋白已完全水解。在對(duì)魚塊進(jìn)行生產(chǎn)加工的過程中會(huì)產(chǎn)生大量的蒸煮液,而這些蒸煮液中所含有的蛋白質(zhì)種類和含量較為豐富,具有一定的營(yíng)養(yǎng)價(jià)值,可以考慮利用蒸煮液,提高資源附加值。
3 結(jié) 論
大菱鲆魚塊蒸制后在理化特性、組織結(jié)構(gòu)和蛋白特性方面均發(fā)生不同程度的變化。蒸制2 min時(shí),魚塊中的Ca2+Mg2+-ATPase活性被破壞,大分子蛋白質(zhì)降解成小片段,肌原纖維蛋白相對(duì)提取率大幅降低。蒸制4 min時(shí),肌原纖維蛋白相對(duì)提取率降至10%以下,魚塊達(dá)到熟化狀態(tài);熟化魚塊剪切力降至較低值,具有較好的嫩度和亮度。繼續(xù)受熱,魚塊的剪切力、L*值基本不變,但由于肌束膜緊密程度不斷降低甚至溶解,導(dǎo)致水分、膠原蛋白等營(yíng)養(yǎng)物質(zhì)持續(xù)流失。因此,限定規(guī)格(1.5 cm×1.5 cm×1.0 cm)魚塊蒸制4 min即可達(dá)到熟化,此時(shí)組織完整,營(yíng)養(yǎng)物質(zhì)流失較少,顏色和嫩度適宜。
參考文獻(xiàn):
[1] YARMAND M S, NIKMARAM P, DJOMEH Z E, et al.Microstructural and mechanical properties of camel longissimus dorsi muscle during roasting, braising and microwave heating[J]. Meat Science, 2013, 95: 419-424. DOI:10.1016/j.meatsci.2013.05.018.
[2] GARCíA-SEGOVIA P, ANDRéS-BELLO A,MARTíNEZ-MONZó J. Effect of cooking method on mechanical properties, color and structure of beef muscle (M. pectoralis)[J].Journal of Food Engineering, 2007, 80(3): 813-821. DOI:10.1016/j.jfoodeng.2006.07.010.
[3] 董志儉, 王慶軍, 黃靜雅, 等. 南美白對(duì)蝦蒸制過程中水分狀態(tài)及質(zhì)構(gòu)的變化[J]. 中國(guó)食品學(xué)報(bào), 2015, 15(2): 231-236. DOI:10.16429/j.1009-7848.2015.02.035.
[4] URBATZKA R, OLIVEIRA S G, ROCHA E, et al. Normalization strategies for gene expression studies by real-time PCR in a marine fish species, Scophthalmus maximus[J]. Marine Genomics, 2013, 10:17-25. DOI:10.1016/j.margen.2013.02.001.
[5] YU Lanping, SUN Boguang, LI Jun, et al. Characterization of a c-type lysozyme of Scophthalmus maximus: expression, activity, and antibacterial effect[J]. Fish & Shellfish Immunology, 2013, 34: 46-54.DOI:10.1016/j.fsi.2012.10.007.
[6] WANG Yingeng, REN Hai, ZHANG Zheng, et al. Causative pathogen of dark-thin syndrome in cultured Scophthalmus maximus and Chinese herbal medicine screening for the bactericidal effect[J]. Progress in Fishery Science, 2012, 33: 57-63.
[7] PADROS F, ZARZA C, DOPAZO L, et al. Pathology of Edwardsiella tarda infection in turbot, Scophthalmus maximus (L.)[J]. Journal of Fish Diseases, 2006, 29: 87-94. DOI:10.1111/j.1365-2761.2006.00685.x.
[8] DANWITZ A V, BUSSEL C G J V, KLATT S, et al. Dietary phytase supplementation in rapeseed protein based diets influences growth performance, digestibility and nutrient utilisation in turbot (Psetta maxima L.)[J]. Aquaculture, 2016, 450: 405-411. DOI:10.1016/j.aquaculture.2015.07.026.
[9] 趙晨, 楊正勇. 魚類工廠化養(yǎng)殖模式成本結(jié)構(gòu)分析: 基于大菱鲆養(yǎng)殖業(yè)的初步比較研究[J]. 中國(guó)漁業(yè)經(jīng)濟(jì), 2015, 33(2): 87-93.DOI:10.3969/j.issn.1009-590X.2015.02.014.
[10] 苗淑彥, 苗慧君, 聶琴, 等. 飼料中不同種類的碳水化合物對(duì)大菱鲆生長(zhǎng)性能和代謝反應(yīng)的影響[J]. 水產(chǎn)學(xué)報(bào), 2013, 37(6): 910-919.DOI:10.3724/SP.J.1231.2013.38575.
[11] LEKNES E, IMSLAND A K, GUSTAVSSON A, et al. Optimum feed formulation for turbot, Scophthalmus maximus (Rafinesque, 1810) in the grow-out phase[J]. Aquaculture, 2012, 344: 114-119. DOI:10.1016/j.aquaculture.2012.03.011.
[12] 王彩理, 王洪軍, 李斌, 等. 大菱鲆炸制工藝技術(shù)研究[J]. 保鮮與加工, 2016, 16(1): 55-58.
[13] 滕瑜, 趙麗靜, 王平, 等. 大菱鲆熏制預(yù)調(diào)味技術(shù)研究[J]. 食品工業(yè),2016(1): 133-135.
[14] 王甜甜, 李振興, 林洪, 等. 腌制工藝對(duì)大菱鲆質(zhì)構(gòu)及理化性質(zhì)的影響[J]. 中國(guó)工程科學(xué), 2014, 16(9): 64-68. DOI:10.3969/j.issn.1009-1742.2014.09.010.
[15] 吳瓊, 李德陽, 潘錦鋒, 等. 熟化方式對(duì)大菱鲆肌肉加工特性的影響[J]. 中國(guó)食品學(xué)報(bào), 2016, 16(9): 129-135. DOI:10.16429/j.1009-7848.2016.09.018.
[16] 鄭皎皎, 吳瓊, 王垚, 等. 鯉魚肌肉蒸制過程中的品質(zhì)變化[J]. 食品與發(fā)酵工業(yè), 2015, 41(1): 90-95. DOI:10.13995/j.cnki.11-1802/ts.201501018.
[17] 孫麗, 夏文水. 蒸煮對(duì)金槍魚肉及其蛋白質(zhì)熱變性的影響[J]. 食品與機(jī)械, 2010, 26(1): 22-25. DOI:10.13652/j.issn.1003-5788.2010.01.011.
[18] 董寶炎, 明漢萍, 喻陸一. 清蒸武昌魚的加工技術(shù)探討[J]. 水利漁業(yè),2002, 22(6): 53-54. DOI:10.15928/j.1674-3075.2002.06.029.
[19] NIAMNUY C, DEVAHASTIN S, SOPONRONNARIT S. Changes in protein compositions and their effects on physical changes of shrimp during boiling in salt solution[J]. Food Chemistry, 2008, 108: 165-175.DOI:10.1016/j.foodchem.2007.10.058.
[20] 藍(lán)尉冰, 毛偉杰, 池岸英, 等. 凡納濱對(duì)蝦肌肉鹽溶蛋白提取工藝研究[J]. 現(xiàn)代食品科技, 2012, 28(3): 313-315. DOI:10.3969/j.issn.1673-9078.2012.03.018.
[21] 袁道強(qiáng), 黃建華. 生物化學(xué)實(shí)驗(yàn)和技術(shù)[M]. 北京: 中國(guó)輕工業(yè)出版社, 2006: 184-185.
[22] DONG Xiuping, WU Qiong, LI Deyang, et al. Physicochemical, microstructural, and textural properties of different parts from farmed common carp (Cyprinus carpio)[J]. International Journal of Food Properties, 2016,20(4): 946-955. DOI:10.1080/10942912.2016.1190375.
[23] 衛(wèi)生部. 食品中脂肪的測(cè)定: GB/T 5009.6—2003[S]. 北京: 中國(guó)標(biāo)準(zhǔn)出版社, 2003: 43-46.
[24] International Organisation for Standardisation. Meat and meat productsdetermination of hydroxyproline content: ISO 3496: 1994(E)[S].Geneva: International Organisation for Standardisation, 1994: 1-2.
[25] 羅鳳連, 夏延斌, 歐陽建勛, 等. 分光光度法測(cè)定雞肉中的羥脯氨酸含量[J]. 食品科技, 2010, 35(1): 122-124. DOI:10.13684/j.cnki.spkj.2010.01.068.
[26] 劉世新. 實(shí)用生物組織學(xué)技術(shù)[M]. 北京: 科學(xué)出版社, 2004: 55-69.
[27] 朱蓓薇. 海珍品加工理論與技術(shù)的研究[M]. 北京: 科學(xué)出版社,2010: 235-242.
[28] 邱澄宇. 鯪魚肌肉加熱變形規(guī)律的研究[J]. 集美大學(xué)學(xué)報(bào)(自然科學(xué)版), 2007, 12(3): 217-220. DOI:10.3969/j.issn.1007-7405.2007.03.005.
[29] TORNBERG E. Effects of heat on meat proteins-implications on structure and quality of meat products[J]. Meat Science, 2005, 70(3):493-508. DOI:10.1016/j.meatsci.2004.11.021.
[30] HENRY Y, SEVE B, COLLEAUX Y, et al. Interactive effects of dietary levels of tryptophan and protein on voluntary feed intake and growth performancein pigs in relation to plasma free amino acids and hypothalamic serotonin[J]. Journal of Animal Science, 1992, 70(6):1873-1887. DOI:10.2527/1992.7061873x.
[31] 吳強(qiáng), 戴四發(fā). 超聲波結(jié)合氯化鈣處理對(duì)牛肉品質(zhì)的影響[J]. 食品科學(xué), 2010, 31(19): 141-145.
[32] 黃明, 趙蓮, 徐幸蓮, 等. 雞肉在成熟過程中肌原纖維蛋白的降解機(jī)制研究[J]. 農(nóng)業(yè)工程學(xué)報(bào), 2007, 23(11): 42-45. DOI:10.3321/j.issn:1002-6819.2007.11.007.
[33] 齊海萍, 胡文忠, 姜愛麗, 等. 熱加工對(duì)鯉魚質(zhì)構(gòu)的影響研究[J]. 食品科技, 2011, 36(5): 144-150. DOI:10.13684/j.cnki.spkj.2011.05.053.
[34] 潘錦鋒, 沈慧星, 尤娟, 等. 草魚肌原纖維蛋白加熱過程中理化特性的變化[J]. 中國(guó)農(nóng)業(yè)大學(xué)學(xué)報(bào), 2009, 14(6): 17-22. DOI:10.3321/j.issn:1007-4333.2009.06.004.
[35] OGAWA M, TAMIYA T, TSUCHIYA T. Structural changes of carp myosin during heating[J]. Fisheries Science, 1994, 60(6): 723-727.DOI:10.2331/fishsci.60.723.
[36] 王垚, 傅新鑫, 潘錦鋒, 等. 大菱鲆背腹部肌肉基本組成, 質(zhì)構(gòu)及加工特性[J]. 食品科學(xué), 2015, 36(23): 64-69. DOI:10.7506/spkx1002-6630-201523013.
[37] 劉宏彥. 鯉魚肌肉中肌原纖維蛋白的性質(zhì)研究[D]. 天津: 天津商業(yè)大學(xué), 2012: 2-5.

