菊苣酸對(duì)蛋白質(zhì)氧化損傷的作用
肖海芳,楊淑青,王旭光,王 靜,宋元達(dá),*
活性氧(reactive oxygen species,ROS)是生物體的正常代謝產(chǎn)物,主要存在于細(xì)胞線粒體中。適量ROS對(duì)于維持機(jī)體細(xì)胞正常的生理功能至關(guān)重要。當(dāng)機(jī)體處于氧化應(yīng)激和疾病狀態(tài)時(shí),體內(nèi)ROS生成增多,過多的ROS攻擊蛋白質(zhì)、脂質(zhì)和DNA等生物大分子,進(jìn)而破壞細(xì)胞結(jié)構(gòu)和功能,最終導(dǎo)致神經(jīng)退行性疾病、炎癥、癌癥和動(dòng)脈粥樣硬化等疾病的發(fā)生[1-5]。
蛋白氧化已成為反映和衡量生命過程中氧化應(yīng)激和氧化損傷的重要手段[6]。蛋白發(fā)生降解以及蛋白羰基的形成是蛋白氧化的主要特征[7-8]。研究發(fā)現(xiàn)許多疾病如阿爾茨海默癥、糖尿病、心腦血管等均與蛋白羰基化水平升高有關(guān)[9-12]。蛋白質(zhì)的側(cè)鏈氨基酸(尤其是脯氨酸、精氨酸、賴氨酸和蘇氨酸)被氧化后發(fā)生羰基化;自由基通過α-酰胺途徑和谷酰基殘基氧化途徑誘導(dǎo)蛋白質(zhì)肽鏈發(fā)生氧化斷裂,生成蛋白羰基化衍生物;半胱氨酸、組氨酸和賴氨酸殘基的親核側(cè)鏈與脂質(zhì)過氧化產(chǎn)物醛類物質(zhì)(如4-羥基壬烯醛、丙二醛和2-丙烯醛)及還原糖反應(yīng)產(chǎn)物活性羰基衍生物的二級(jí)反應(yīng)也會(huì)產(chǎn)生羰基化合物[13]。目前,蛋白質(zhì)羰基化水平是應(yīng)用最多、最廣泛的蛋白氧化指標(biāo)[14-15]。檢測(cè)蛋白羰基水平的方法很多,其中較為靈敏的方法是采用二硝基苯肼(dinitrophenylhydrazine,DNPH)對(duì)羰基進(jìn)行衍生,形成穩(wěn)定的2,4-二硝基苯基腙,該物質(zhì)能夠吸收紫外光,因此可通過分光光度法進(jìn)行檢測(cè)[16]。另外,還可采用特異性Anti-DNP抗體,通過免疫印跡法(Western blot)檢測(cè)蛋白羰基表達(dá)[17]。
食用植物中存在的天然抗氧化劑對(duì)于預(yù)防氧化應(yīng)激相關(guān)疾病具有重要意義。菊苣酸作為天然多酚類化合物,已被證明能夠清除自由基,具有較強(qiáng)的抗氧化能力[18]。然而目前仍未見從生物大分子角度探討菊苣酸抗氧化作用的報(bào)道。因此,本研究采用Cu2+/H2O2和2,2’-偶氮二(2-甲基丙基咪)二鹽酸鹽(2,2’-azobis(2-methylpropionamidine)dihydrochloride,AAPH)兩種不同的自由基誘導(dǎo)體系,分別產(chǎn)生羥自由基和烷氧自由基,誘導(dǎo)牛血清白蛋白(bovine serum albumin,BSA)、小鼠肝臟蛋白和腦蛋白3 種蛋白模型氧化損傷,探討菊苣酸對(duì)蛋白質(zhì)氧化損傷的影響。
1 材料與方法
1.1 動(dòng)物、材料與試劑
健康SPF級(jí)雄性昆明小鼠20 只,體質(zhì)量(20±2)g,購(gòu)自第四軍醫(yī)大學(xué)實(shí)驗(yàn)動(dòng)物中心,生產(chǎn)許可證號(hào):SCXK(陜)2007-001。
考馬斯亮藍(lán)R250 西安沃爾森生物技術(shù)有限公司;放射免疫沉淀測(cè)定(radioimmunoprecipitation assay,RIPA)裂解液 碧云天生物技術(shù)研究所;苯甲基磺酰氟(phenylmethanesulfonyl fluoride,PMSF)、硫酸鏈霉素 科邦生物有限公司;DNPH、三羥甲基氨基甲烷 美國(guó)Amresco公司;二抗 美國(guó)Santa Cruz公司;0.45 μm孔徑聚偏二氟乙烯(polyvinylidene chloride film,PVDF)膜 美國(guó)Millipore公司;BCA蛋白定量試劑盒、化學(xué)發(fā)光檢測(cè)試劑盒(electrical chemiluminescence immunoassay,ECL) 美國(guó)Thermo Fisher公司;甘氨酸 德國(guó)Merck公司;菊苣酸(純度≥98%)、BSA、AAPH、Anti-DNP抗體 美國(guó)Sigma公司;其他化學(xué)試劑均為分析純。
1.2 儀器與設(shè)備
DY89-Ⅱ型勻漿機(jī) 寧波新芝生物科技股份有限公司;5419R型高速離心機(jī)、移液槍 德國(guó)Eppendorf公司;PowerPac 220V電泳供電裝置、165-8001型垂直電泳槽、221BR型Trans-Blot SD半干轉(zhuǎn)印槽、ChemiDox XRS凝膠成像系統(tǒng) 美國(guó)Bio-Rad公司;-80 ℃低溫冰箱 日本SANYO公司;PHS-3C型pH計(jì) 上海雷磁儀器廠;恒溫水浴鍋 北京科偉永興儀器有限公司;BP211D型萬分之一天平 德國(guó)Sartorius公司;VORTEX-5型漩渦混合器 江蘇海門其林貝爾儀器制造有限公司;QYC110臺(tái)式恒溫振蕩器 上海福瑪實(shí)驗(yàn)設(shè)備有限公司;生化分析型超純水機(jī) 成都優(yōu)普凈化科技有限公司。
1.3 方法
1.3.1 組織蛋白的提取
本實(shí)驗(yàn)中所有動(dòng)物的處理,遵循山東理工大學(xué)實(shí)驗(yàn)室動(dòng)物管理辦法的規(guī)定。小鼠于20~22 ℃、相對(duì)濕度45%~50%條件下飼養(yǎng),以基礎(chǔ)飼料喂養(yǎng),自由飲水,實(shí)驗(yàn)前將小鼠禁食過夜,次日頸椎脫臼處死,迅速取出肝臟組織和腦組織,置4 ℃生理鹽水中反復(fù)漂洗,剔除脂肪及結(jié)締組織,用濾紙吸干水分。稱取0.1 g肝臟或腦組織,迅速剪碎,置于玻璃勻漿器中,加入1 mL RIPA細(xì)胞裂解液及10 μL PMSF溶液,冰水浴中勻漿,繼續(xù)裂解10 min,然后于4 ℃、15 000 r/min離心10 min,取上清液,即為組織總蛋白。采用BCA蛋白定量試劑盒測(cè)定組織總蛋白濃度。
1.3.2 菊苣酸對(duì)Cu2+/H2O2誘導(dǎo)蛋白氧化損傷的影響
Cu2+與H2O2反應(yīng)能夠產(chǎn)生羥自由基,引起蛋白質(zhì)氧化[6]。取0.6 mg/mL的BSA溶液(以100 mmol/L 磷酸鹽緩沖液溶解)或組織蛋白(肝臟組織和腦組織)放入多支1.5 mL的離心管中,向?qū)嶒?yàn)組離心管中分別加入不同濃度的菊苣酸溶液,混合均勻。封口膜封口后置于37 ℃水浴中孵育,30 min后取出,分別向各離心管中加入一定濃度的H2O2和CuSO4溶液,使其終濃度分別為25 mmol/L和0.1 mmol/L;對(duì)照組不加H2O2和CuSO4溶液,以同體積的pH 7.4磷酸鹽緩沖液代替。將各離心管于37 ℃水浴中繼續(xù)孵育,90 min后分別檢測(cè)各蛋白樣品氧化損傷程度。
1.3.3 菊苣酸對(duì)AAPH誘導(dǎo)蛋白氧化損傷的影響
蛋白樣品與菊苣酸的孵育方法同1.3.2節(jié)。將AAPH溶液置于37 ℃水浴2 min,使其熱分解。實(shí)驗(yàn)組分別向各孵育后的樣品中加入一定體積濃度為500 mmol/L的AAPH溶液,使其終濃度為50 mmol/L;對(duì)照組不加AAPH溶液,以同體積的pH 7.4磷酸鹽緩沖液代替。將各樣品于37 ℃水浴鍋中繼續(xù)孵育4 h,分別檢測(cè)蛋白樣品氧化損傷程度。
1.3.4 SDS-PAGE檢測(cè)蛋白損傷程度
分別向1.3.2節(jié)和1.3.3節(jié)處理好的蛋白樣品中加入十二烷基硫酸鈉(sodium dodecyl sulfate,SDS)上樣緩沖液,混勻,置于95 ℃水浴中反應(yīng)10 min,使蛋白變性。取等量各變性后的蛋白樣品,經(jīng)10%聚丙烯酰胺凝膠電泳(polyacrylamide gel electrophoresis,PAGE)90 min后,置于0.1%考馬斯亮藍(lán)R250染色液中染色30 min,脫色后采用ChemiDox凝膠成像系統(tǒng)對(duì)膠片成像,Quantity One軟件對(duì)條帶灰度進(jìn)行半定量分析。
1.3.5 Western blot檢測(cè)蛋白羰基化水平
分別取1.3.2節(jié)和1.3.3節(jié)處理好的蛋白樣品進(jìn)行SDS-PAGE電泳,方法同1.3.4節(jié)。電泳結(jié)束后,剝離凝膠,于電轉(zhuǎn)槽中恒壓10 V半干式轉(zhuǎn)印至PVDF膜上。將轉(zhuǎn)印后的PVDF膜放入2 mol/L的鹽酸溶液中浸泡10 min,再將其放入20 mmol/L的DNPH鹽酸溶液中衍生30 min。洗滌數(shù)次后將膜置于5%脫脂奶粉的TBST封閉液中室溫封閉2 h。TBST洗膜數(shù)次后,將膜放入稀釋的Anti-DNP一抗中孵育,4 ℃過夜。TBST洗滌后放入稀釋的二抗中,室溫輕搖孵育2h。上述PVDF膜經(jīng)TBST洗滌后采用ECL發(fā)光液于ChemiDox凝膠成像系統(tǒng)成像,Quantity One軟件對(duì)條帶灰度進(jìn)行半定量分析。
1.4 數(shù)據(jù)統(tǒng)計(jì)分析
實(shí)驗(yàn)數(shù)據(jù)以 ±s表示,采用SPSS 16.0統(tǒng)計(jì)軟件進(jìn)行Duncan’s多重比較分析,P<0.05表示差異具有統(tǒng)計(jì)學(xué)意義。
2 結(jié)果與分析
2.1 菊苣酸對(duì)BSA氧化損傷的影響
2.1.1 菊苣酸對(duì)Cu2+/H2O2誘導(dǎo)BSA氧化損傷的影響
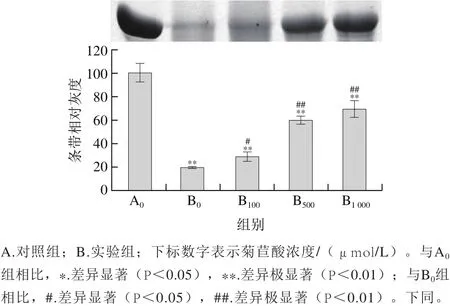
圖1 菊苣酸對(duì)Cu2/誘導(dǎo)BSA氧化損傷的影響(SDS-PAGE檢測(cè))Fig. 1 Effect of chicoric acid on Cu2+/H2O2-induced oxidative damage to BSA (detected by SDS-PAGE)
與對(duì)照組相比,BSA經(jīng)Cu2+/H2O2單獨(dú)誘導(dǎo)后,圖1中BSA條帶明顯變淺(P<0.01),圖2中BSA羰基化水平明顯升高(P<0.01),說明Cu2+/H2O2誘導(dǎo)體系產(chǎn)生的羥自由基使BSA發(fā)生明顯的氧化降解和羰基化修飾。與Cu2+/H2O2單獨(dú)處理組相比,菊苣酸預(yù)先孵育組的BSA條帶灰度明顯升高(P<0.01),羰基化水平明顯下降(P<0.01),并且濃度越高,菊苣酸的作用效果越顯著;其中,1 000 μmol/L菊苣酸幾乎能夠完全抑制Cu2+/H2O2誘導(dǎo)的BSA氧化損傷。以上結(jié)果說明,100~1 000 μmol/L菊苣酸對(duì)Cu2+/H2O2誘導(dǎo)的BSA氧化損傷具有保護(hù)作用。
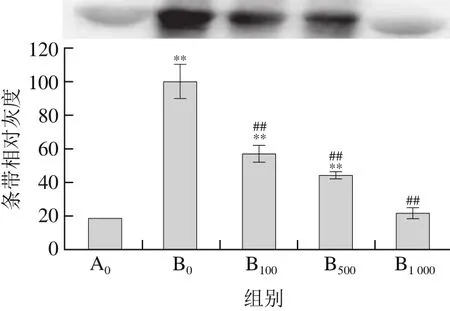
圖2 菊苣酸對(duì)Cu2+/H2O2誘導(dǎo)BSA羰基化的影響(Western blot檢測(cè))Fig. 2 Effect of chicoric acid on Cu2+/H2O2-induced carbonylation of BSA (detected by Western blot)
2.1.2 菊苣酸對(duì)AAPH誘導(dǎo)BSA氧化損傷的影響
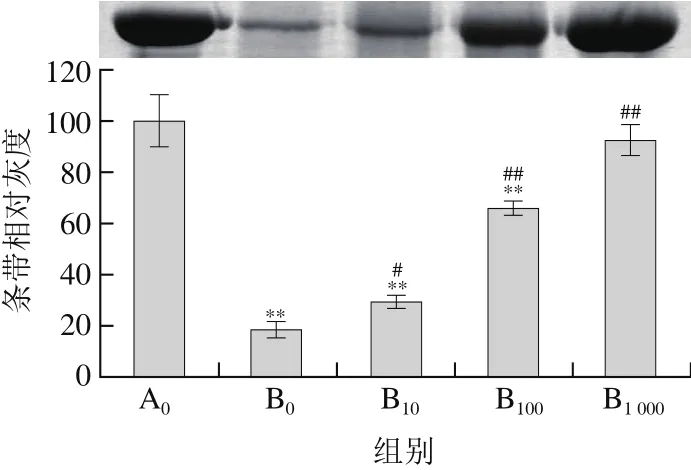
圖3 菊苣酸對(duì)AAPH誘導(dǎo)BSA氧化損傷的影響(SDS-PAGE檢測(cè))Fig. 3 Effect of chicoric acid on AAPH-induced oxidative damage to BSA (detected by SDS-PAGE)
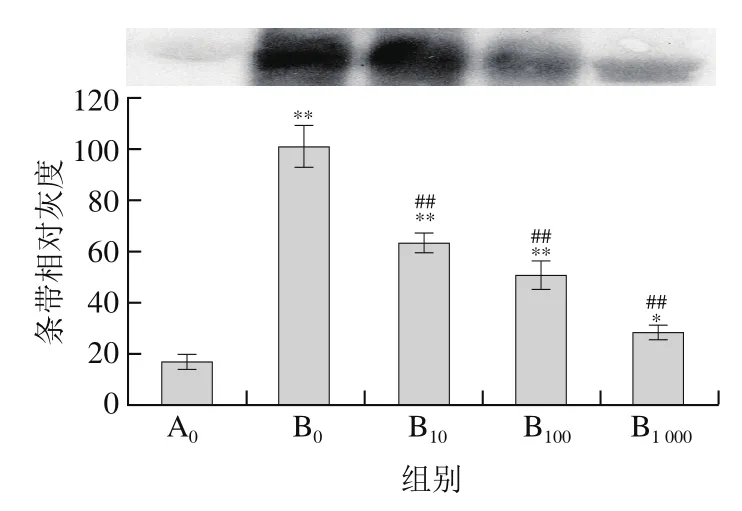
圖4 菊苣酸對(duì)AAPH誘導(dǎo)BSA羰基化的影響(Western blot檢測(cè))Fig. 4 Effect of chicoric acid on AAPH-induced carbonylation of BSA(detected by Western blot)
在不同的誘導(dǎo)體系中抗氧化物的活性存在差異,為進(jìn)一步探討菊苣酸在其他誘導(dǎo)體系中對(duì)BSA氧化損傷的影響,本實(shí)驗(yàn)采用熱分解的含氮化合物AAPH誘導(dǎo)BSA發(fā)生氧化損傷。由圖3可見,經(jīng)50 mmol/L AAPH單獨(dú)誘導(dǎo)后,大部分BSA被氧化降解;由圖4可見,與對(duì)照組相比,BSA羰基化水平也明顯升高(P<0.01),說明AAPH能夠誘導(dǎo)BSA氧化損傷。采用10~1 000 μmol/L菊苣酸預(yù)處理后:由圖3可見,BSA蛋白條帶灰度與AAPH單獨(dú)處理組相比明顯加深(P<0.01);由圖4可見,羰基化水平明顯下降(P<0.01);另外,隨著濃度的增加,其菊苣酸對(duì)BSA的作用效果越明顯。上述結(jié)果說明菊苣酸對(duì)AAPH誘導(dǎo)的BSA氧化損傷也具有明顯的保護(hù)作用。
2.2 菊苣酸對(duì)小鼠組織蛋白氧化損傷的影響
動(dòng)物肝臟和腦組織中蛋白含量較高,本實(shí)驗(yàn)選用小鼠肝臟蛋白和腦蛋白作為蛋白模型,以羰基化水平為檢測(cè)指標(biāo),進(jìn)一步探討菊苣酸對(duì)組織蛋白氧化損傷的影響。
2.2.1 菊苣酸對(duì)小鼠肝臟蛋白氧化損傷的影響
2.2.1.1 菊苣酸對(duì)Cu2+/H2O2誘導(dǎo)小鼠肝臟蛋白氧化損傷的影響
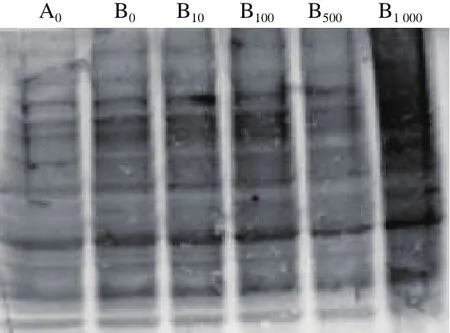
圖5 菊苣酸對(duì)Cu2/誘導(dǎo)小鼠肝臟蛋白羰基化的影響Fig. 5 Effect of chicoric acid on Cu2+/H2O2-induced protein carbonylation in mouse liver
蛋白羰基化條帶灰度越高,說明其氧化損傷程度越高。由圖5可以看出,Cu2+/H2O2單獨(dú)作用能引起肝臟蛋白羰基化水平的明顯升高。與Cu2+/H2O2單獨(dú)組相比,經(jīng)10~100 μmol/L菊苣酸預(yù)先孵育后,Cu2+/H2O2誘導(dǎo)體系中的小鼠肝臟蛋白羰基化水平無明顯變化,但500 μmol/L菊苣酸能明顯降低小鼠肝臟蛋白的羰基化水平;當(dāng)菊苣酸濃度增加為1 000 μmol/L時(shí),小鼠肝臟蛋白的羰基化水平與其他各處理組相比均明顯升高。上述結(jié)果表明,菊苣酸在一定濃度范圍內(nèi)能夠?qū)u2+/H2O2誘導(dǎo)小鼠肝臟蛋白氧化損傷具有保護(hù)作用,但高濃度菊苣酸表現(xiàn)出促氧化作用。
2.2.1.2 菊苣酸對(duì)AAPH誘導(dǎo)小鼠肝臟蛋白氧化損傷的影響
由圖6可以看出,AAPH單獨(dú)處理后,小鼠肝臟蛋白的羰基化水平明顯升高。10 μmol/L菊苣酸對(duì)AAPH誘導(dǎo)的小鼠肝臟蛋白羰基化修飾無明顯抑制作用,而菊苣酸在100~1 000 μmol/L濃度范圍內(nèi)能夠有效抑制AAPH誘導(dǎo)小鼠肝臟蛋白羰基的產(chǎn)生,對(duì)小鼠肝臟蛋白氧化損傷具有明顯的保護(hù)作用,且菊苣酸濃度越高對(duì)AAPH誘導(dǎo)體系中小鼠肝臟蛋白的保護(hù)效果越好。
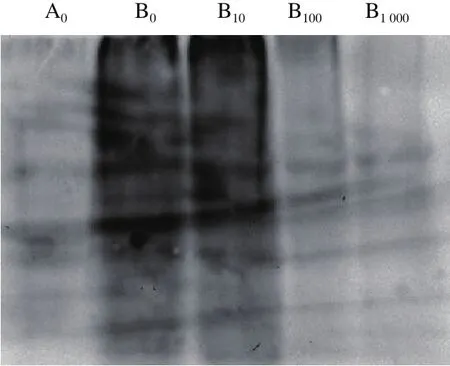
圖6 菊苣酸對(duì)AAPH誘導(dǎo)小鼠肝臟蛋白羰基化的影響Fig. 6 Effect of chicoric acid on AAPH-induced protein carbonylation in mouse liver
2.2.2 菊苣酸對(duì)小鼠腦蛋白氧化損傷的影響
2.2.2.1 菊苣酸對(duì)Cu2+/H2O2誘導(dǎo)小鼠腦蛋白氧化損傷的影響

圖7 菊苣酸對(duì)Cu2+/小鼠腦蛋白羰基化的影響Fig. 7 Effect of chicoric acid on Cu2+/H2O2-induced protein carbonylation in mouse brain
由圖7可以看出,與空白組相比,經(jīng)Cu2+/H2O2誘導(dǎo)體系單獨(dú)處理的小鼠腦蛋白羰基化水平明顯升高。經(jīng)10、100 μmol/L菊苣酸預(yù)先孵育后,小鼠腦蛋白羰基化程度明顯下降,說明該濃度范圍內(nèi)菊苣酸對(duì)Cu2+/H2O2誘導(dǎo)體系中的小鼠腦蛋白具有保護(hù)作用。當(dāng)菊苣酸濃度分別增加至500、1 000 μmol/L時(shí),小鼠腦蛋白羰基化水平反而明顯升高,甚至超過Cu2+/H2O2單獨(dú)處理組。這一結(jié)果說明,在Cu2+/H2O2誘導(dǎo)體系中濃度過高的菊苣酸對(duì)小鼠腦蛋白表現(xiàn)出促氧化作用。
2.2.2.2 菊苣酸對(duì)AAPH誘導(dǎo)小鼠腦蛋白氧化損傷的影響
由圖8可見,經(jīng)終濃度為50 mmol/L的AAPH誘導(dǎo)后,小鼠腦蛋白羰基化程度明顯升高。濃度為10 μmol/L的菊苣酸對(duì)AAPH誘導(dǎo)的小鼠腦蛋白羰基化無明顯抑制作用,但經(jīng)濃度分別為100、1 000 μmol/L的菊苣酸預(yù)先孵育后,小鼠腦蛋白的羰基化程度明顯下降。上述結(jié)果說明,在AAPH誘導(dǎo)體系中濃度為100~1 000 μmol/L菊苣酸表現(xiàn)出抗氧化作用,對(duì)小鼠腦蛋白具有明顯的保護(hù)作用。

圖8 菊苣酸對(duì)AAPH誘導(dǎo)小鼠腦蛋白羰基化水平的影響Fig. 8 Effect of chicoric acid on AAPH-induced protein carbonylation in mouse brain
3 討 論
Cu2+與H2O2反應(yīng)生成羥自由基,AAPH熱分解產(chǎn)生烷過氧自由基,兩種反應(yīng)體系均能誘導(dǎo)生物大分子蛋白質(zhì)發(fā)生氧化損傷。大量研究顯示,天然抗氧化劑能夠抑制自由基對(duì)蛋白的氧化損傷[6,19-21]。本實(shí)驗(yàn)利用上述兩種典型的氧化誘導(dǎo)體系,在預(yù)實(shí)驗(yàn)的基礎(chǔ)上,分別以BSA、小鼠肝臟蛋白和腦蛋白為蛋白模型,研究菊苣酸對(duì)蛋白質(zhì)氧化損傷的影響。
本研究結(jié)果表明,無論是通過SDS-PAGE觀察蛋白降解情況,還是Western blot檢測(cè)蛋白羰基化水平,菊苣酸在100~1 000 μmol/L濃度范圍內(nèi)能夠抑制Cu2+與H2O2誘導(dǎo)體系對(duì)BSA的氧化損傷;低濃度菊苣酸對(duì)羥自由基引起的小鼠肝臟蛋白和腦蛋白氧化損傷具有保護(hù)作用,但在高濃度時(shí)菊苣酸表現(xiàn)出促氧化作用。與Cu2+/H2O2反應(yīng)體系不同,在AAPH誘導(dǎo)體系中,高濃度菊苣酸對(duì)BSA、小鼠肝臟蛋白和小鼠腦蛋白均表現(xiàn)出較強(qiáng)的保護(hù)作用。菊苣酸之所以在兩種反應(yīng)體系中表現(xiàn)出不同的作用效果,可能是由兩種體系中自由基的性質(zhì)及在生物大分子上的作用位點(diǎn)不同引起[22]。
據(jù)文獻(xiàn)[23-24]報(bào)道,VC和VE分別與Cu2+共同作用,均能引起蛋白和DNA的氧化損傷;類黃酮類物質(zhì)能夠與過渡金屬反應(yīng),加速羥自由基的生成[25-26];高劑量注射VC后,豚鼠血清脂質(zhì)過氧化水平升高[27]。上述研究結(jié)果均表明,許多抗氧化劑在某些情況下能夠表現(xiàn)出促氧化效應(yīng)。在Cu2+與H2O2誘導(dǎo)體系中,高濃度菊苣酸對(duì)小鼠組織蛋白表現(xiàn)出促氧化作用,可能與Cu2+與H2O2反應(yīng)體系本身有關(guān)。Cu2+與H2O2反應(yīng)產(chǎn)生羥自由基的原理為[28]:Cu2++H2O2→Cu++HO2·+H+,H2O2+Cu+→OH·+OH-+Cu2+。由反應(yīng)式能夠看出,Cu2+向Cu+的轉(zhuǎn)變是生成羥自由基的限速步驟,高濃度菊苣酸加入后可能促進(jìn)了Cu2+向Cu+的轉(zhuǎn)變,進(jìn)而加速羥自由基的產(chǎn)生,促進(jìn)蛋白質(zhì)氧化,這一推測(cè)有待于進(jìn)一步研究證實(shí)。前期研究也曾發(fā)現(xiàn),菊苣酸能夠誘導(dǎo)3T3-L1前脂肪細(xì)胞內(nèi)ROS的產(chǎn)生[29]。另外,在Cu2+/H2O2誘導(dǎo)體系中,高濃度菊苣酸對(duì)BSA和小鼠組織蛋白表現(xiàn)出不同的作用效果,這一差異可能與小鼠組織蛋白的成分較為復(fù)雜有關(guān)。菊苣酸促氧化的作用機(jī)制還需要進(jìn)一步深入探討。
參考文獻(xiàn):
[1] FANG C, BOURDETTE D, BANKER G. Oxidative stress inhibits axonal transport: implications for neurodegenerative diseases[J]. Molecular Neurodegeneration, 2012, 7(1): 29. DOI:10.1186/1750-1326-7-29.
[2] VALAVANIDIS A, VLACHOGIANNI T, FIOTAKIS K, et al.Pulmonary oxidative stress, inflammation and cancer: respirable particulate matter, fibrous dusts and ozone as major causes of lung carcinogenesis through reactive oxygen species mechanisms[J].International Journal of Environmental Research and Public Health,2013, 10(9): 3886-3907. DOI:10.3390/ijerph10093886.
[3] CONROY S K, MCDONALD B C, SMITH D J, et al. Alterations in brain structure and function in breast cancer survivors: effect of postchemotherapy interval and relation to oxidative DNA damage[J].Breast Cancer Research and Treatment, 2013, 137(2): 493-502.DOI:10.1007/s10549-012-2385-x.
[4] SULTANA R, BUTTERFIELD D A. Oxidative modification of brain proteins in Alzheimer's disease: perspective on future studies based on results of redox proteomics studies[J]. Journal of Alzheimer's Disease,2013, 33: 243-251. DOI:10.3233/JAD-2012-129018.
[5] VENDROV A E, VENDROV K C, SMITH A, et al. NOX4 NADPH oxidase-dependent mitochondrial oxidative stress in aging-associated cardiovascular disease[J]. Antioxidants & Redox Signaling, 2015,23(18): 1389-1409. DOI:10.1089/ars.2014.6221.
[6] 李愛春. 富氫水對(duì)骨骼肌運(yùn)動(dòng)性氧化應(yīng)激損傷與選擇性抗氧化作用機(jī)制研究[D]. 蘇州: 蘇州大學(xué), 2012: 6-8.
[7] YUZEFOVYCH L V, MUSIYENKO S I, WILSON G L, et al.Mitochondrial DNA damage and dysfunction, and oxidative stress are associated with endoplasmic reticulum stress, protein degradation and apoptosis in high fat diet-induced insulin resistance mice[J]. PLoS ONE, 2013, 8(1): e54059. DOI:10.1371/journal.pone.0054059.g007.
[8] ARYAL B P, JEONG J, RAO V A. Carbonylation and degradation of cardiac myosin binding protein C serves as an indicator of doxorubicin-induced cardiotoxicity[J]. Cancer Research, 2015, 75:1825-1825. DOI:10.1158/1538-7445.
[9] SHEN L, CHEN Y, YANG A, et al. Redox proteomic profiling of specifically carbonylated proteins in the serum of triple transgenic Alzheimer’s disease mice[J]. International Journal of Molecular Sciences, 2016, 17(4): 469. DOI:10.3390/ijms17040469.
[10] HSU C, YANG H, HO J, et al. Houttuynia cordata aqueous extract attenuated glycative and oxidative stress in heart and kidney of diabetic mice[J]. European Journal of Nutrition, 2016, 55(2): 845-854.DOI:10.1007/s00394-015-0994-y.
[11] ASADI H, ABOLFATHI A A, BADALZADEH R, et al. Effects of ramadan fasting on serum amyloid A and protein carbonyl group levels in patients with cardiovascular diseases[J]. Journal of Cardiovascular and Thoracic Research, 2015, 7(2): 55-59. DOI:10.15171/jcvtr.2015.12.
[12] MADISETTY M K, KUMARASWAMI K, KATKAM S, et al.Assessment of oxidative stress markers and carotid artery intimamedia thickness in elderly patients without and with coronary artery disease[J]. Indian Journal of Clinical Biochemistry, 2016, 31(3):278-285. DOI:10.1007/s12291-015-0530-0.
[13] DALLE-DONNE I, ROSSI R, GIUSTARINI D, et al. Protein carbonyl groups as biomarkers of oxidative stress[J]. Clinica Chimica Acta,2003, 329(1/2): 23-38. DOI:10.1016/S0009-8981(03)00003-2.
[14] FERNANDO N, WICKREMESINGHE S, NILOOFA R, et al. Protein carbonyl as a biomarker of oxidative stress in severe leptospirosis,and its usefulness in differentiating leptospirosis from dengue infections[J]. PLoS ONE, 2016, 11(6): e0156085. DOI:10.1371/journal. pone.0156085.
[15] BROCARDO P S, MCGINNIS E, CHRISTIE B R, et al. Timecourse analysis of protein and lipid oxidation in the brains of Yac128 Huntington's disease transgenic mice[J]. Rejuvenation Research, 2016,19(2): 140-148. DOI:10.1089/rej.2015.1736.
[16] PILLON N J, CROZE M L, VELLA R E, et al. The lipid peroxidation by-product 4-hydroxy-2-nonenal (4-HNE) induces insulin resistance in skeletal muscle through both carbonyl and oxidative stress[J].Endocrinology, 2012, 153(5): 2099-2111. DOI:10.1210/en.2011-1957.
[17] VáSQUEZ-GARZóN V R, ROUIMI P, JOUANIN I, et al. Evaluation of three simple direct or indirect carbonyl detection methods for characterization of oxidative modifications of proteins[J]. Toxicology Mechanisms and Methods, 2012, 22(4): 296-304. DOI:10.3109/15376 516.2012.657258.
[18] SCHLERNITZAUER A, OIRY C, HAMAD R, et al. Chicoric acid is an antioxidant molecule that stimulates AMP kinase pathway in L6 myotubes and extends lifespan in Caenorhabditis elegans[J]. PLoS ONE, 2013, 8(11): e78788. DOI:10.1371/journal.pone.0078788.
[19] 相啟森, 孟旭, 喬燕, 等. 鼠尾草酸對(duì)自由基誘導(dǎo)蛋白質(zhì)氧化損傷的保護(hù)作用[J]. 食品科學(xué), 2013, 34(15): 281-284. DOI:10.7506/spkx1002-6630-201315058.
[20] 孟旭, 劉學(xué)波. 茶多酚協(xié)同荷葉堿的抗氧化活性及其對(duì)結(jié)腸癌細(xì)胞的抑制作用[J]. 食品科學(xué), 2014, 35(19): 119-124. DOI:10.7506/spkx1002-6630-201419025.
[21] 姚雯, 楊天衡, 劉學(xué)波. 血根堿清除自由基及抑制生物大分子氧化的作用[J]. 食品科學(xué), 2014, 35(9): 137-141. DOI:10.7506/spkx1002-6630-201409028.
[22] MAYO J C, TAN D X, SAINZ R M, et al. Protection against oxidative protein damage induced by metal-catalyzed reaction or alkylperoxyl radicals: comparative effects of melatonin and other antioxidants[J].Biochimica et Biophysica Acta, 2003, 1620(1): 139-150. DOI:10.1016/S0304-4165(02)00527-5.
[23] GAETKE L M, CHOW C K. Copper toxicity, oxidative stress,and antioxidant nutrients[J]. Toxicology, 2003, 189(1): 147-163.DOI:10.1016/S0300-483X(03)00159-8.
[24] KATO Y, KITAMOTO N, KAWAI Y, et al. The hydrogen peroxide/copper ion system, but not other metal-catalyzed oxidation systems,produces protein-bound dityrosine[J]. Free Radical Biology and Medicine, 2001, 31(5): 624-632. DOI:10.1016/S0891-5849(01)00623-2.
[25] CAO G, SOFIC E, PRIOR R L. Antioxidant and prooxidant behavior of flavonoids: structure-activity relationships[J]. Free Radical Biology and Medicine, 1997, 22(5): 749-760. DOI:10.1016/S0891-5849(96)00351-6.
[26] PROCHáZKOVá D, BOU?OVá I, WILHELMOVá N. Antioxidant and prooxidant properties of flavonoids[J]. Fitoterapia, 2011, 82(4):513-523. DOI:10.1016/j.fitote.2011.01.018.
[27] KAPSOKEFALOU M, MILLER D D. Iron loading and large doses of intravenous ascorbic acid promote lipid peroxidation in whole serum in guinea pigs[J]. British Journal of Nutrition, 2001, 85(6): 681-687.DOI:10.1079/BJN2001319.
[28] SIMPSON J A, CHEESEMAN K H, SMITH S E, et al. Free-radical generation by copper ions and hydrogen peroxide. stimulation by Hepes buffer[J]. Biochemical Journal, 1988, 254(2): 519-523.DOI:10.1042/bj2540519.
[29] XIAO H, WANG J, YUAN L, et al. Chicoric acid induces apoptosis in 3T3-L1 preadipocytes through ROS-mediated PI3K/Akt and MAPK signaling pathways[J]. Journal of Agricultural and Food Chemistry,2013, 61(7): 1509-1520. DOI:10.1021/jf3050268.

