高濃度殼聚糖溶液酶解條件優化
吳健鋒,張立彥
(華南理工大學食品科學與工程學院,廣東廣州 510640)
殼寡糖具有抑菌[1]、抑制腫瘤生長[2]、抗氧化[3]、抗過敏性炎癥[4]、提高植物免疫力[5]等多種生物活性,在日化、食品、醫藥、臨床治療等方面有廣泛的應用前景。生產殼寡糖的方法眾多[6-7],其中利用專一性殼聚糖酶對殼聚糖進行水解的方法條件溫和、產物分子量相對容易控制且綠色環保[8],在工業上已得到廣泛應用。在工業上由于要節約時間和縮減能耗,往往會對質量濃度高達8%的殼聚糖溶液進行酶解來生產殼寡糖,這種反應體系粘度高,酶解效率低,與低濃度的反應體系有明顯的差別。至今工業生產還未實現在高濃度底物條件下,高效酶解生產殼寡糖,而且,目前絕大多數研究圍繞著2%以下濃度的殼聚糖溶液來展開[9-10]。
鑒于此,本文探討殼聚糖酶的酶解穩定性,在保持酶活穩定的基礎上研究溶解和水解過程中不同加酶方式對水解效率及產物的影響,以達到提高酶解效率和產物得率的效果。
1 材料與方法
1.1 材料與儀器
殼聚糖 DD89.98%,118132 Da,山東萊州市海力生物制品有限公司;殼聚糖粗酶液 酶活為10 U/mL,廣東惠州長龍生物科技有限公司;殼寡糖標準品(DP 2-6)及氨基葡萄糖鹽酸鹽標品 上海甄準生物有限公司;其他化學試劑 均為分析純。
PHS-25型pH計 上海雷磁儀器廠;TGL-16型超速離心機 上海安科儀器有限公司;JK-WB-4A型電熱恒溫水浴鍋 上海精學科學儀器有限公司;Model752型紫外-可見分光光度計 上海現科分光儀器有限公司;SNB-1A型數顯旋轉粘度計 上海方瑞儀器有限公司;Agilent1100型高效液相色譜儀 美國安捷倫科技有限公司。
1.2 實驗方法
1.2.1 殼聚糖溶液的配制 準確稱取4.00 g殼聚糖,加入50 mL去離子水,恒溫20 min并不斷攪拌以充分分散殼聚糖粉末,每5 min加入0.5 mL 6 mol/L的鹽酸,在40 min內共加入4 mL,以使殼聚糖溶解,配制成濃度為8%的殼聚糖溶液。在加酸0、5、10、15、20、25、30、35、40 min時,相應的鹽酸濃度分別約為0.00、0.06、0.12、0.17、0.23、0.29、0.34、0.39、0.44 mol/L[11]。
1.2.2 還原糖濃度的測定
1.2.2.1 氨基葡萄糖鹽酸鹽標準曲線的制作 準確稱取192.00 g酒石酸鉀鈉,用500 mL左右的熱水將其溶解,接著加入6.3 g 3,5-二硝基水楊酸,21.00 g氫氧化鈉,攪拌溶解,最后再加入5.00 g苯酚,5.00 g亞硫酸鈉,待其充分溶解,冷卻至室溫后,用去離子水定容至1000 mL,貯存于棕色瓶中,放置1周得到DNS試劑。將氨基葡萄糖鹽酸鹽配制成濃度為1 mg/mL的溶液,分別取該標準液0、200、400、600、800、1000 μL于具塞比色管中,然后用蒸餾水分別補足至1 mL,再加入3 mL DNS試劑,搖勻加塞,放入沸水浴反應15 min后,立即流水冷卻,用蒸餾水定容到10 mL,搖勻顯色穩定數分鐘,在波長520 nm下,以零管作為空白對照,測定吸光值,并以氨基葡萄糖鹽酸鹽含量為橫坐標,以相應吸光值為縱坐標繪制線性標準曲線,如下圖所示。

1.2.2.2 殼聚糖溶液還原糖濃度的測定 取1 mL的殼聚糖的水解液,加入3 mL 3,5-二硝基水楊酸(DNS試劑),搖勻加塞,放入沸水浴反應15 min后,立即流水冷卻,用蒸餾水定容到10 mL,搖勻顯色穩定數分鐘,在波長520 nm下,以1 mL蒸餾水加入3 mL DNS試劑作為空白對照,測定吸光值,對照標準曲線計算還原糖含量。平行實驗三次,取平均值。
1.2.3 殼聚糖酶穩定性的研究
1.2.3.1 殼聚糖酶溫度穩定性研究 將配制好的殼聚糖溶液分別在45、50、55、60 ℃水浴準備酶解反應,按5 U/g殼聚糖加入殼聚糖酶液。每小時攪拌15 min,酶解反應12 h,每隔60 min測定還原糖含量,平行實驗三次,取平均值。
1.2.3.2 殼聚糖酶pH穩定性研究 用乙酸-乙酸鈉緩沖液分別配制pH為3.5、4.5、5.0、5.5、6.0,濃度為2%的殼聚糖溶液,然后分別在55 ℃下,按5 U/g 殼聚糖加入殼聚糖酶液,每小時攪拌15 min,酶解反應12 h。定時測定還原糖濃度方法,平行實驗三次,取平均值。
1.2.4 殼聚糖溶液pH及粘度的測定 在1.2.1殼聚糖溶解過程中,在15、20、25、30、35、40 min時使用數顯粘度計測定溶液粘度;每隔5 min使用數顯pH計測定溶液pH,平行實驗三次,取平均值。
1.2.5 高濃度殼聚糖溶液酶解條件的改進研究
1.2.5.1 溶解過程中一次性加酶處理 不加酶方案:加酸溶解30 min,加酸結束后按5 U/g殼聚糖加酶;方案1:加酸溶解0 min,按5 U/g殼聚糖加酶;方案2:加酸溶解10 min時,按5 U/g殼聚糖加酶。各方案中殼聚糖加酸溶解過程同1.2.1,并在10、20、30、60 min時對以上兩種加酶方案的溶液測定粘度。
1.2.5.2 溶解過程中分批加酶處理 法1:加酸溶解10 min時,按照1 U/g殼聚糖加入酶液,溶解30 min后,按照4 U/g殼聚糖補加酶液;法2:加酸溶解10 min時,按照2 U/g殼聚糖加入酶液,溶解30 min后,按照3 U/g殼聚糖補加酶液;法3:加酸溶解10 min時,按照3 U/g殼聚糖加入酶液,溶解30 min后,按照2 U/g殼聚糖補加酶液。各方法中殼聚糖加酸溶解過程同1.2.1,并對以上三種加酶方案的溶液定時測定粘度及還原糖含量。
1.2.6 薄層色譜 按以下兩種方式進行加酶:a.加酸溶解30 min 后加入5 U/g殼聚糖的殼聚糖酶進行水解;b.按1.2.5.2中法2進行操作。定時取一定量的酶解液進行薄層色譜分析。用毛細管在硅膠平板上點樣,同時用濃度為10 mg/mL的氨基葡萄糖鹽酸鹽和DP2~6的殼寡糖標準溶液做對照。展開劑為異丙醇∶水∶氨水=60∶30∶4(V/V/V),顯色劑為濃度為0.5%的茚三酮溶液。
1.2.7 HPLC分析 同1.2.6兩種方式進行加酶,定時對溶液取樣進行HPLC分析。采用裝備Agilent示差檢測器的髙效液相色譜儀對殼寡糖的含量及分布情況進行檢測分析,并選擇Shodex的Asahipak NH2P 50-4E(4.6 mm×250 mm)氨基柱作為實驗色譜柱。參考董惠宗等[12-13]的方法,主要的色譜條件為:流動相乙腈∶水=70∶30,流速0.9 mL/min,柱溫30 ℃,進樣量為10 μL。以10 mg/mL的氨基葡萄糖和殼寡糖水溶液作為標準樣,利用面積歸一法對殼寡糖的含量進行計算[14]。
1.2.8 數據處理 使用Office 2007中的Excel軟件和GraphPad Prism進行圖表整理,以及采用SPSS 23.0軟件的單因素方差分析方法對數據進行顯著性分析。
2 結果與討論
2.1 殼聚糖酶溫度和pH穩定性研究
本文研究了殼聚糖酶的溫度及pH穩定性,結果見圖1和圖2所示。

圖1 溫度對殼聚糖酶解液還原糖濃度的影響Fig.1 Effect of temperature on reducing sugar concentration in hydrolysate solution hydrolyzed by chitosanase

圖2 pH對殼聚糖酶酶解液還原糖濃度的影響Fig.2 Effect of pH on reducing sugar concentration in hydrolysate solution hydrolyzed by chitosanase
由圖1可知,在45、50、55 ℃、酶解720 min內,隨溫度升高,還原糖濃度增加,酶解效率提高。該殼聚糖酶在55 ℃以下具有較好的熱穩定性,而60 ℃或者更高的溫度能使殼聚糖酶酶活迅速喪失。對于高濃度殼聚糖粘性溶液來說,提高溫度可以有效降低溶液粘度,但溶液溫度不能超過60 ℃,否則殼聚糖酶失活嚴重。
由圖2可知,在pH4.5、5.0、5.5范圍內產生的還原糖濃度較高,而pH6.0和3.5時產生的還原糖明顯減少,說明殼聚糖酶在pH4.5~5.5范圍內較穩定,超出這個范圍酶活性急劇下降。
2.2 殼聚糖溶解過程中溶液粘度及pH的變化

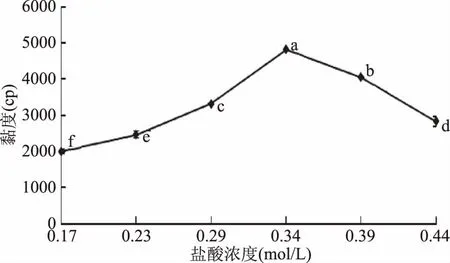
圖3 55 ℃下殼聚糖溶液粘度隨鹽酸濃度的變化(殼聚糖濃度6%,w/w)Fig.3 Changes in viscosity of chitosan solution with HCl concentration at 55 ℃(6% chitosan solution,w/w)注:不同小寫字母表示差異顯著(p<0.05),圖4~圖9同。
圖4為殼聚糖加鹽酸溶解過程中溶液pH的變化情況。圖中顯示,殼聚糖溶液在鹽酸濃度為0~0.39 mol/L的范圍內,pH緩慢降低;而當加酸量超過0.39 mol/L之后,溶液pH則急劇下降。這是因為鹽酸加量較少時,H+主要參與氨基質子化反應,至殼聚糖分子完全質子化,即殼聚糖溶解后,加入的H+以自由離子形式存在,使溶液pH驟降,這也與溶液中的電導率變化相對應[11]。在溶液粘度減低前溶液的pH處于5.5~5.8左右,根據2.1可知此時酶活損失少,此階段加入殼聚糖酶比較可行。

圖4 55 ℃下殼聚糖溶液pH隨鹽酸濃度的變化(殼聚糖濃度為6%)Fig.4 Changes in pH of chitosan solution with HCl concentration at 55 ℃(6% chitosan solution,w/w)
2.3 高濃度殼聚糖溶液酶解條件的改進研究
依據上述,探索在溶解過程中不同加酶時間和加酶量對降低粘度的效果。
2.3.1 溶解過程一次性加酶處理的研究 依據上述結果及討論,研究采用兩種方式加入殼聚糖酶,加酶量為酶解時所需全部酶量,用量為5 U/g殼聚糖,溶液的粘度變化見圖5。

圖5 溶解過程中不同加酶方式對溶液粘度的影響(殼聚糖濃度8%)Fig.5 Effect of adding enzyme methods on viscosity of chitosan solution in the process of dissolution(8% chitosan solution,w/w)
由圖5可知,在加酸溶解過程中添加殼聚糖酶確實起到了降低溶液粘度的作用。當加酸溶解30 min后,與不加酶組相比,采取方案1與方案2加酶方法均使溶液的粘度顯著下降(p<0.05),與不加酶樣相比分別降低了約68.5%、74.9%,有效抑制了溶液粘度上升。而且方案2降粘效果更好,這可能是因為未加酸溶解前溶液pH近中性,按方案1加酶后酶活有損失,而且由于加酶較早,在不斷加酸過程中溶液局部過酸也導致一部分酶分子活性損失。總的來說,邊溶解邊加酶可以有效降低殼聚糖溶液的粘度,方案2效果最好。
2.3.2 溶解過程中分批加酶的研究
2.3.2.1 不同加酶時間和用量對殼聚糖溶液粘度的影響 據2.3.1的結果,在加酸溶解10 min時加酶具有較好的降粘作用。但是據圖5推測可知,在溶解過程中,過早的加入殼聚糖酶降粘效果不佳是由于滴加酸過程中造成局部過酸,酶活部分損失。因此,考慮在溶解過程中只加入一部分酶來降低溶液粘度,殼聚糖充分溶解后,再補添加剩余的酶,如圖6中的法1~3。
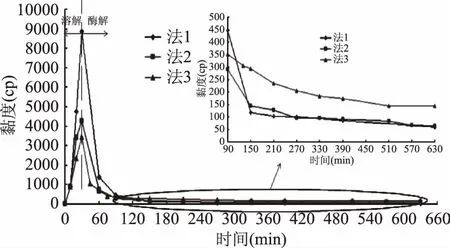
圖6 不同加酶方法對溶液粘度的影響Fig.6 Effect of adding enzyme methods on viscosity of chitosan solution
由圖6知,在加酸溶解10 min后加入的酶量越大,溶液的粘度越低。從圖6的放大圖可知,按法1和法2加酶后溶液的最終粘度十分相近,而按法3實驗的溶液的最終粘度較高。這是因為按法3殼聚糖溶解過程中加入的酶量相對較多,不斷加酸過程中局部過酸使酶活損失較大。據上述溶液粘度變化分析可知,按法1溶液在溶解過程中的降粘效果較差,而按法3溶液在酶解過程中粘度值相對較高,所以按法2降粘效果相對較好。
2.3.2.2 不同加酶時間和用量對酶解溶液中還原糖含量的影響 由圖7可知,三種方案在酶解過程中溶液中還原糖變化趨勢大致相同,開始階段增長較快,后來增長速度逐漸變慢,最終還原糖含量趨于穩定。法1中雖然前30 min內溶液中還原糖濃度較低,但之后隨水解進行還原糖濃度較快增加,直至240 min后水解速度逐漸變緩,480 min后還原糖濃度則基本不變;法2及法3在水解前120 min差別不大,之后法3水解速度減慢。對酶解720 min后溶液中還原糖濃度進行顯著性分析,發現按法1溶液中還原糖濃度顯著高于法2、法3(p<0.05),法2顯著高于法3(p<0.05)。這可能是因為溶解過程中加入殼聚糖酶確實喪失了部分活性,使水解效率下降。綜合來說,既要降低溶液粘度,又要保證酶解效率,采取法2較好。因此接著對按法2進行優化前后的殼寡糖產物進行檢測,考察優化過程對產物的影響。

圖7 不同加酶方法對酶解溶液中還原糖含量的影響 Fig.7 Effect of different adding enzyme methods on reducing sugar concentration
2.4 不同酶解方式下酶解過程中目標殼寡糖組成及產量變化
2.4.1 薄層色譜分析 由圖8a可知,沒有在溶解過程中加酶時,隨著水解時間的延長,酶解液在GlcN~(GlcN)6相應顯色位置顯色逐漸加深,含量逐漸增加,但是在整個水解過程中各種寡糖相應顯色位置顯色都很淺,產生的殼寡糖普遍較少。
由圖8b可知,在酶解第0.5~4 h,發現酶解液在GlcN~(GlcN)6相應顯色位置顯色很淺,僅有一定量的殼三糖和殼四糖產生;在酶解第4~12 h,可以看到2~6個聚合度的殼寡糖顯色越來越深。對比圖8a,相同水解時間下各種寡糖在對應顯色位置的顯色明顯加深,產生的寡糖含量明顯增加,說明按照法2在溶解過程中加酶可以有效提高目標殼寡糖的產量。為了進一步證實以上結論,對酶解液進行HPLC分析。

圖8 水解過程中的反應產物的TLC分析圖Fig.8 Analysis of chitooligosaccharides in the process of hydrolysis by TLC注:譜帶S:殼寡糖標樣,從上到下依次為GlcN2~GlcN6;譜帶0.5~12 h:表示相應酶解時間的產物;(a)加酸溶解30 min 后加入5 U/g殼聚糖的殼聚糖酶進行水解(b)按法2進行操作。
2.4.2 高效液相色譜分析 由圖9a可知,聚合度為2~6的目標殼寡糖總量隨時間不斷上升,并在12 h后趨于穩定,達到12.3 mg/mL左右;最具功能特性及經濟價值的殼五糖和殼六糖在反應時間12 h,兩者均達到最大值,分別為3.1和3.0 mg/mL。

圖9 各種聚合度的殼寡糖含量隨時間變化圖Fig.9 Changes of chitooligosaccharides content in the process of hydrolysis analyzed by HPLC 注:(a)加酸溶解30 min 后加入5 U/g殼聚糖的殼聚糖酶進行水解;(b)按法2進行操作。
由圖9b可知,隨著反應的進行,聚合度為2~6的目標殼寡糖總量也是不斷上升,并在6 h后趨于穩定,能達到40 mg/mL左右;在整個水解過程中單糖和殼二糖的含量始終較低;水解產物中殼三糖的含量始終保持最高,而聚合度相對較大的4~6糖均經歷了先增加后減少的過程,這是由于這些聚合度相對較大的殼寡糖在一定時間內逐漸積累,隨著反應繼續進行又降解為更小分子的糖或發生轉糖基作用而使含量減少。目標殼寡糖的組成及產量與殼聚糖酶的水解規律有關。Fukamizo等[18]提出源自Streptomycessp. N174的殼聚糖酶與底物形成的結合縫可以容納6個GlcN殘基,鍵裂解傾向于發生在結合縫的中間部位,而且對于4糖及以下的寡糖的降解率很小,所以產物中單糖、殼二糖的含量很少。
對比圖9a和圖9b可知,按照法2在溶解過程中加酶,水解過程中聚合度為2~6的殼寡糖的總量以及殼五糖、殼六糖的最大含量均顯著增加(p<0.05),在反應時間10 h時,分別能達到42.7、5.5、3.9 mg/mL,比此前的報道都要高[9-10,19-21],大大提高了生產效率以及節約濃縮成本。
3 結論
實驗所用殼聚糖酶在45~55 ℃及pH4.5~5.5范圍內保持穩定。對于濃度為8%的殼聚糖溶液體系,通過在溶解過程中分批加酶可有效降低體系粘度并保持酶活性,最佳方案如下:殼聚糖在滴加鹽酸濃度達到0.17 mol/L(10 min)時,加入2 U/g殼聚糖的酶液,當鹽酸濃度達到0.48 mol/L溶解30 min后,再補加3 U/g殼聚糖的酶液。薄層色譜和高效液相色譜分析結果表明,通過以上方式的優化,產物中的聚合度2~6的殼寡糖總含量顯著增加(p<0.05),達到42.7 mg/mL;產物中的殼五糖和殼六糖的含量也顯著增加(p<0.05),分別達到5.5和3.9 mg/mL,大大提高了生產效率、節約成本。
[1]Kulikov S,Tikhonov V,Blagodatskikh I,et al. Molecular weight and pH aspects of the efficacy of oligochitosan against methicillin-resistantStaphylococcusaureus(MRSA)[J]. Carbohydrate Polymers,2012,87(1):545-550.
[2]Ngo D H,Ngo D N,Vo T S,et al. Protective effects of aminoethyl-chitooligosaccharides against oxidative stress and inflammation in murine microglial BV-2 cells[J]. Carbohydrate Polymers,2012,88(2):743-747.
[3]Fernandes J C,Eaton P,Nascimento H,et al. Antioxidant activity of chitooligosaccharides upon two biological systems:ErythrocytesandBacteriophages[J]. Carbohydrate Polymers,2010,79(4):1101-1106.
[4]Chung M J,Park J K,Park Y I. Anti-inflammatory effects of low-molecular weight chitosan oligosaccharides in IgE-antigen complex-stimulated RBL-2H3 cells and asthma model mice[J]. International Immunopharmacology,2012,12(2):453.
[5]Deng L,Zeng K,Zhou Y,et al. Effects of postharvest oligochitosan treatment on anthracnose disease in citrus(CitrussinensisL. Osbeck)fruit[J]. European Food Research and Technology,2015,240(4):795-804.
[6]Sinha S,Chand S,Tripathi P. Recent progress in chitosanase production of monomer-free chitooligosaccharides:Bioprocess strategies and future applications[J]. Applied Biochemistry and Biotechnology,2016,180(5):883-899.
[7]Wei C,Liang J T,Yue W,et al. Continuous preparation of low-molecular-weight chitosan by the combination of ozone treatment and membrane separation[J]. Applied Mechanics & Materials,2012,189:16-20.
[8]Chang C T,Lin Y L,Lu S W,et al. Characterization of a chitosanase from Jelly Fig(Ficus awkeotsang Makino)Latex and its application in the production of water-soluble low molecular weight chitosans[J]. Plos One,2016,11(3):e150490.
[9]Sinha S,Chand S,Tripathi P. Production,purification and characterization of a new chitosanase enzyme and improvement of chitosan pentamer and hexamer yield in an enzyme membrane reactor[J]. Biocatalysis and Biotransformation,2014,32(4):208-213.
[10]Jung W J,Park R D. Bioproduction of chitooligosaccharides:present and perspectives[J]. Marine Drugs,2014,12(11):5328.
[11]牛培陽,張立彥. 殼聚糖溶解行為及溶液特性的探究[J].食品工業科技,2017(6):84-89.
[12]董惠忠. 聚合度6-8殼寡糖的制備關鍵技術研究[D]. 上海:華東理工大學,2014.
[13]Dong H,Wang Y,Zhao L,et al. Purification of DP 6 to 8 chitooligosaccharides by nanofiltration from the prepared chitooligosaccharides syrup[J]. Bioresources and Bioprocessing,2014,1(1):1-12.
[14]Izume M,Nagae S,Kawagishi H,et al. Action pattern ofBacillussp. no. 7-M chitosanase on partially N-acetylated chitosan[J]. Biosci Biotechnol Biochem,1992,56(3):448-453.
[15]李星科,縱偉,章銀良,等. 脫乙酰度、pH和離子強度對殼聚糖溶液流變性質的影響[J]. 現代食品科技,2013(1):11-14.
[16]李海濤,王美玲,張友玉,等. 殼聚糖在稀溶液中的聚集行為[J]. 應用化學,2004,21(2):159-163.
[17]吳迪,蔡偉民. 殼聚糖-鹽酸溶液中溫度敏感的相分離行為[J]. 物理化學學報,2002,18(6):554-557.
[18]Fukamizo T,Honda Y,Goto S,et al. Reaction mechanism of chitosanase fromStreptomycessp. N174[J]. Biochemical Journal,1995,311(Pt 2):377-383.
[19]Kuroiwa T,Izuta H,Nabetani H,et al. Selective and stable production of physiologically active chitosan oligosaccharides using an enzymatic membrane bioreactor[J]. Process Biochemistry,2009,44(3):283-287.
[20]Lin Y W,Yichien H,Beenhuang C. Production of high degree polymerized chitooligosaccharides in a membrane reactor using purified chitosanase fromBacilluscereus[J]. Food Research International,2009,42(9):1355-1361.
[21]Ming M,Kuroiwa T,Ichikawa S,et al. Production of chitosan oligosaccharides at high concentration by immobilized chitosanase[J]. Food Science and Technology Research,2006,12(2):85-90.

