微波輔助提取橄欖苦苷及其抗氧化性能研究
王曉杰,黃立新,*,張彩虹,2,謝普軍,2,鄧葉俊
(1.中國林業科學研究院 林產化學工業研究所;生物質化學利用國家工程實驗室;國家林業局林產化學工程重點開放性實驗室;江蘇省生物質能源與材料重點實驗室,江蘇南京 210042;2.中國林業科學研究院 林業新技術研究所,北京 100091)
油橄欖(Oleaeuropaea)為木犀科木樨欖屬的常綠喬木,是世界上重要的經濟作物。我國從1956年開始陸續引進不同品種的油橄欖[1]。油橄欖果實用于榨取橄欖油,而油橄欖葉則作為廢棄物造成資源浪費和環境污染。油橄欖葉中富含多酚、黃酮、糖類、有機酸、皂苷、萜類等活性成分[2-3],近年來酚類物質等活性成分及其經濟利用價值得到更多的關注。其中橄欖苦苷擁有較好的抗氧化、抗菌、抗腫瘤、降血糖能力[4-5]。謝普軍等[6]測定干燥后橄欖葉中橄欖苦苷的含量為6.530 mg/g,高于橄欖果實中的0.042 mg/g。傳統提取橄欖苦苷的熱浸提法存在提取時間長,效率低,溶劑用量大等缺點[7],使得一些新式的提取方法逐漸應用到天然產物的提取中。
微波輔助提取是利用微波能來提高提取效率,利用水等極性物質產生局部過熱,從物料的內部加速內溶物在溶劑中釋放的一種新式提取方法[8-9]。微波萃取的溶劑通常為極性溶劑或者極性溶劑和非極性溶劑的混合物,例如水、乙醇、酸、堿等[10]。這類物質能夠吸收微波,使自身的溫度升高,從而加熱內溶物,使分離速度加快提高萃取效率[11]。黨建中等[12]的研究表明微波輔助提取橄欖苦苷時間極短,達到與超臨界CO2萃取2 h同等效果,僅需3 min,但沒有考察不同提取因素對橄欖苦苷得率的影響。本實驗探索提取時間、提取溫度、料液比、提取功率等因素對橄欖苦苷得率的影響,在單因素實驗的基礎上進行 L9(33)正交實驗,確定最佳提取條件,可為油橄欖葉橄欖苦苷的提取研究提供借鑒。同時測定了最優提取條件下提取物的總多酚、總黃酮含量以及比較了三種干燥方式對油橄欖提取物抗氧化能力的影響。
1 材料與方法
1.1 材料與儀器
油橄欖葉(九峰6號,葉片較厚,灰綠色) 甘肅武都油橄欖中心;無水乙醇、正己烷、甲醇、乙酸乙酯、蒸餾水、氯化鋁、碳酸鈉 南京化學試劑有限公司;DPPH、Folin-Ciocalteu、沒食子酸 美國西格瑪試劑有限公司;蘆丁 百靈威科技有限公司;2,6-二叔丁基-4-甲基苯酚(BHT) 西安沃爾森生物技術有限公司;橄欖苦苷(分析標準品,≥98%) 阿拉丁化學試劑有限公司。
電熱恒溫鼓風干燥箱 上海索普儀器有限公司;電子分析天平 賽多利斯科學儀器有限公司;旋轉蒸發器、循環水式真空泵 上海東璽制冷儀器設備有限公司;紫外可見分光光度計 北京譜析通用儀器有限責任公司;真空干燥箱 上海一恒科學儀器有限公司;wizard 2.0型真空冷凍干燥機 美國VirTis公司;靈巧型粉碎機 上海隆拓儀器設備有限公司;高效液相色譜 日本島津有限公司;MAS-Ⅱ型常壓微波合成/萃取反應工作站 上海新儀微波化學有限公司。
1.2 實驗方法
1.2.1 原料預處理 油橄欖葉自然風干至水分含量9.44%,用粉碎機粉碎,過60目篩,得到粒徑小于0.2 mm的橄欖葉粉末,放入密封袋中,在室溫下避光保存。
1.2.2 橄欖苦苷的提取 1 g橄欖葉粉放入50 mL的三頸圓底燒瓶中,與一定量的溶劑混合均勻,在轉速為400 r/min、微波頻率2450 MHz的條件下,取不同的提取時間、料液比、提取溫度和提取功率進行微波提取橄欖苦苷實驗。提取液趁熱抽濾后,用等量正己烷萃取3次,濃縮提取物,用乙醇定容于100 mL容量瓶中。
1.2.3 標準曲線的制作
1.2.3.1 橄欖苦苷標準曲線的繪制 色譜柱以甲醇∶水(v/v,0.45∶0.55)為流動相,液相色譜的紫外檢測波長、流速及柱溫箱溫度分別為1 mL/min、280 nm和30 ℃。所使用的色譜分離柱為C18ODS2,其規格為Φ4.6 mm×200 mm、填料粒徑為5 μm。
取1.6 mg橄欖苦苷標準品,配制成1.0 mg/mL的標準溶液,分別進樣4、8、12、16、20 μL的體積量。以橄欖苦苷的質量為橫坐標,以峰面積為縱坐標,得橄欖苦苷標準曲線回歸方程為Y=175548.9+282316.2X,R2=0.9949;橄欖苦苷對照品的質量在4~20 μg范圍之內。
1.2.3.2 沒食子酸標準曲線的繪制 對Yu等[13]的方法稍作修改,配制0.1 mg/mL的沒食子酸標準溶液,避光保存;配制0.2 mol/mL的Folin-Ciocalteu溶液,避光保存。分別取0.0、0.2、0.4、0.6、0.8、1.0 mL的沒食子酸標準溶液,加入1.0 mL的Folin-Ciocalteu試劑,混合均勻;加入2.0 mL的15%碳酸鈉溶液,混合均勻;加水定容至10 mL,搖勻,避光靜置反應90 min,用分光光度計測定760 nm處的吸光度。以沒食子酸濃度為橫坐標,吸光度值為縱坐標,繪制標準曲線。標準曲線回歸方程為Y=77.157X+0.0224,R2=0.9974;沒食子酸對照品濃度在0.002~0.010 mg/mL范圍之內。
1.2.3.3 蘆丁標準曲線的繪制 引用鄭媛媛等[14]的方法,測定油橄欖提取物總黃酮含量。以蘆丁標準品濃度為橫坐標,吸光度為縱坐標。標準曲線回歸方程為Y=24.894X+0.0211,R2=0.9981。蘆丁對照品濃度在0.01~0.05 mg/mL范圍之內。
1.2.4 橄欖苦苷得率的計算 得率的計算公式為:Y(%)=C×V/1000/M×100,其中C為提取物中橄欖苦苷的濃度(mg/mL),V為提取液的體積(mL),M為原料的質量(1 g)。
1.2.5 單因素實驗 在料液比1∶40 g/mL、時間2 min、溫度50 ℃、提取功率600 W的情況下,考察乙醇濃度(55%、65%、75%、85%、95%)對橄欖苦苷得率的影響,取最優乙醇濃度,并依次考察提取時間(1、2、3、4、5 min)、料液比(1∶10、1∶20、1∶30、1∶40、1∶50)、提取溫度(20、30、40、50、60 ℃)、微波提取功率(400、500、600、700、800 W)對橄欖苦苷得率的影響。
1.2.6 正交實驗設計 在單因素實驗的基礎上,確定影響橄欖苦苷含量最為關鍵的三個因素:提取溫度、提取時間、料液比,采用 L9(33)正交實驗,因素水平見表1,以橄欖苦苷得率為評價指標,最終獲得微波提取橄欖苦苷優化工藝。
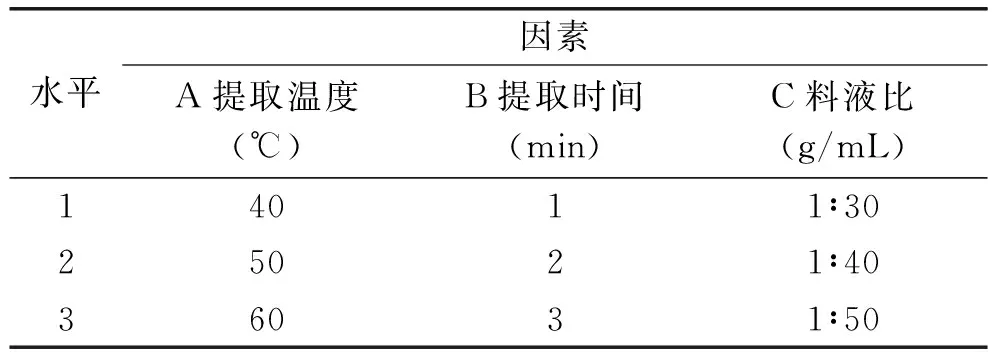
表1 因素水平表Table 1 Factors and levels table
1.2.7 熱浸提提取 根據葉建中等[15]熱浸提優化提取橄欖苦苷的實驗,表明提取時間3 h可作為最佳提取時間,同時選取和微波輔助提取相同的料液比和乙醇濃度作為提取條件進行橄欖苦苷的提取實驗。提取完成后,趁熱抽濾,用等量正己烷萃取三次,用乙醇定容于100 mL的容量瓶中待測。
1.2.8 油橄欖葉提取物的干燥方法以及干燥后水分的測定 取1 g橄欖葉粉以最佳提取條件提取,重復提取6次,將6份提取液合并,并平均分為四份并標記為A、B、C、D,分別在旋轉蒸發儀中(35 ℃)去除乙醇,收集水溶液,將除去乙醇的A溶液放入鼓風干燥機中在30 ℃的條件下干燥24 h,B溶液放入冷凍干燥機在-10 ℃、真空度1.48×10-4MPa下干燥24 h,C溶液放入真空干燥機中在30 ℃、真空度0.08 MPa的條件下干燥24 h。D溶液放入鼓風干燥機中在50 ℃的條件下24 h。采用105 ℃恒重法(烘箱干燥105 ℃,3 h)測定干燥產品的水分含量。分別稱取干燥產品用甲醇配制成0.2、0.4、0.6、0.8、1.0 mg/mL的油橄欖葉提取物溶液。
1.2.9 DPPH自由基清除能力測試 根據 Brand-Williams[16]的方法,用甲醇溶液配制不同濃度的油橄欖葉提取物和0.5 mmol/L的DPPH溶液。取0.5 mL不同濃度的橄欖葉提取物溶液與2.5 mL的DPPH溶液混合均勻,在暗室反應30 min,在517 nm處測量吸光度值,實驗以BHT作為對照。DPPH自由基清除率公式如下:
式中,A0為DPPH醇溶液的初始值;A1為加入橄欖葉提取物溶液后的吸光度值。
1.2.10 ABTS+·清除能力測定 對Re等[17]的方法稍作修改,配制4 mL ABTS+·儲備液,其中過硫酸鉀濃度為2.45 mmol/L,ABTS濃度為7 mmol/L。在黑暗處反應16 h,儲備液用磷酸鹽緩沖液(pH=7.4)稀釋,稀釋40~50倍,使其在734波長處吸光度為0.680~0.720之間。取0.05 mL1.0 mg/mL橄欖葉提取物加入4 mL ABTS+·測定液,振蕩30 s,在734 nm波長處測定反應一段時間后的吸光度。ABTS+·自由基清除率公式如下:

式中,A0為ABTS+·測定液的初始值;A1為加入橄欖葉提取物溶液后的吸光度值。
1.3 數據處理

2 結果與討論
2.1 單因素實驗
2.1.1 提取溶劑的選擇 由圖1可知,甲醇溶液提取效果最好,其次是乙醇,水的得率最低,此結果與謝普軍等[18]不同溶劑的提取效果相似。原因可能是醇溶液的極性與橄欖苦苷的極性相近,根據相似相溶的原理,橄欖苦苷在醇溶液中有很好的溶解性[19]。其次,細胞質主要由脂類等物質構成,醇等脂溶性物質易于進出。考慮到用甲醇或乙醇提取橄欖苦苷得率相近以及甲醇的毒性,所以選用乙醇作為提取溶劑。
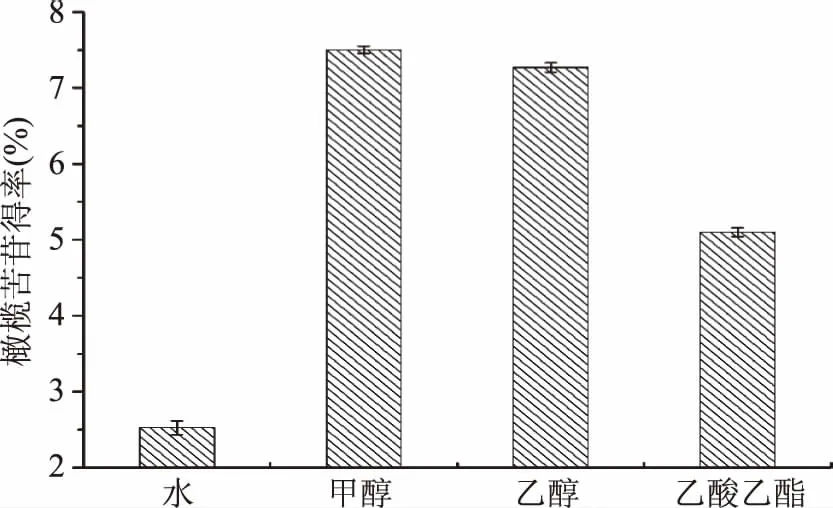
圖1 提取溶劑對橄欖苦苷得率的影響Fig.1 Effects of solvent type on oleuropein yield
2.1.2 乙醇濃度的選擇 由圖2可知,隨著乙醇濃度逐漸升高,橄欖苦苷得率先增加后減少,當乙醇濃度為75%時,橄欖苦苷的得率最高為7.93%。當乙醇濃度超過75%時,橄欖苦苷的得率開始下降,極可能的原因是75%的乙醇濃度的極性與橄欖苦苷的極性相近,橄欖苦苷更易在其中溶解。另外細胞膜主要由脂質、蛋白質構成,控制物質的進出,醇等脂溶性物質更易在細胞中進出[19]。

圖2 乙醇濃度對橄欖苦苷得率的影響Fig.2 Effects of extraction time on oleuropein yield
2.1.3 提取時間的選擇 由圖3可知,橄欖苦苷得率隨著時間的延長先增加后減少,當提取時間為2 min時,橄欖苦苷的提取率最高,可達8.08%,提取時間為3 min時,橄欖苦苷的得率為7.74%,兩者的提取效果相近,說明微波提取在2 min左右完成提取,之后橄欖苦苷得率稍有下降并趨于平穩,從提取效果和時間成本綜合考慮,2 min提取效果最好。
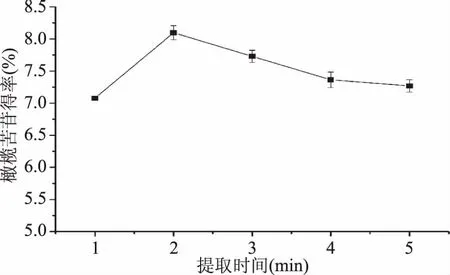
圖3 提取時間對橄欖苦苷得率的影響Fig.3 Effects of extraction time on oleuropein yield
2.1.4 料液比的選擇 由圖4可知,隨料液比增大,橄欖苦苷得率先是增加后趨于平穩。當料液比增加到1∶40時,橄欖苦苷提取得率達到8.25%。在達到1∶40的料液比之前,橄欖苦苷得率與料液比呈現正相關。隨料液比的增大,溶劑中橄欖苦苷濃度降低,濃度差加大,橄欖苦苷不斷從油橄欖葉片中溶解到溶劑中,橄欖苦苷得率增加,當料液比超過1∶40時,橄欖苦苷得率幾乎沒有變化。從節約資源和成本方面考慮,選擇1∶40的料液比作為最佳料液比。
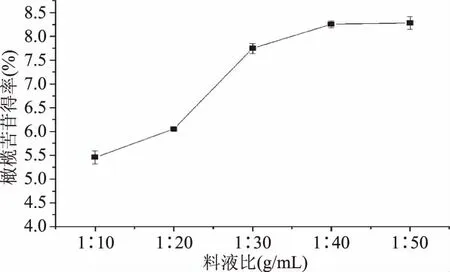
圖4 料液比對橄欖苦苷得率的影響Fig.4 Effects of solid to liquid ratio on oleuropein yield
2.1.5 提取溫度的選擇 由圖5可知,隨提取溫度升高,橄欖苦苷得率先增加后減少,提取溫度為40 ℃橄欖苦苷得率為7.36%提取溫度為50 ℃時,橄欖苦苷得率達到最高為7.51%,兩者非常接近。在50 ℃之前,橄欖苦苷得率與提取溫度呈現正相關,隨溫度升高,物質的傳質傳熱加快,更多的橄欖苦苷在溶劑中溶解,橄欖苦苷得率增加。在50 ℃之后,橄欖苦苷得率幾乎沒有變化,從節約能源的角度考慮,選取提取溫度50 ℃作為最佳提取溫度。

圖5 提取溫度對橄欖苦苷得率的影響Fig.5 Effects of extraction temperature on oleuropein yield
2.1.6 提取功率的選擇 由圖6可知,隨提取功率升高,橄欖苦苷得率先增加后減少,在提取功率為600 W時,橄欖苦苷得率最高為8.02%。微波功率增加,達到預設溫度的時間越短,在更多的時間內維持較高溫度,傳質效率提高,提取效果相對較好。當功率過大時,易于引起溶液劇烈蒸發,從而影響橄欖苦苷溶解。綜合考慮,最佳提取功率為600 W。
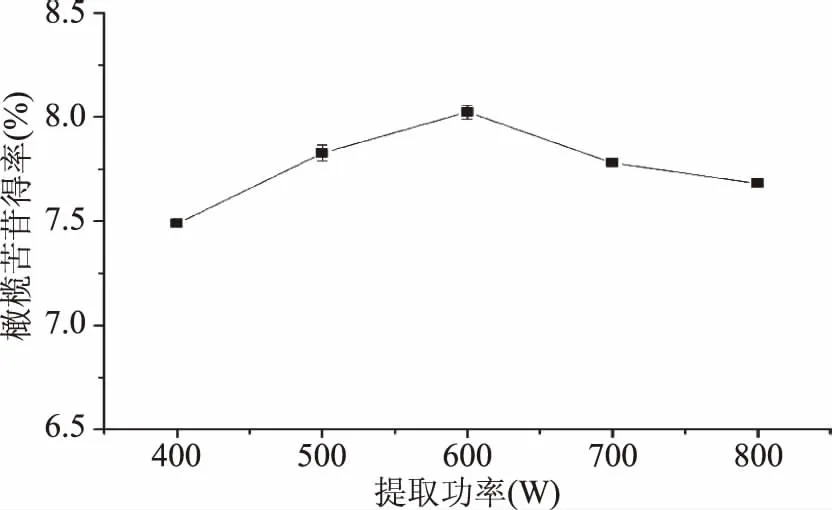
圖6 提取功率對橄欖苦苷得率的影響Fig.6 Effects of extraction power on oleuropein yield
由單因素實驗結果可知,單因素提取橄欖苦苷的優化條件為提取時間為2 min,料液比為1∶40,乙醇濃度為75%,提取溫度為50 ℃,提取功率為600 W。從圖1~圖6中橄欖苦苷得率曲線浮動情況可以看出橄欖苦苷得率變化較大的影響因素為提取溫度、提取時間、料液比。
2.2 正交實驗
正交實驗設計法對橄欖苦苷提取工藝進行三因素三水平優化設計,正交結果見表2,方差分析見表3。由極差和方差結果分析可知,三個因素對提取率的影響順序是料液比>提取時間>提取溫度,最佳工藝條件為A1B3C3,即提取溫度40 ℃,提取時間3 min,料液比1∶50 g/mL。按所得最佳工藝條件進行實驗驗證,三次所得橄欖苦苷提取率平均值為(8.06%±0.06%)。
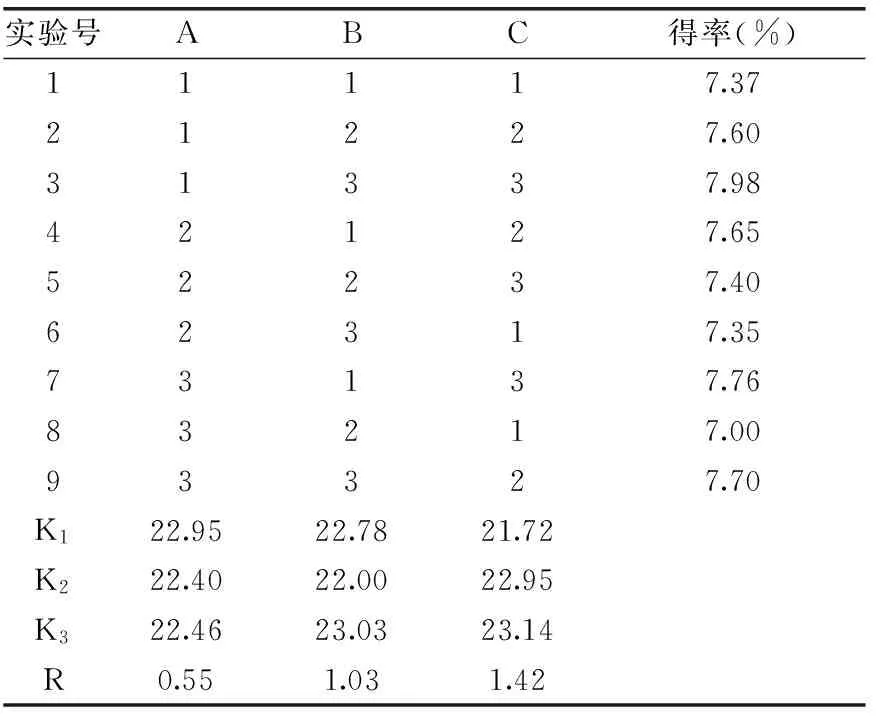
表2 正交實驗設計及結果Table 2 Orthogonal array design arrangement and experimental results
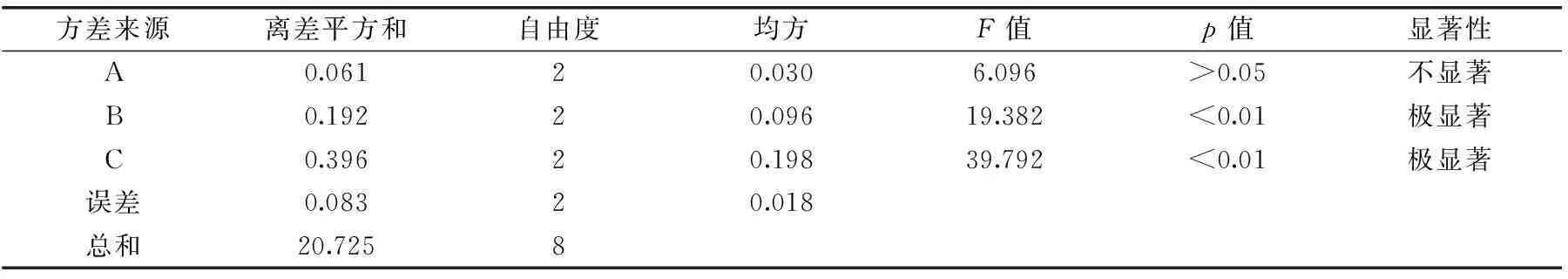
表3 正交實驗方差分析表Table 3 Analysis of variance for the results of orthogonal test
2.3 與傳統提取方法的比較
2.3.1 活性成分含量對比 從圖7可以看出微波輔助提取活性物質的含量優于熱浸提,微波輔助提取橄欖苦苷的含量為8.06%±0.06%,熱浸提為6.61%±0.16%,微波輔助提取橄欖苦苷得率提高了21.94%,且微波所需時間僅為3 min,而熱浸提則需要3 h。微波輔助提取總多酚和總黃酮含量分別為7.85%±0.01%和2.20%±0.11%,同樣高于熱浸提。因此,相對于傳統提取方式,微波輔助提取提取時間短,能耗少,提取效率高等優點。

圖7 不同提取方法活性成分比較Fig.7 Comparison of different extraction method on active components
2.3.2 抗氧化性能對比 分別取1.0 mg/mL油橄欖葉提取物按照1.2.9中的方法測定DPPH自由基清除能力,按照1.2.10中的方法測定ABTS+·清除能力。由圖8可知,微波輔助提取DPPH自由基清除率為73.52%±1.06%,高于熱浸提的55.99%±0.37%。微波輔助提取ABTS+·清除率為52.41%±0.58%稍高于50.85%±0.76%的熱浸提。根據2.3.1,微波輔助提取總多酚和總黃酮的含量明顯高于熱浸提,而多酚和黃酮等活性物質有很好的自由基清除能力[20],因此相比于傳統提取方法熱浸提,微波輔助提取抗氧化性更顯著。

圖8 不同提取方法抗氧化性能比較Fig.8 Comparison of different extraction method on antioxidant properties
2.4 不同干燥方式下橄欖苦苷提取物的DPPH自由基清除能力
橄欖苦苷提取物作為溶液體積過大,易變質,不利于保存,干燥成固體便于保存和運輸,而且不同的干燥方式對于活性物質的抗氧化活性存在影響[21-22],由此探討了三種干燥方式以及鼓風干燥兩種干燥溫度干燥產物的水分含量以及干燥產物對于DPPH自由基清除能力的影響。運用1.2.8中105°恒重法測四種干燥產物的水分含量為真空干燥6.11%、真空冷凍干燥5.91%、鼓風干燥(30 ℃)4.97%,鼓風干燥(50 ℃)4.72%。鼓風干燥(50 ℃)水分含量最少,其次是鼓風干燥(30 ℃),而從由圖7可以看出,鼓風干燥(30 ℃)DPPH自由基清除能力要優于鼓風干燥(50 ℃),說明一部分抗氧化成分在高溫條件下喪失活性[23]。隨油橄欖葉提取物濃度增加,清除DPPH自由基的能力增強,其中鼓風干燥清除自由基能力最強,通過曲線擬合,鼓風干燥(30 ℃)、真空冷凍干燥、真空干燥和鼓風干燥(50 ℃)清除DPPH自由基的IC50值分別為0.65、0.69、0.71和0.83 mg/mL。真空冷凍干燥、真空干燥和鼓風干燥(30 ℃)的干燥產物DPPH自由基清除能力非常接近,說明三種干燥方式所保留的活性物質含量相近。綜上所述,要較大程度地保留提取物的抗氧化活性應采取低溫或真空冷凍的干燥方式。

圖9 不同濃度樣品經不同方式干燥后的DPPH自由基清除效率Fig.9 Different samples on scavenging DPPH radical efficiency
3 結論
在單因素實驗的基礎上,采用三因素三水平正交實驗確定了微波輔助提取橄欖苦苷的最佳提取工藝:乙醇濃度75%,料液比 1∶50 g/mL,提取溫度40 ℃,提取時間 3 min,提取功率600 W。在此條件下,橄欖苦苷得率為8.06%±0.06%,總多酚含量為7.85%±0.01%,總黃酮含量為2.20%±0.11%。將傳統提取方式熱浸提與微波輔助提取進行比較,前者橄欖苦苷得率為6.61%±0.16%,而微波輔助提取的得率為8.06%±0.06%,說明微波輔助提取具有提取時間短、效率高、能耗少等優點,是天然活性成分提取的一種有效的提取手段。比較三種干燥方式以及鼓風干燥兩種干燥溫度DPPH自由基清除能力,真空冷凍干燥、鼓風干燥(30 ℃)、鼓風干燥(50 ℃)以及真空干燥的IC50值分別為0.69、0.65、0.83和0.71 mg/mL,說明低溫或真空冷凍干燥能較大程度的保存提取物的活性。
[1]王貴禧,俞寧,鄧明全,等. 中國油橄欖發展概況[J]. 林業實用技術,2000(1):18-19.
[2]朱靜平. 油橄欖葉中活性成分初步分析[J]. 湖北農業科學,2012,51(15):3315-3317.
[3]王百川,付紹平,王丹,等. 超高壓液相色譜-飛行時間質譜法分析國產油橄欖葉中酚類化合物[J]. 食品科學,2011,32(18):225-229.
[4]郝婷,崔建玲,趙桂琴,等. 橄欖苦苷提取分離和藥理活性的研究進展[J]. 承德醫學院學報,2010,27(1):69-72.
[5]吳遵秋,姜友軍,蘇光燦,等. 油橄欖葉中橄欖苦苷的體外抗氧化和抑菌活性[J]. 食品科學,2014,35(21):94-99.
[6]謝普軍. 油橄欖葉高值化利用技術及機理研究[D]. 北京:中國林業科學研究院,2015.
[7]葉建中,高彩霞,周昊,等. 油橄欖中橄欖苦苷的提取及純化工藝研究[J]. 生物質化學工程,2011,45(3):35-40.
[8]Kaufmann B,Christen P. Recent extraction techniques for natural products:Microwave-assisted extraction and pressurised solvent extraction[J]. Phytochemical Analysis,2002,13(2):105-113.
[9]Destandau E,Michel T,Elfakir C. Microwave-assisted extraction[M]. UK:RSC Publishing,Cambridge,2013.
[10]Eskilsson C S,Bj?rklund E. Analytical-scale microwave-assisted extraction[J]. Journal of Chromatography A,2000,902(1):227-250.
[11]劉明言,王幫臣. 用于中藥提取的新技術進展[J]. 中草藥,2010,41(2):169-175.
[12]黨建章,黃志立,張志安,等. 橄欖葉中橄欖苦苷不同提取方法的研究[J]. 深圳職業技術學院學報,2006,5(4):34-36.
[13]Yu X,Zhu P,Zhong Q,et al. Subcritical water extraction of antioxidant phenolic compounds from XiLan olive fruit dreg[J]. Journal of Food Science and Technology,2015,52(8):5012.
[14]鄭媛媛,李辰,封士蘭,等. 油橄欖葉中總黃酮含量測定方法探討[J]. 光譜學與光譜分析,2011,31(2):547-550.
[15]葉建中,高彩霞,周昊,等. 油橄欖中橄欖苦苷的提取及純化工藝研究[J]. 生物質化學工程,2011,45(3):35-40.
[16]Brand-Williams W,Cuvelier M E,Berset C. Use of a free radical method to evaluate antioxidant activity[J]. LWT-Food Science and Technology,1995,28(1):25-30.
[17]Re R,Pellegrini N,Proteggente A,et al. Antioxidant activity applying an improved ABTS radical cation decolorization assay[J]. Free Radical Biology & Medicine,1999,26(9-10):1231-1237.
[18]謝普軍,黃立新,張彩虹,等. 低溫減壓沸騰提取橄欖苦苷的工藝研究[J]. 中國中藥雜志,2012,37(13):1946-1951.
[19]孫雅才. 細胞膜的不對稱性與流動性[J]. 生物學通報,1986(8):16-18.
[20]羅成,周達,魯曉翔. 天然產物抗氧化機理的研究進展[J]. 食品工業科技,2009(4):335-339.
[21]陳瑋琦,郭玉蓉,張娟,等. 干燥方式對蘋果幼果干酚類物質及其抗氧化性的影響[J]. 食品科學,2015,36(5):33-37.
[22]王麗威,金佳慧,于錦,等. 干燥方式對香菇酚類物質抗氧化活性的影響[J]. 食品工業科技,2015,36(9):132-135.
[23]曹立民,張瑾,陳明霞.制備條件對于生姜提取物抗氧化活性的影響.[J]. 食品工業,2001(4):36-38.

