經典孔隙結構鈦合金內置物在兔肱骨近端大結節處骨長入的初步組織學研究
薛喆 宋關陽 李奉龍 姜春巖
采用傳統人工肩關節假體置換治療復雜肱骨近端骨折,術后大結節不愈合是最常見的并發癥,嚴重影響肩關節功能,降低手術療效[1]。目前臨床應用的多孔涂層假體存在一定的缺陷,如低孔隙率、涂層與假體構架空間的界面剪切力以及原電池效應等,可影響骨長入、降低假體的生物固定強度。而通過電子束熔融技術制備的經典正六面體孔隙結構鈦合金生物型內置物可以克服傳統涂層假體的缺點,理論上可進一步改善骨長入效果。
本研究采用新西蘭大耳兔進行動物實驗,將經典孔隙結構即正六面體孔隙結構的鈦合金生物型內置物植入大兔肱骨近端大結節處,旨在通過組織學切片研究證實:①隨著時間的演變,經典孔隙結構的鈦合金金屬在肱骨近端是否具備骨長入潛能;②植入鈦合金生物型內置物后隨時間的演變骨長入的組織學特點如何。
本研究可為鈦合金生物型內置物在肩關節外科領域的應用以及設計加強大結節愈合的骨折型人工肩關節假體提供理論和依據。
材料與方法
一、實驗動物及分組
于2015年5月至2016年11月在本院動物實驗室,將成年雄性新西蘭大耳白兔15只隨機分為3組,體質量2.41~2.70 kg,兔齡4個月,單籠普通飼料喂養,術前觀察1周,確認體健無疾病。實驗過程對動物的處置符合醫學倫理學標準。
二、方法
兔肱骨近端生物型內置物植入模型的建立:以速眠新Ⅱ注射液0.2 ml/kg對實驗動物進行肌肉注射以施行全身麻醉,麻醉成功后將其置于左側臥位。術區備皮、清潔,常規消毒,鋪無菌單。在肩關節做長約2 cm的縱行皮膚切口。鈍性分離三角肌,顯露大結節,見圖1A。于大結節止點處,使用2.0克氏針,穿過肱骨干的中心,并與肱骨遠端長軸成約120°鉆入,將經典孔隙結構的鈦合金螺釘(圖2、3)沿骨道方向置入,建立肱骨近端鈦合金生物型內置物植入模型,如圖1B。檢查無活動性出血后逐層關閉傷口。
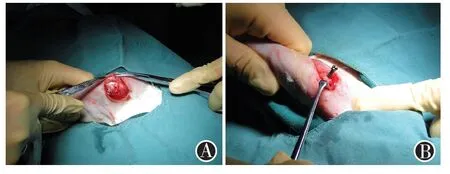
圖1 骨長入模型建立 圖A鈍性分離兔三角肌,顯露大結節;圖B將經典孔隙結構的鈦合金螺釘與肱骨遠端長軸成約120°打入骨質,建立肱骨近端鈦合金生物型內置物植入模型

圖2 經典結構鈦合金內置物,以正六面體網格為基礎單元向周圍空間規律排布

圖3 螺釘實物圖(每刻度為1mm)
三、造模后處理
觀察家兔自然蘇醒,常規進食。始終置于兔籠(65 cm×40 cm×40 cm)中限制活動,患肢不制動,造模后前3 d,肌肉注射青霉素4×105 U預防感染。分別于術后3、6、12周這三個時間點隨機選取實驗兔進行樣本標本采集。保留肱骨頭至其遠端3 cm的骨標本,去除所有肌肉以及軟組織。使用中性福爾馬林固定48 h,再使用梯度酒精(70%、80%、90%)脫水7 d,100%脫水2次,每次2 d。使用Technovit 7200VLC光固化樹脂浸透1個月后,行光固化包埋。再應用德國EXAKT硬組織切磨系統制片(EXAKT 400 CS/AW Micro Grinding System),平行肱骨干長方向切割,以解剖軸為中心,內外側分別留有約1mm骨組織,切成厚度大約為2mm的標本后,行甲苯胺藍染色。后于光學顯微鏡下,采用×4倍放大率進行圖像采集。骨長入面積的測量使用Image-Pro Plus軟件進行圖像的處理分析。在矢狀位切片上做一個可包含螺釘長徑a和寬徑b的矩形,則總面積S0=a×b,在計算出此矩形去除螺釘后的總面積S1及可被甲苯胺藍著色的組織面積Sx,定義骨長入面積S%=Sx/S1×100%(圖4)。所有的組織學測量均由同一操作者完成。

圖4 骨長入面積測量,此圖為沿螺釘矢狀位切割后的組織學切片,其中黑色為螺釘部分(右側為螺母部分),紫色部分為長入螺釘空隙內的骨質。取可包含螺釘體部的矩形,最長徑為a,最寬徑為b(黃色示),則總面積S0=a×b,使用Image-Pro Plus軟件計算出此矩形中去除螺釘后的總面積S1及可被甲苯胺藍著色的組織面積Sx,則骨長入面積百分比S%=Sx/S1×100%
四、觀察指標
①定性觀察:觀察隨著時間的演變,生物型內置物骨長入的大體情況。②定量測量:骨長入面積百分比隨時間的變化情況。
五、統計學分析
使用SPSS 20.0 軟件進行統計學分析,數據由均值±標準差表示,評估三個時間點下骨長入面積百分比的差異,采用ANOVA方差分析。P <0.05為差異有統計學意義。
結 果
一、實驗動物數量分析
15只兔術后健康狀況良好,均于造模當天開始自主進食。觀察期間無傷口感染及非預計性死亡發生。在建模操作過程中,家兔的肩關節局部解剖結構與人類相似,手術入路的相關解剖位置比較恒定,肩關節大結節生物型內置物植入模型的建立操作過程可重復性高。
二、生物型內置物骨長入情況隨時間演變的大體變化情況
由鏡下組織學切片染色大體來看,在3、6、12周這三個時間點,如圖5所示,可見螺釘空隙內軟骨細胞數量成正增長趨勢,且分布的范圍逐漸擴大。
三、骨長入百分比隨時間的變化情況
15個樣本的組織學測量結果如表1所示, 組織學數據顯示在骨長入百分比方面三個時間點之間總體上差異有統計學意義,且12周時的骨長入面積百分比相比3周(P <0.05)和6周(P <0.05)都有顯著性的增長; 但3周和6周這兩個時間點骨長入面積百分比差異無統計學意義(P >0.05),如表2所示。
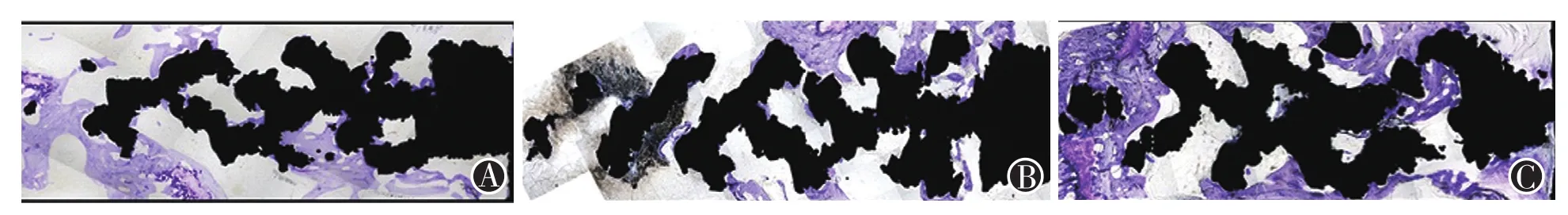
圖5 不同時間點螺釘骨長入面積情況 圖A、B、C分別為3、6、12周時骨長入螺釘孔隙的鏡下情況。其中黑色為螺釘部分(右側為螺母部分),紫色部分為長入螺釘空隙內的骨組織,可見螺釘空隙內軟骨細胞數量成正增長趨勢,且分布的范圍逐漸擴大
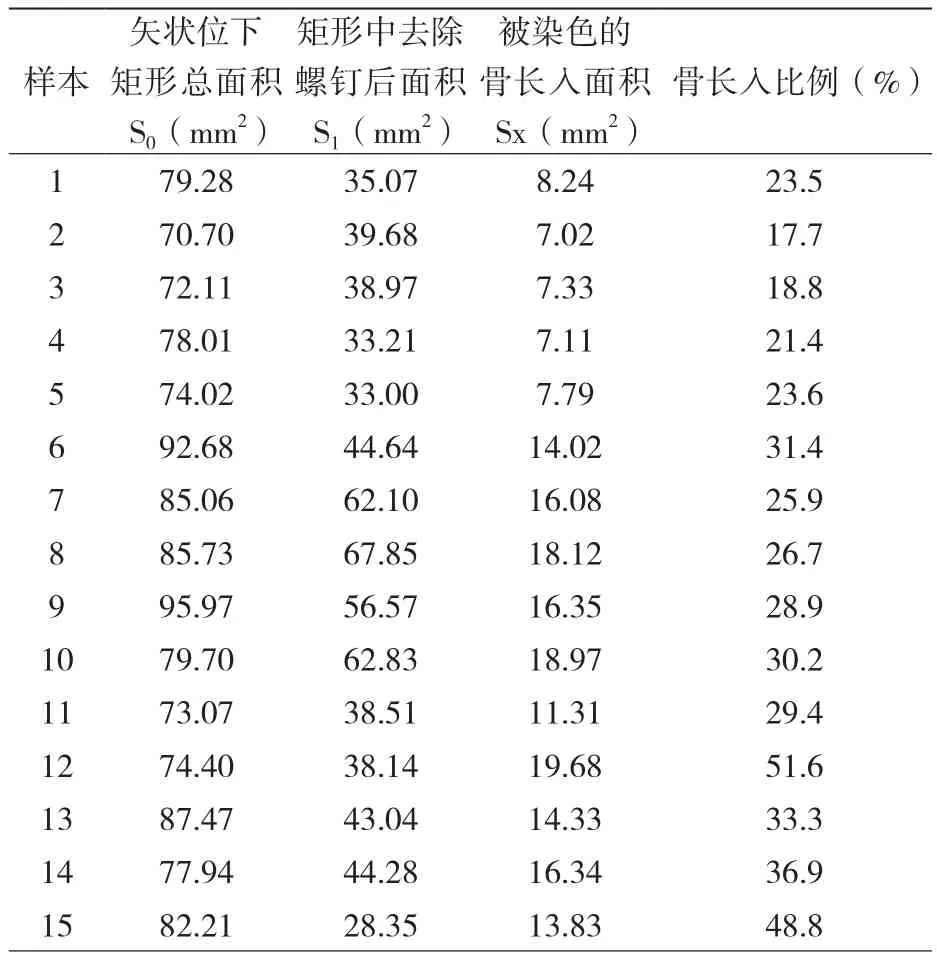
表1 15個樣本組織學測量結果
表2 三個時間點骨長入面積百分比情況(±s)
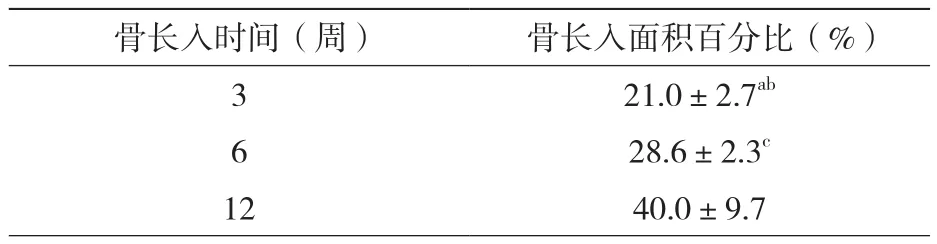
表2 三個時間點骨長入面積百分比情況(±s)
注:與6周比較,aP>0.05;與12周比較,bP<0.05;與12周比較,cP<0.05
骨長入時間(周) 骨長入面積百分比(%)321.0±2.7ab 28.6±2.3c 12 40.0±9.76
同時制作出了骨長入面積百分比在三個時間點上的柱狀圖(圖6)及隨時間變化折線圖(圖7),并對骨長入面積百分比及相對應的時間進行函數擬合,發現在3個月內,骨長入隨時間的變化成對數關系(圖8),S%=13.706ln(T) + 5.3095;R2=0.9868
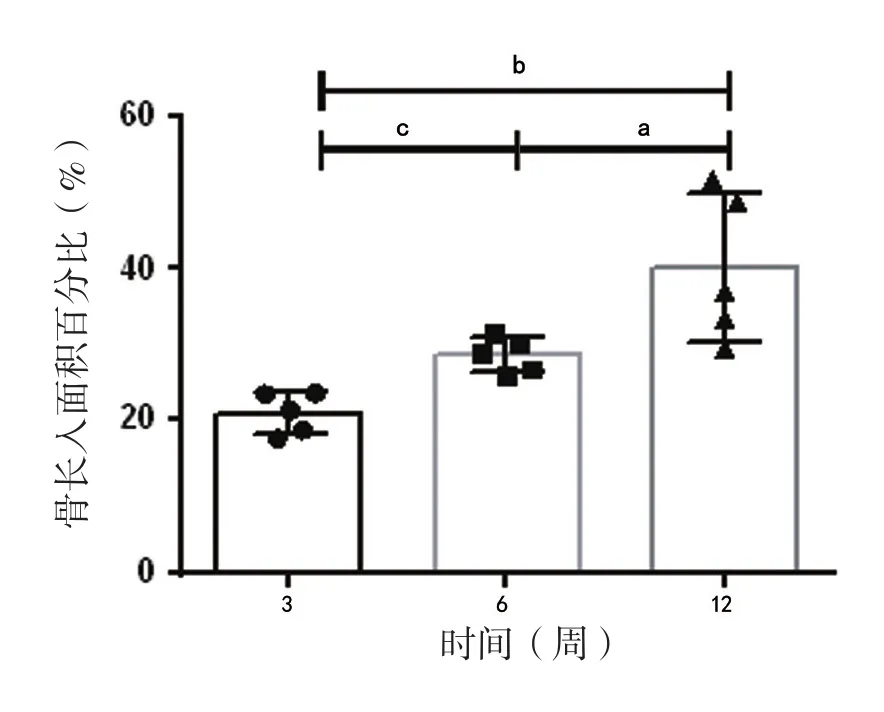
圖6 3、6、12周時骨長入面積百分比比較情況
圖7 骨長入面積百分比隨時間變化折線圖
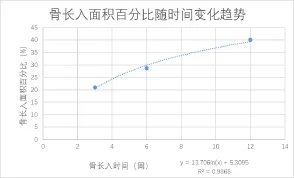
圖8 骨長入面積百分比與時間的函數關系
討 論
本研究通過組織學證實,隨著時間的推移經典孔隙結構鈦合金生物型內置物在大兔肱骨近端的骨長入面積比例不斷增加,且在12周內骨長入面積與時間成指數關系,增長速度逐漸變慢。
目前,鈦合金金屬假體作為新興的骨長入材料,與之相關的基礎及臨床研究較為有限[1],有關鈦合金金屬應用于肩關節假體的基礎及臨床研究在國內外亦屬空白。而國內外有關鈦合金內置物植入骨組織后骨長入隨時間演變的組織學研究也未見報道。
經典孔隙結構的鈦合金金屬是以鈦合金為原料,采用電子束熔融技術制備成的新型金屬材料,其以六面體網格為基礎單位向周圍空間規律排布發散形成的幾何結構。雖然已有研究證明此種空間構型骨長入的確實性[1],但對于該種孔隙結構的鈦合金金屬植入骨組織后骨長入情況也無定論。因此設計實驗進行研究。
肱骨近端骨折是肩關節外科的常見疾病,其中對于老年粉碎性Neer四部分骨折以及部分三部分骨折患者,老年解剖頸骨折患者,肱骨頭劈裂、骨折脫位患者等情況,應采用肩關節置換術治療[1-5]。雖然人工肩關節置換治療肱骨近端骨折可以較好的緩解患者的疼痛,但對于術后肩關節功能恢復的文獻報道結果不一致[1,6-7]。近年來大部分研究報道采用人工肩關節置換術治療肱骨近端骨折術后患者疼痛滿意度在80%左右[1],但是患者術后肩關節活動度及功能恢復并不理想。目前學術界認為其影響因素主要包括:假體高度、后傾角、大結節位置、功能鍛煉的時機選擇等[8-11],其中大結節的解剖愈合狀況是位移被大多數學者一致認同,影響術后肩關節功能的重要因素[1],因此,肩關節假體置換術后的大結節不愈合是肩關節置換術后的最常見并發癥之一。
接受人工肩關節置換術的患者群主要特點為高齡、骨質疏松、骨折粉碎程度嚴重、骨折周圍組織條件差、骨折缺血供應破壞嚴重[3]。大結節作為肱骨近端重要的解剖結構和功能單位,其與假體間的愈合狀況必然是受到以上因素的影響,進而降低了人工肩關節置換的手術療效。
關于影響大結節愈合的因素,目前文獻報道的影響人工肩關節假體置換術后大結節愈合的主要因素包括患者年齡、性別、骨質狀況、假體的置入位置、肩袖質量以及假體類型[1],高齡、女性患者以及明顯骨質疏松者術后大結節不愈合發生率明顯增高。目前應用較多的假體類型是在原有假體構架基礎上,于假體近端通過特殊工藝制備多孔涂層,進而促進固定于此處大結節與假體的骨長入,理論上改善術后大結節的愈合狀況,但是相關的臨床多中心回歸分析研究發現大結節的愈合率仍不能達到滿意的效果[1,12]。因此如何通過相關基礎研究為改善假體設計進而提高術后大結節的愈合率提供必要的理論及實踐依據是肩關節外科的重要課題。
對于行肩關節置換術的患者,絕大多數文獻都認為術后康復是評價手術成功與否的關鍵因素之一[1,13]。在本研究中,發現在內置物植入早期(12周內),螺釘空隙內的軟骨細胞在不斷的增長,其長入面積以及范圍在不斷的擴大。組織學分析發現3周和6周的骨長入面積百分比差異無統計學意義,而3周與12周以及6周與12周相比差異均有明顯的統計學意義,即12周相對于3周和6周骨質生長更加明顯。且至少在12周內,骨質的生長與時間成指數關系,表明骨長入速度在術后早期為峰值,隨時間的延長逐漸變慢,且經驗性臨床觀察表明在術后10~12周時肌腱的愈合才足以支持早期的肌肉訓練以及主動活動[14-15]。因此術后早期為骨質生長的重要時期,同樣也是肩關節穩定性形成的關鍵時機,如過于激進的進行術后主動功能練習及肌肉訓練,則會干擾大結節的愈合過程,甚至導致術后失效[16]。因此在術后的康復過程中,特別是內置物植入的早期(12周內)需要嚴格遵循術后康復流程,避免早期主動功能鍛煉以及力量訓練,為內植物與骨質之間的愈合提供良好的力學環境,降低術后并發癥的發生率。
本研究還有以下幾點不足:第一,入組的實驗動物樣本量較小,且飼養時間相對較短,缺少更長期的研究跟進。第二,缺少對照組,沒有與傳統空隙結構的生物型內置物的骨長入情況進行對比。第三,本研究只進行了組織學切片研究,沒有相應的生物力學實驗進行佐證,因此還需要后續的生物力學研究進一步證實經典孔隙結構鈦合金生物型內置物的有效性及安全性。
綜上所述,本研究通過組織學切片證實,隨著時間的推移經典孔隙結構鈦合金生物型內置物在大兔肱骨近端的骨長入面積比例不斷增加。在12周內,骨長入面積與時間成指數關系,增長速度逐漸變慢。本研究結果提示在臨床中需要更加嚴格得遵守肩關節置換術后主動功能鍛煉的康復流程,降低術后并發癥的發生。
[1] Reuther F, M ü hlh?usler B, Wahl D, et al. Functional outcome of shoulder hemiarthroplasty for fractures: A multicentre analysis[J].Injury, 2010, 41(6): 606-612.
[2] Fialka C, Stampfl P, Arbes S, et al. Primary hemiarthroplasty in four-part fractures of the proximal humerus: Randomized trial of two different implant systems[J]. J Shoulder Elbow Surg, 2008,17(2): 210-215.
[3] Anjum SN, Butt MS. Treatment of comminuted proximal humerus fractures with shoulder hemiarthroplasty in elderly patients[J].Acta Orthop Belg, 2005, 71(4): 388-395.
[4] Boileau P, Krishnan SG, Tinsi L, et al. Tuberosity malposition and migration: reasons for poor outcomes after hemiarthroplasty for displaced fractures of the proximal humerus[J]. J Shoulder Elbow Surg, 2002, 11(5): 401-412.
[5] Robinson CM, Page RS, Hill RM, et al. Primary hemiarthroplasty for treatment of proximal humeral fractures[J]. J Bone Joint Surg Am, 2003, 85(7): 1215-1223.
[6] Kralinger F, Schwaiger R, Wambacher M, et al. Outcome after primary hemiarthroplasty for fracture of the head of the humerus. A retrospective multicentre study of 167 patients[J]. J Bone Joint Surg Br,2004,86(2):217-219.
[7] Krishnan SG, Bennion PW, Reineck JR. Hemiarthroplasty for proximal humeral fracture: restoration of the Gothic arch[J].Orthop Clin North Am, 2008, 39(4): 441-450.
[8] Grassi F, Tajana MS. Partial prosthetic replacement of the shoulder in fractures and fracture-dislocations of the proximal humerus[J].Chir Organi Mov, 2005, 90(2): 179-190.
[9] 朱以明,姜春巖,王滿宜.人工肱骨頭置換術中大結節與假體背翅間相對位置的解剖學研究[J].中華外科雜志,2006,44(20):1427-1429.
[10] 姜春巖,朱以明,魯誼,等.人工肱骨頭置換術中大結節不同固定方式的穩定性研究[J].中華骨科雜志,2006,26(7):459-463.
[11] 姜春巖,朱以明,魯誼,等.人工肱骨頭置換術后大結節影像學改變對肩關節功能的影響[J].中華骨科雜志,2007(27):505-508.
[12] Reuther F, Muhlhausler B, Wahl D, et al. Functional outcome of shoulder hemiarthroplasty for fractures:A multicentre analysis[J].Injury, 2010, 41(6): 606-612.
[13] Brems JJ. Rehabilitation following total shoulder arthroplasty[J].Clin Orthop Relat Res, 1994(307): 70-85.
[14] Wilcox RB, Arslanian LE, Millett PJ. Rehabilitation following total shoulder arthroplasty[J]. J Orthop Sports Phys Ther, 2005, 35(12): 821-836.
[15] Boardman ND 3rd,Cofield RH,Bengtson KA,et al.Rehabilitation after total shoulder arthroplasty[J].Arthroplasty, 2001, 16(4):483-486.
[16] Li F, Zhu Y, Lu Y, et al. Hemiarthroplasty for the treatment of complex proximal humeral fractures: does a trabecular metal prosthesis make a difference? A prospective, comparative study with a minimum 3-year follow-up[J]. J Shoulder Elbow Surg,2014, 23(10): 1437-1443.

