真菌漆酶在綠色化學中的研究進展
龔睿 孫凱 謝道月
(農田生態保育與污染防控安徽省重點實驗室 安徽農業大學資源與環境學院 合肥230036)
漆酶是一種含銅的多酚氧化酶,它能夠以氧分子作為最終的電子接受體催化氧化酚類和非酚類底物的氧化、降解或聚合反應[1-2]。目前,自然界中關于漆酶的研究主要集中于真菌分泌的胞外漆酶,分泌漆酶的真菌主要包括擔子菌門(Basidiomycota)、子囊菌門(Ascomycota)和半知菌類(Deuteromycota),其中最重要的是擔子菌門中的白腐真菌[3-5]。漆酶的催化活性中心包含3個Cu2+結合位點,共結合4個Cu2+協同介導酚類和非酚類底物的催化氧化反應[6-8]。Park等[9]主要采用紫外分光光度法測定漆酶的催化氧化活性,其常用的顯色底物包括2,2-聯氮-二(3-乙基-苯并噻唑-6-磺酸)二銨鹽(ABTS)、2,6-甲氧基苯酚(DMP)和愈創木酚等。漆酶對不同底物的親和力和催化效能具體表現在米氏常數(Km)和最大反應速率常數(Vmax)值上[10-12]。
漆酶的底物廣譜性和多功能特征決定了其能夠作為一種環境友好型“綠色催化劑”,并在各個領域得到廣泛地應用[13-14]。例如,漆酶已經用于有機污染物轉化、合成染料脫色、造紙廢水、食品加工、生物傳感器和環境質量指示器等諸多綠色環境化學工程中[15-20]。此外,固定化技術的快速發展也為增強真菌漆酶在環境中的催化活性、穩定性和循環再利用能力提供了可靠保障[7,21]。本文綜述了真菌漆酶的分子組成、結構特征及其催化氧化酚類和非酚類底物的作用機制,系統地比較了固定化漆酶的制備技術及其優缺點,重點剖析了真菌漆酶在綠色環境化學中的最新研究進展及其潛在的應用價值,旨在為拓展和開發固定化漆酶技術解決環境領域面臨的諸多問題提供有力的參考依據。
1 真菌漆酶的分子組成、結構特征及其催化機制
1.1 分子組成和結構特征
漆酶分子一般由單一多肽組成,共含有18種氨基酸(約500-550個)。真菌漆酶是一種酸性等電點單體糖蛋白,其分子量為40-110 kD,糖基化程度占10%-25%[22-23]。一方面,糖基化對真菌漆酶的分泌、異源性生產、催化活性和穩定性等均可能產生不同程度的影響且難以克服;另一方面,糖基化也可以防控漆酶的蛋白質降解[24-25]。漆酶的蛋白質晶體結構研究結果表明[11,26],漆酶含有3個Cu2+結合位點,根據氧化還原電勢、光學和磁學特征可分為 3 種類型:T1(I Cu2+)、T2(II Cu2+)和 T3(IIIa Cu2+和IIIb Cu2+)(圖 1-A、B)。第一類(T1)和第二類(T2)各1個,是單電子受體,呈順磁性。漆酶的T1位點在610 nm處有強烈的光吸收作用,導致漆酶呈現出藍綠色,其吸收光譜帶來源于Cu2+與半胱氨酸的共價結合;漆酶介導的底物催化氧化過程發生在T1位點,它可以從底物中獲取電子并傳遞給水中的溶解氧分子[11,27-28]。漆酶的T2位點不穩定,由兩分子咪唑和單分子水配位形成松散的扭曲四面體幾何構型,在可見光區的吸收峰較弱;當有螯合劑存在時,T2位點能夠被選擇性的還原去除,從而導致漆酶的活性顯著性下降[29]。漆酶的第三類(T3)位點呈反磁體,由兩個III Cu2+構成一個雙核銅簇中心,該銅簇中心在330 nm的紫外可見光譜處具有明顯地吸收峰[24,27,30-31]。漆酶的 T1、T2 和 T3位點共同構成銅簇位點的四面體幾何構型(圖1-A)。
1.2 漆酶的作用機制
真菌漆酶能夠催化氧化酚類和非酚類底物的單電子氧化產生自由基中間體,隨后這些自由基中間體涉及到氧化耦合或目標底物的鍵斷裂,最終導致底物發生氧化、降解或聚合反應(圖1-C)。酶促反應過程主要包括漆酶分子對底物的作用、電子在漆酶分子中的傳遞、氧分子對漆酶分子的還原和產物的反作用[25],即T1活性位點的Cu2+從還原態的底物吸收電子,底物被氧化形成自由基,從而導致不同非銅簇的次級反應,如羥化、歧化和聚合反應等。真菌漆酶的整個催化循環過程中,單個分子的氧被還原成兩個分子的水,4個底物分子被氧化形成4個自由基中間體[6,32]。芳烴類、抗生素、藥物和木質素等大分子或具有較高氧化還原電勢的底物分子需要氧化還原介質的參與才能被漆酶催化氧化[27,33-35]。這些介質分子與漆酶進行反應,生成的自由基狀態分子再氧化大體積或高氧化還原電勢的底物分子[36]。以芳烴類化合物為例,漆酶分子催化氧化芳烴類化合物,首先從底物傳遞一個電子到專門的含銅位點以形成自由基,這些自由基能夠重新排列并通過歧化或互變異構化等反應生成等量的醌和氧化底物,并進一步促使烷基-苯基裂開,苯基醇氧化及支鏈和芳香環裂解[37-39]。
2 固定化真菌漆酶的制備及其優缺點
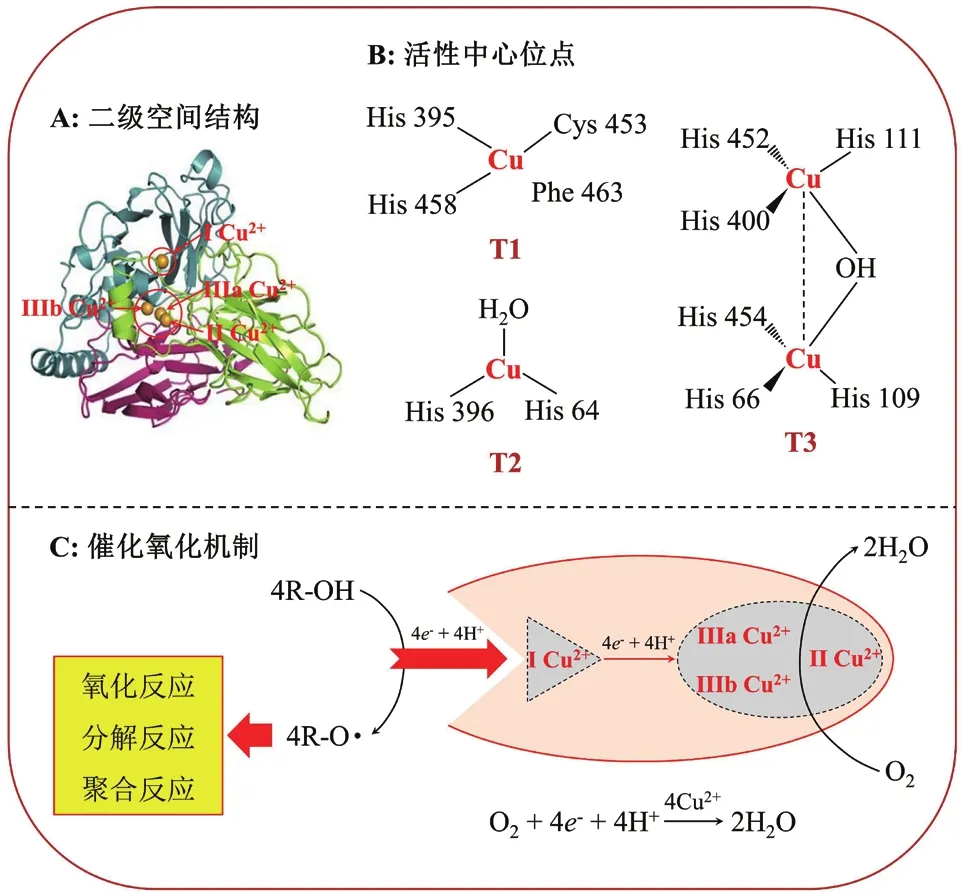
圖1 真菌漆酶的二級空間結構、活性中心位點和催化氧化功能示意圖
雖然,漆酶作為一種“綠色催化劑”具有低成本、高效率、環境友好和可持續等優點,但是,其在綠色環境化學中的應用受到諸多限制,如缺乏長期的穩定性、難以回收和循環再利用等[26]。此外,漆酶的活性也會受到溫度、pH、金屬離子和抑制劑等諸多環境因子的影響,其作用機理可能是氨基酸的修飾作用、酶空間結構的改變或者是與底物結合位點的相互作用[40]。如何增強漆酶的催化活性、穩定性和循環再利用功效是推廣其在環境中應用的首要任務。研究指出[7,41],采用吸附、包埋、共價綁定和交聯結合等方法(圖2)將游離態漆酶固定在載體上制備固定化漆酶,可以提高漆酶的催化活性、穩定性和重復利用率,增強漆酶在實際環境中的應用。常用的固定化載體具有以下特點[7,41]:(1)載體材料易獲得且價格低廉;(2)固定化操作簡便且能用于大規模生產;(3)載體機械強度高且具有較長的使用周期和重復利用率。
2.1 吸附法
吸附法包括物理吸附法和離子吸附法。(1)物理吸附法是指將漆酶液與活潑吸附載體接觸,利用分子間相互作用力使酶吸附在載體表面[21]。采用物理吸附法固定漆酶的研究中,常用的載體包括石墨、纖維素和活性炭等可導電物質,它們能夠與漆酶形成高性能的生物傳感器,可以用來監測水溶液中的酚類物質。物理吸附的優點是固定化技術簡單、可供選擇的載體較多、不會改變酶的空間構象和催化性能等,其主要的缺點是酶和載體之間的結合力較弱、固定化酶的可重復利用率低[42]。(2)離子吸附法是指將漆酶與含有離子交換基團的疏水性載體以靜電作用力相結合的一種固定化方法,其常用的載體有陰離子交換劑和陽離子交換劑[43]。該方法反應條件溫和且不會改變漆酶的空間結構和活性中心的氨基酸序列,可以獲得較高活性的固定化漆酶。
2.2 包埋法
包埋法分為網格型和微囊型兩種,即將漆酶包裹于凝膠形成的網絡結構中或半透膜聚合物的超濾膜內,從而實現漆酶的固定化[44]。包埋法主要采用惰性材料作為載體,維持酶促反應過程中漆酶的活性,其優點是反應條件溫和、不會引起漆酶的空間構象和分子結構變化、漆酶活性和回收利用率較高[45]。(1)凝膠包埋法。凝膠包埋法常用的載體包括海藻酸鈉凝膠、瓊脂凝膠、明膠和角叉萊膠等。例如,采用明膠和海藻酸鈉的聚合作用與海藻酸鈣凝膠球的包埋作用制備固定化漆酶,不僅可以延長固定化漆酶的使用周期,也能夠提高其機械強度和穩定性。(2)微囊包埋法。微囊包埋法可以使漆酶存在于類似細胞內的環境中,增強漆酶的穩定性,其常用的載體有硝酸纖維素、乙基纖維素和聚苯乙烯等[45]。代云容等[46]研究指出,采用乳液靜電紡絲技術將漆酶包埋在纖維內部,能夠顯著增強漆酶對pH和溫度等環境因素變化的耐受性,其穩定性得到顯著性提高。
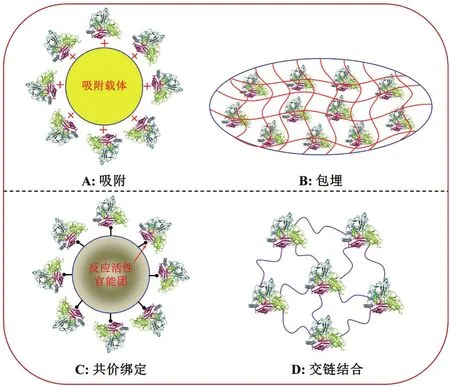
圖2 漆酶的固定化技術
2.3 共價綁定法
漆酶的共價綁定法一般分為兩類:一是將固定化載體上的有關基團用二酰亞胺等活化,隨后與漆酶發生偶聯反應;二是在載體上加入一個雙功能試劑,然后將漆酶偶聯上去。該方法在酶蛋白分子上的功能基團和載體表面上的反應基團之間形成牢固的化學共價鍵結合,致使漆酶不易從載體上脫落并保持較高的穩定性。例如,采用特定的化學試劑活化廉價易得的硅膠、陶瓷、土壤和蒙脫石等載體用于固定Trametes versicolor漆酶已經取得了較好的固定化效果,且該類固定化漆酶具有良好的穩定性和重復利用性[42]。Xu等[47]研究指出,將酶固定在氨基修飾的介孔分子篩(SBA-15)上能夠保證其具有更好的化學穩定性和熱穩定效能,且該酶重復使用五次后,其活性仍可達到初始值的49.2%。然而需指出,共價綁定法的缺點是載體的活化和固定化操作比較復雜、反應比較劇烈,需要嚴格控制條件才能獲得活力較高的固定化漆酶[21]。
2.4 交聯結合法
交聯結合法的基本原理是利用雙功能或多功能試劑在酶分子間、酶分子與惰性蛋白或酶分子與載體間進行交聯反應,把酶蛋白分子彼此交叉連接起來形成交聯網絡結構。常用的交聯劑是戊二醛,該固定化方法常與吸附法和包埋法結合使用,不僅可以提高固定化漆酶的活性,也起到加固作用[48]。王穎等[49]研究表明,與游離態漆酶相比,以殼聚糖為載體通過交聯法固定漆酶,在pH 2.5-4.0范圍內其活性較為穩定,25℃保存10 d后酶活仍為初始酶活性的88.70%。杜東霞等[50]以海藻酸鈉為載體,戊二醇為交聯劑制備的固定化漆酶在pH 4.5、底物濃度40 mg/L和反應溫度65℃的水浴鍋中脫色降解3 h后,對染料剛果紅的脫色率高達92.6%,并且該酶可以重復使用。基于以上結果可知,與游離態漆酶相比,采用交聯結合法固定漆酶可以顯著地提高酶的適應能力、耐熱性和貯存穩定性等。
2.5 固定化漆酶的利弊
與游離態漆酶對比,固定化漆酶有很多優勢,如提高酶的活性、穩定性、溫度和pH適應性及循環再利用率等[7,51]。同時,固定化漆酶也可實現酶促反應的連續生產及嚴控酶反應過程、增加產物回收率、提高產物質量,適用于產業化、連續化和自動化生產[52]。與此同時,由于漆酶的分離和固定化處理等原因,其也具備一些弊端,如固定化過程中造成酶活性損失、可能改變漆酶的空間構象和分子結構、引起酶活性位點的變化等。表1總結了4種常見的漆酶固定化方法的優缺點。
3 真菌漆酶在環境中的應用
固定化酶是酶工程的核心,它有利于實現酶的重復再利用及產物與酶的再分離,使酶工程達到一個嶄新的應用水平。真菌漆酶因具備多功能特性和廣譜功效而備受關注。目前,漆酶已經在化學、生物學和生物工程等多個學科領域得到廣泛地應用,并取得了較好的經濟效益和實際價值(圖3)。例如,漆酶在環境有機污染物去除、合成染料脫色、造紙廢水、食品工業、生物監測和環境質量指示劑等綠色化學中皆有應用[15-20]。

表1 四種固定化方法的優缺點
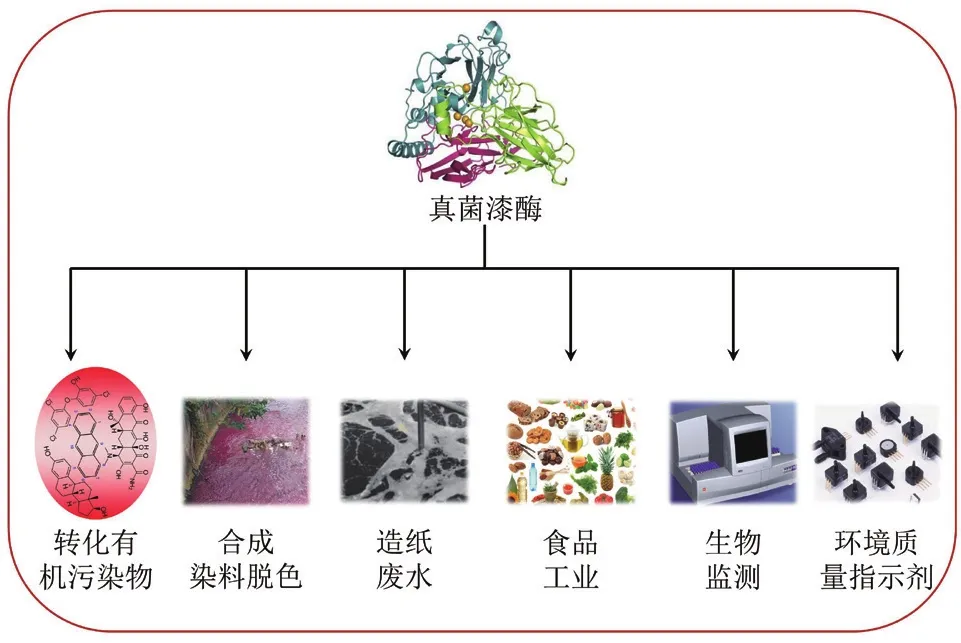
圖3 漆酶在綠色環境化學中的多功能應用
3.1 催化氧化有機污染物
環境中酚類污染物、多環芳烴(PAHs)、抗生素和藥物等污染備受國際關注。其在環境中長期穩定存在,對野生物種具有毒害作用,且難以通過化學和生物過程降解代謝[53-54]。漆酶能催化氧化多種難降解有機污染物(表2),其催化氧化能力與漆酶的氧化還原能力和底物的電勢能密切相關,電勢能較高的底物會阻礙漆酶的氧化還原能力[17,36,55]。漆酶介導酚類污染物的轉化主要通過氧化耦合反應形成多種復雜性聚合物[2];而針對非酚類惰性有機污染物,漆酶需要反應活性分子的參與共同完成底物的氧化降解過程。添加氧化還原介質可以極大的促進漆酶的活性及其對惰性有機污染物的催化氧化反應。研究表明[56],漆酶能夠通過聚合和氧化降解反應有效地摧毀雌激素類化合物的雌激素活性。另有研究指出[57],從菌株白腐真菌(Marasmius quercophilus)中分離出的不同亞類漆酶能夠有效地轉化PAHs中的蒽和苯并[a]芘,但對萘和菲無效果。PAHs的電離電位影響它們的酶促反應效能,該亞類漆酶僅能夠轉化電離電位小于7.55 eV的PAHs。
3.1.1 催化氧化水中有機污染物 研究指出[2,58],Pleurotus ostreatus漆酶能夠催化氧化雌二醇和三氯生,并通過自由基介導的C-C或C-O-C耦合反應形成二聚體、三聚體和四聚體等聚合產物。夏青等[59]研究表明,漆酶能夠有效地催化雙酚A、雌二醇、炔雌醇、雌銅和辛基酚等雌激素的轉化;當呈現天然有機質時,在反應初期可抑制該5種雌激素的去除效率,而反應后期無顯著性影響。陳輝等[60]研究證實,固定化漆酶能夠提高酶的穩定性和重復利用率,可用于連續降解2,4-二氯苯酚(2,4-DCP),在連續反應6 h后其對2,4-DCP的降解率仍然保持在60%以上。王穎等[49]研究指出,采用殼聚糖固定漆酶對2,4-DCP具有良好的吸附-催化氧化效能,且隨著反應時間的遞增,溶液中氯離子濃度逐漸增加。氣相色譜-質譜串聯技術分析結果表明,2,4-DCP的可溶性降解產物主要包括2-羥基丙二酸和3-羥基-順,順-黏糖酸。
3.1.2 催化氧化土壤中有機污染物 固定化漆酶在土壤中的應用主要表現在修復土壤污染。Singh等[61]研究表明,漆酶對土壤中17β-雌二醇的轉化具有較好的調控作用,反應5 h后土壤中17β-雌二醇的去除率高達98%以上,而漆酶的活性無顯著性變化。趙月春等[62]采用游離態漆酶處理土壤二氯二苯三氯乙烷(DDT)污染,DDT總降解率為50.53%,而在固定化反膠團漆酶處理中DDT總降解率高達69.17%,且固定化反膠團漆酶對DDT各組分的降解均高于游離態漆酶。另有研究[63-64]將Trametes orientalis漆酶加入老化的PAHs污染土壤,培養10 d后,該酶對蒽和苯并[a]芘的轉化率分別為52.7%和40.8%,添加ABTS可以提高其對PAHs的轉化效率。此外,采用可生物降解的高分子外消旋聚乳酸作為原料,結合乳液電紡技術將漆酶包埋固定在納米纖維中,也可以有效地去除土壤中菲、熒蒽、苯并[a]蒽和苯并[a]芘等 PAHs[65]。
3.2 合成染料的脫色反應
合成類染料已經廣泛地應用于染色工藝和印刷產業,其種類繁多、結構復雜且難降解,并具有生物毒性和致畸效應。每年大約有10%的合成染料經過不同的水通道進入環境中,它們可以改變水體的理化性質,對水生物種造成潛在的危害。研究指出[22],采用高效脫色生物酶進行合成染料的脫色處理,具有成本低、無二次污染和經濟有效等特點。真菌漆酶能夠有效地去除生色團化合物,如偶氮、三芳基甲烷、酸性紫、蒽醌和靛藍類染料等,實現對合成染料的脫色,且多數在10 min內即可達到80% 的脫色率[6-7,75-76]。例如,Trametes hirsute產生的漆酶不僅可以用于紡織染料的脫色和解毒,對靛藍類染料、偶氮和蒽醌染料也具有相同的效果[19]。趙林果等[77]研究發現,采用自制復合型載體丙烯酸酯類聚合物固定的漆酶在酶用量為12.5 U/mL、染料濃度為150 mg/L、反應溫度為45-55℃和pH 4.5-5.0的條件下脫色降解酸性紫43,反應4 h后染料酸性紫43的脫色率高達98.5%。另有研究指出[78],綠椰纖維對染料RB5的吸附脫色率為23%,固定化空白小球對染料RB5的吸附脫色率為11.95%,而采用固定化漆酶-介體系統對染料RB5的脫色率高達92.5%。由此可見,利用漆酶的固定化技術可以對合成染料進行有效脫色。
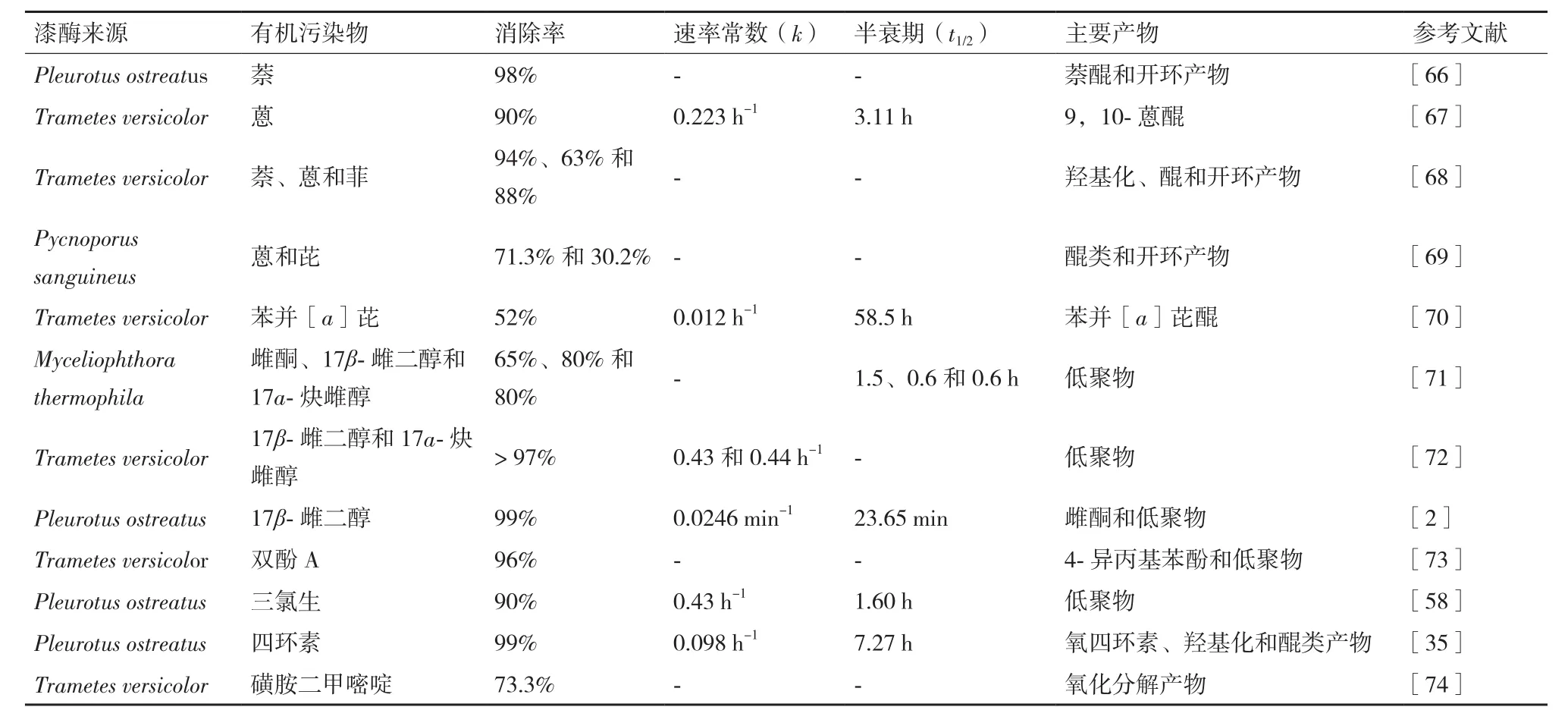
表2 真菌漆酶催化氧化有機污染物的轉化動力學及其主要產物分布
3.3 造紙工業中的應用
漆酶在造紙工業中的應用主要包括紙漿的生物漂白、木質素降解和造紙廢水處理等。與傳統的化學方法相比,通過漆酶參與的生物制漿工藝在降低能耗和節約設備的基礎上,進一步避免了傳統化學方法降解木質素時不夠徹底的問題。與此同時,用漆酶進行的生物制漿也避免了傳統的氯化物漂白產生廢水污染和漂白后紙張極易反彈等一系列的弊端現象,顯著地提高了紙張的質量和強度。
生物漂白技術是一種綠色環保型漂白方法,可提高紙漿的可漂性,減少化學藥品的使用量及其對環境的污染。付時雨等[79]研究了漆酶/介體系統漂白尾葉桉硫酸鹽漿,結果表明,Panus conchatus漆酶在介體N-羥基乙酰苯胺的存在下進行尾葉桉硫酸鹽漿的生物漂白,可使紙漿的卡伯值降低30%。在漆酶處理時添加表面活性劑可以增加木質素的溶出、提高紙漿的白度,并且保持漆酶的穩定性。漆酶在木質素的生物降解中起著重要的作用,對纖維素原料的解構也有很大的潛力[80]。Wang等[81]指出,不同漆酶電荷和處理時間下對木質素的去除體現在兩個階段:快速初始階段和緩慢的第二階段,并發現大多數木質素的降解發生在漆酶處理的前2 h內,其后木質素的降解率保持在一個較高的水平,直至5 h后木質素被徹底降解。在造紙廢水方面,劉娜娜[82]指出在序批式反應器(SBR)中投加200 mL以海藻酸鈉固定的Trametes versicolor漆酶,能夠有效地改善造紙廢水的水質質量,并增強SBR抵抗進水負荷的沖擊能力。劉帥等[83]研究也表明,采用最佳工藝條件(反應時間6 h、溫度50-55℃、pH 4.0)處理造紙廢水時,固定化漆酶對廢水中COD去除率為74%,色度去除率為77%。該固定化漆酶具備反應溫度耐受性強、pH適應性廣、處理效果好和反應周期短等特點。因此,固定化漆酶技術可以廣泛地應用于造紙工業。
3.4 在食品工業中的應用
漆酶在食品行業具有多方面的應用,可以用于調整食物或飲料的外觀顏色、提高葡萄酒的穩定性。在烘焙食品中,漆酶可增加面團的機械強度、穩定性并降低它的黏性,從而改善面團的機械加工性;漆酶在食品氣味控制和品質提高方面也有諸多應用[84]。此外,漆酶可以提高食品的生產效率和質量,且投資成本較低[85]。漆酶能降解白酒、啤酒和果汁中的酚類物質,保持食品的風味、減緩食品變色和變質的速度。很多漆酶底物,如碳水化合物、不飽和脂肪酸、酚類化合物及含疏基的蛋白質是各種食品和飲料的重要組成部分,應用漆酶可以改善食品品質、降低成本。Alberts等[86]指出,Pleurotus ostreatus漆酶能夠降解一種黃曲霉毒素AFB1,并且其漆酶活性比Trametes versicolor和Penicillium等真菌強。例如,利用來源于Frametes versicolor的漆酶處理低芥酸菜籽產品(通常作為飼料飼養畜禽),3 h內低芥酸菜籽中酚含量降低90%,其可能代替大豆蛋白用于食品和飼料的產生[88]。此外,漆酶添加在漱口水、牙膏、口香糖和薄荷糖等各種口腔用品中可以起到抑制口臭的作用[87]。
3.5 生物檢測
漆酶在催化氧化反應中消耗氧分子,該過程容易被轉化為電信號而得到高靈敏度檢測。目前,已經有多種漆酶在生物檢測中得到廣泛地應用[89]。例如,利用漆酶生物傳感器可以方便快速地檢測到廢水中的酚類、芳香胺類、有機磷化合物和二噁英等有毒物質[90-91]。
3.5.1 生物傳感器 生物傳感器是以固定化的生物成分(酶、蛋白質、DNA抗體、抗原和生物膜等)或生物本身(細胞、微生物和組織等)為敏感材料,與適當的化學轉換器相結合產生的一種快速檢測各種物理、化學和生物量的器件,其通過各種物理、化學換能器捕捉目標物與敏感物之間的反應,然后將反應的程度轉換成電信號,根據電信號推算出被測量的大小[92]。固定化漆酶使漆酶的活性、穩定性和環境適應能力較游離態漆酶均有所提高,其為生物傳感器的制備提供了良好的條件。漆酶傳感器是以固定化漆酶作為感受器,以基礎電極作為換能器的裝置。Liu等[93]將Trametes versicolor漆酶包埋在高分子聚合膠的原位電紡和納米金顆粒中,該生物傳感器在靈敏度線性范圍內能夠檢測氯酚,檢測順序依次為 2,4-DCP > 2,4,6-三氯酚 > 4-氯苯酚,檢測范圍0.04-12.10 μmol/L;30 d儲存期后,漆酶依舊保留較高的重復性和酶活力(> 60%)。運用纖維質的DEAE-纖維素固定漆酶,制成兩種類型的高活力和穩定性傳感器,用于檢測茶葉加工過程中兒茶酚的變化情況,每個酶單元可以作500次以上檢測,并在室溫下保存2個月。這種類型的傳感器也可以用來檢測來自煤炭、石油、天然氣和造紙等工業污水中的木質素和酚類物質等。
3.5.2 免疫檢測 在免疫檢測中,漆酶有望替代辣根過氧化物酶而成為新的標記酶,因為漆酶具有以下幾個優點:氧氣作為第二底物,不形成非產物型的酶-底物復合物;相比于過氧化物酶,漆酶對介質中不同價態的金屬離子濃度的敏感性較低;無需特殊的儀器和試劑。漆酶在生物檢測中的應用具有重要意義,使免疫檢測更靈敏、結果更準確,使生物傳感器測定的范圍更寬、操作更簡便,不僅可以用更低廉的費用分析更多的樣品,而且減少了有機溶劑的使用量,優于物理化學方法[94]。
3.6 環境質量指示器
如果采用未知污染物對環境進行定性和定量,必須測定多種屬性,共同評估環境質量和狀態,主要包括修復過程的實施和總結。通常選擇指示器的最小數據集,它們具有響應性、可承受性、可解釋性、國際接受性和生態意義等。研究指出[95-96],土壤酶能夠用于評估人類活動對土壤質量的影響和生態系統的擾動,而在絲狀真菌中表達的重組漆酶可應用于環境中酚類化合物的檢測。將漆酶吸附在碳上制成固定化酶電極能有效地催化負極氧化還原,間接地進行環境監測。這種方法的特點就是專一性強、速度快、可連續操作、手續簡便、測定結果直觀顯示并有數據記錄儲存,環境及人為因素對其影響較小,可精確測量濃度在2.0×10-5-7.0×10-4mol/L范圍內的多酚和多氨基苯等底物,適用于一些有特殊要求的區域環境監測,如海洋環境監測網絡、三峽庫區環境監測、環境應急響應監測和突發性環境事故的應急監測。
4 展望
綜上所述,真菌漆酶可以介導多種底物形成自由基中間體,并通過這些中間體的氧化、分解或耦合反應轉化底物。吸附、包埋、共價綁定和交鏈結合等固定化技術能夠增強漆酶在環境中的活性、穩定性和循環再利用能力。結合漆酶的多功能特征和固定化技術的優勢,固定化漆酶已經在諸多綠色環境化學中得到了廣泛地應用。例如,將漆酶嵌入生物傳感器中可提高其探測和多功能分析能力,并有效地評估污染環境中的分子類型、檢測污染物的濃度和去除效率。此外,納米技術、微電子和微流體技術的應用也使得漆酶生物傳感器對環境中化學物質的檢測更加快速、準確和可靠。
然而需指出,我國關于固定化漆酶在綠色環境化學中的應用仍處于初級階段。能否建立一整套漆酶與環境之間的理想模型體系,通過分析環境中漆酶的活性和污染物之間的關系,評估污染物對環境質量和健康指標的影響?該理論模型值得深入發掘。另一方面,如何拓展和探究漆酶在綠色環境化學中新的應用途徑和技術手段也是研究者今后亟待解決的難點問題。鑒于此,我國學者今后研究的重點仍需從以下幾個方面著手:(1)分離篩選高產漆酶真菌,推動漆酶的大規模生產和工業化應用;(2)優選高效、穩定的固定化漆酶載體,通過修飾和改性載體提高其固定化效能;(3)將固定化漆酶與環境處理工藝相結合,拓展漆酶在環境污染治理中的應用;(4)采用基因工程對產漆酶真菌進行異源表達,改善漆酶的理化性質,挖掘其在綠色環境化學工藝領域中新的應用前景和價值。
[1] 丁惠君, 吳亦瀟, 鐘家有, 等. 兩種介體物質在漆酶降解磺胺類抗生素中的作用[J]. 中國環境科學, 2016, 36(5):1469-1475.
[2] Sun K, Luo Q, Gao Y, et al. Laccase-catalyzed reactions of 17βestradiol in the presence of humic acid:Resolved by high-resolution mass spectrometry in combination with13C labeling[J]. Chemosphere, 2016, 145:394-401.
[3] 張延威, 邱樹毅, 韓燕峰, 等. 產漆酶菌株篩選及一株產酶菌株的優化與鑒定[J]. 微生物學通報, 2014, 41(2):251-257.
[4] Dhakar K, Anita P. Phialophora melinii(NFCCI 3617):A newly isolated psychrotolerant fungus that produces enhanced laccase under the influence of organic solvents[J]. Advances in Natural Science, 2015, 8(1):14-20.
[5] Rekadwad B, Khobragade C. Fungi imperfecti laccase:Biotechnological potential and perspectives[M/OL]//Microbial Applications Vol. 2. Springer International Publishing, 2017:203-212.
[6] 劉家揚, 焦國寶, 有小娟, 等. 真菌漆酶的性質, 生產及應用研究進展[J]. 生物技術通報, 2016, 32(4):24-33.
[7] Fernández-Fernández M, Sanromán Má, Moldes D. Recent developments and applications of immobilized laccase[J].Biotechnol Adv, 2013, 31(8):1808-1825.
[8] Piontek K, Antorini M, Choinowski T. Crystal structure of a laccase from the fungusTrametes versicolorat 1. 90-? resolution containing a full complement of coppers[J]. Journal of Biological Chemistry,2002, 277(40):37663-37669.
[9] Park JW, Dec J, Kim JE, et al. Effect of humic constituents on the transformation of chlorinated phenols and anilines in the presence of oxidoreductive enzymes or birnessite[J]. Environmental Science& Technology, 1999, 33(12):2028-2034.
[10] 劉歡, 袁興中, 彭馨, 等. 反膠束體系中漆酶催化愈創木酚的研究[J]. 中國環境科學, 2015, 35(2):493-498.
[11] 羅爽, 謝天, 劉忠川, 等. 漆酶/介體系統研究進展[J]. 應用與環境生物學報, 2015, 21(6):987-995.
[12] Miyazawa N, Tanaka M, Hakamada M, et al. Molecular dynamics study of laccase immobilized on self-assembled monolayer-modified Au[J]. Journal of Materials Science, 2017, 52(21):12848-12853.
[13] 馬雙新, 劉寧, 賈慧, 等. 玉米大斑病菌漆酶基因Stlac2結構分析及原核表達[J]. 中國農業科學, 2016, 49(21):4130-4139.
[14] Mate DM, Alcalde M. Laccase engineering:From rational design to directed evolution[J]. Biotechnol Adv, 2015, 33(1):25-40.
[15] Couto SR, Herrera JLT. Industrial and biotechnological applications of laccases:A review[J]. Biotechnol Adv, 2006, 24(5):500-513.
[16] Zheng F, An Q, Meng G, et al. A novel laccase from white rot fungusTrametes orientalis:Purification, characterization, and application[J]. Int J Biol Macromol, 2017, 102:758-770.
[17] 李陽, 蔣國翔, 牛軍峰, 等. 漆酶催化氧化水中有機污染物[J].化學進展, 2009, 21(10):2028-2036.
[18] Polak J, Jarosz-Wilkolazka A. Fungal laccases as green catalysts for dye synthesis[J]. Process Biochemistry, 2012, 47(9):1295-1307.
[19] Subramanian J, Ramesh T, Kalaiselvam M. Fungal laccasesproperties and applications:A review[J]. Int J Pharm Biol Arch, 2014, 5(2):8-16.
[20] Yang J, Ng TB, Lin J, et al. A novel laccase from basidiomyceteCerrenasp. :Cloning, heterologous expression, and characterization[J]. Int J Biol Macromol, 2015, 77:344-349.
[21] 羅開昆, 彭紅, 龔躍法. 漆酶的固定化及其在廢水處理中的應用[J]. 工業水處理 , 2005, 25(5):14-17.
[22] 司靜, 李偉, 崔寶凱, 等. 真菌漆酶性質, 分子生物學及其應用研究進展[J]. 生物技術通報, 2011(2):48-55.
[23] Giardina P, Faraco V, Pezzella C, et al. Laccases:A never-ending story[J]. Cellular and Molecular Life Sciences, 2010, 67(3):369-385.
[24] 葛宏華, 武赟, 肖亞中. 漆酶空間結構, 反應機理及應用[J].生物工程學報, 2011, 27(2):156-163.
[25] Baldrian P. Fungal laccases-occurrence and properties[J].FEMS Microbiol Rev, 2006, 30(2):215-242.
[26] Riva S. Laccases:Blue enzymes for green chemistry[J]. Trends in Biotechnology, 2006, 24(5):219-226.
[27] 王國棟, 陳曉亞. 漆酶的性質, 功能, 催化機理和應用[J].植物學通報, 2003, 20(4):469-475.
[28] Mayer AM, Staples RC. Laccase:New functions for an old enzyme[J]. Phytochemistry, 2002, 60(6):551-565.
[29] 高玉千, 張利明, 張世敏, 等. 真菌漆酶高級結構研究進展[J].食品與生物技術學報, 2011, 30(2):166-171.
[30] Palmer AE, Lee SK, Solomon EI. Decay of the peroxide intermediate in laccase:Reductive cleavage of the O-O bond[J]. Journal of the American Chemical Society, 2001, 123(27):6591-6599.
[31] Garavaglia S, Cambria MT, Miglio M, et al. The structure ofRigidoporus lignosuslaccase containing a full complement of copper ions, reveals an asymmetrical arrangement for the T3 copper pair[J]. Journal of Molecular Biology, 2004, 342(5):1519-1531.
[32] Su J, Fu J, Wang Q, et al. Laccase:a green catalyst for the biosynthesis of poly-phenols[J]. Critical Reviews in Biotechnology,2018, 38(2):294-307.
[33] Christopher LP, Yao B, Ji Y. Lignin biodegradation with laccasemediator systems[J]. Frontiers in Energy Research, 2014, 2 :12.
[34] Peng X, Yuan X, Liu H, et al. Degradation of polycyclic aromatic hydrocarbons(PAHs)by laccase in rhamnolipid reversed micellar system[J]. Applied Biochemistry and Biotechnology,2015, 176(1):45-55.
[35] Sun K, Huang Q, Li S. Transformation and toxicity evaluation of tetracycline in humic acid solution by laccase coupled with 1-hydroxybenzotriazole[J]. Journal of Hazardous Materials,2017, 331:182-188.
[36] 賴超鳳, 李爽, 彭麗麗, 等. 漆酶及其在有機合成中應用的研究進展[J]. 化工進展, 2010(7):1300-1308.
[37] 靳蓉, 張飛龍. 漆酶的結構與催化反應機理[J]. 中國生漆,2012, 31(4):6-16.
[38] Dodor DE, Hwang HM, Ekunwe SIN. Oxidation of anthracene and benzo[a]pyrene by immobilized laccase fromTrametes versicolor[J]. Enzyme and Microbial Technology, 2004, 35(2):210-217.
[39] Han MJ, Choi HT, Song HG. Degradation of phenanthrene byTrametes versicolorand its laccase[J]. The Journal of Microbiology, 2004, 42(2):94-98.
[40] 鄧寒梅, 邵可, 梁家豪, 等. 漆酶的來源及固定化漆酶載體研究進展[J]. 生物技術通報, 2017, 33(6):10-15.
[41] 王新, 劉麗, 陸佳靚, 等. 固定化漆酶載體研究進展[J]. 生態學雜志, 2013(10):2823-2829.
[42] 潘洪艷, 張安龍, 張佳. 漆酶的固定化及其在造紙廢水處理中的應用[J]. 黑龍江造紙, 2011, 39(1):43-45.
[43] 游金坤, 余旭亞, 趙鵬. 吸附法固定化酶的研究進展[J]. 化學工程, 2012(4):1-5.
[44] 王美銀, 張新穎, 湯真平. 固定化漆酶處理染料廢水的研究進展[J]. 能源與環境 , 2017(3):85-86.
[45] 喬德亮, 胡冰, 曾曉雄. 酶固定化及其在食品工業中應用新進展[J]. 食品工業科技, 2008(1):304-308.
[46] 代云容, 袁鈺, 于彩虹, 等. 靜電紡絲纖維膜固定化漆酶對水中雙酚A的降解性能[J]. 環境科學學報, 2015, 35(7):2107-2113.
[47] Xu Y, Zhou G, Wu C, et al. Improving adsorption and activation of the lipase immobilized in amino-functionalized ordered mesoporous SBA-15[J]. Solid State Sciences, 2011, 13(5):867-874.
[48] Tan Y, Deng W, Ge B, et al. Biofuel cell and phenolic biosensor based on acid-resistant laccase-glutaraldehyde functionalized chitosan-multiwalled carbon nanotubes nanocomposite film[J].Biosensors and Bioelectronics, 2009, 24(7):2225-2231.
[49] 王穎, 張笛, 茹加, 等. 殼聚糖固定化漆酶酶學性質及其催化氧化水中2, 4-二氯酚的效能與途徑[J]. 環境化學, 2013, 32(10):1901-1908.
[50] 杜東霞, 王宜磊. 固定化漆酶對剛果紅染料脫色降解的研究[J]. 安徽農業科學, 2013, 41(11):4985-4987.
[51] 羅貴民. 酶工程[M]. 北京:化學工業出版社, 2003:251-253.
[52] 陳冬梅. 固定化酶及其在食品工業中的應用[J]. 現代農業科技, 2010(19):330-332.
[53] 傅婉秋, 謝星光, 戴傳超, 等. 植物-微生物聯合對環境有機污染物降解的研究進展[J]. 微生物學通報, 2017, 44(4):929-939.
[54] 馮秋園, 吳桐, 萬祎, 等. 持久性有機污染物(POPs)在水生生態系統中的環境行為[J]. 北京大學學報:自然科學版,2017, 53(3):588-596.
[55] Dai Y, Yin L, Niu J. Laccase-carrying electrospun fibrous membranes for adsorption and degradation of PAHs in shoal soils[J]. Environmental Science & Technology, 2011, 45(24):10611-10618.
[56] Kudanga T, Nyanhongo GS, Guebitz GM, et al. Potential applications of laccase-mediated coupling and grafting reactions:A review[J]. Enzyme and Microbial Technology, 2011, 48(3):195-208.
[57] Farnet AM, Gil G, Ferre E. Effects of pollutants on laccase activities ofMarasmius quercophilus, a white-rot fungus isolated from a Mediterranean schlerophyllous litter[J]. Chemosphere,2008, 70(5):895-900.
[58] 孫凱, 李舜堯. 漆酶催化氧化水溶液中三氯生轉化的作用機理[J]. 中國環境科學, 2017, 37(8):2947-2954.
[59] 夏青, 謝衛平, 劉國強, 等. 漆酶催化氧化水中雌激素的研究[J]. 環境科學 , 2013, 34(8):3119-3124.
[60] 陳輝, 張劍波, 劉小鵬, 等. 漆酶催化降解氯酚類有機污染物[J]. 北京大學學報:自然科學版, 2005, 41(4):605-611.
[61] Singh R, Cabrera ML, Radcliffe DE, et al. Laccase mediated transformation of 17β-estradiol in soil[J]. Environmental Pollution, 2015, 197:28-35.
[62] 趙月春, 付蓉, 莫測輝, 易筱筠. 固定化反膠團漆酶及其在修復土壤DDT污染中的應用[J]. 生態環境, 2008(2):606-610.
[63] Li X, Lin X, Yin R, et al. Optimization of laccase-mediated benzo[a]pyrene oxidation and the bioremedial application in aged polycyclic aromatic hydrocarbons-contaminated soil[J].Journal of Health Science, 2010, 56(5):534-540.
[64] 林先貴, 吳宇澄, 曾軍, 等. 多環芳烴的真菌漆酶轉化及污染土壤修復技術[J]. 微生物學通報, 2017, 44(7):1720-1727.
[65] 葛世杰. 固定化阿特拉津降解酶制備及其土壤修復效果研究[D]. 哈爾濱:東北農業大學, 2013.
[66] Sukor MZ, Yin CY, Savory RM, et al. Biodegradation kinetics of naphthalene in soil medium usingPleurotus ostreatusin batch mode with addition of fibrous biomass as a nutrient[J]. Bioremediation Journal, 2012, 16(3):177-184.
[67] 任大軍, 許琴, 張元元, 等. 漆酶/ABTS介體系統對蒽的降解研究[J]. 工業安全與環保, 2013(12):1-3.
[68] Bautista LF, Morales G, Sanz R. Biodegradation of polycyclic aromatic hydrocarbons(PAHs)by laccase fromTrametes versicolorcovalently immobilized on amino-functionalized SBA-15[J]. Chemosphere, 2015, 136:273-280.
[69] Li X, Wang Y, Wu S,et al. Peculiarities of metabolism of anthracene and pyrene by laccase-producing fungusPycnoporus sanguineusH1[J]. Biotechnology and Applied Biochemistry,2014, 61(5):549-554.
[70] Hu X, Zhang Y, Zhao X,et al. Biodegradation of benzo[a]pyrene with immobilized laccase:Genotoxicity of the products in HaCat and A3 cells[J]. Environmental and Molecular Mutagenesis,2007, 48(2):106-113.
[71] Lloret L, Hollmann F, Eibes G,et al. Immobilisation of laccase on Eupergit supports and its application for the removal of endocrine disrupting chemicals in a packed-bed reactor[J].Biodegradation, 2012, 23(3):373-386.
[72]Blánquez P, Guieysse B. Continuous biodegradation of 17β-estradiol and 17α-ethynylestradiol byTrametes versicolor[J]. Journal of Hazardous Materials, 2008, 150(2):459-462.
[73] Arca-Ramos A, Eibes G, Feijoo G,et al. Potentiality of a ceramic membrane reactor for the laccase-catalyzed removal of bisphenol A from secondary effluents[J]. Appl Microbiol Biotechnol, 2015,99(21):9299-9308.
[74] Liang S, Luo Q, Huang Q. Degradation of sulfadimethoxine catalyzed by laccase with soybean meal extract as natural mediator:Mechanism and reaction pathway[J]. Chemosphere,2017, 181:320-327.
[75] Peralta-Zamora P, Pereira CM, Tiburtius ERL, et al. Decolorization of reactive dyes by immobilized laccase[J]. Applied Catalysis B:Environmental, 2003, 42(2):131-144.
[76] 袁海生, 戴玉成, 曹云, 等. 白腐真菌染料脫色菌株的篩選及一色齒毛菌脫色條件的研究[J]. 菌物學報, 2010(3):429-436.
[77] 趙林果, 季永新, 李強, 等. 固定化漆酶對染料酸性紫43的脫色和降解[J]. 工業微生物, 2007, 37(6):35-40.
[78] Manu B, Chaudhari S. Anaerobic decolorisation of simulated textile wastewater containing azo dyes[J]. Bioresource Technology,2002, 82(3):225-231.
[79] 付時雨, 詹懷宇. 漆酶/介體系統漂白尾葉桉硫酸鹽漿的初步研究[J]. 中國造紙 , 2000(2):8-12.
[80] Rich JO, Anderson AM, Berhow MA. Laccase-mediator catalyzed conversion of model lignin compounds[J]. Biocatalysis and Agricultural Biotechnology, 2016, 5:111-115.
[81] Wang Q, Liu S, Yang G, et al. Modeling laccase-induced lignin removal in prehydrolysis liquor from kraft-based dissolving pulp production[J]. Bioresource Technology, 2015, 175:638-641.
[82] 劉娜娜. 固定化漆酶在SBR處理造紙廢水中的應用[J]. 天津造紙, 2015, 37(2):7-10.
[83] 劉帥, 張安龍, 羅清. 固定漆酶與游離漆酶對造紙廢水深度處理的研究[J]. 紙和造紙, 2012, 31(3):63-65.
[84] 張昱, 趙倩, 李冠華. 漆酶在食品領域的應用研究進展[J].食品工業科技, 2016, 17:77.
[85] Minussi RC, Pastore GM, Durán N. Potential applications of laccase in the food industry[J]. Trends in Food Science & Technology,2002, 13(6):205-216.
[86] Alberts JF, Gelderblom WCA, Botha A, et al. Degradation of aflatoxin B 1 by fungal laccase enzymes[J]. International Journal of Food Microbiology, 2009, 135(1):47-52.
[87] Brinch DS, Pedersen PB. Toxicological studies on laccase fromMyceliophthora thermophilaexpressed inAspergillus oryzae[J].Regulatory Toxicology and Pharmacology, 2002, 35(3):296-307.
[88] 王歲樓, 王瓊波. 漆酶在食品工業中的應用及其產生菌的研究[J]. 食品科學 , 2005(2):260-263.
[89] 劉佳, 殷立峰, 代云容, 等. 電化學酶傳感器在環境污染監測中的應用[J]. 化學進展, 2011, 24(01):131-143.
[90] García-Arellano H, Fink D, Hernández GM, et al. Nuclear trackbased biosensors with the enzyme laccase[J]. Applied Surface Science, 2014, 310:66-76.
[91] Casero E, Petit-Domínguez MD, Vázquez L, et al. Laccase biosensors based on different enzyme immobilization strategies for phenolic compounds determination[J]. Talanta, 2013, 115 :401-408.
[92] 陳玲. 生物傳感器的研究進展綜述[J]. . 傳感器與微系統,2006, 25(9):4-7.
[93] Liu J, Niu J, Yin L, et al. In situ encapsulation of laccase in nanofibers by electrospinning for development of enzyme biosensors for chlorophenol monitoring[J]. Analyst, 2011, 136(22):4802-4808.
[94] 曹治云, 鄭騰, 謝必峰, 等. 漆酶在生物檢測中的應用進展[J].傳感器技術, 2004, 23(8):1-3.
[95] Riffaldi R, Levi-Minzi R, Cardelli R, et al. Soil biological activities in monitoring the bioremediation of diesel oil-contaminated soil[J]. Water, Air, & Soil Pollution, 2006, 170(1):3-15.
[96] 寧娜, 譚慧軍, 孫新新, 等. 真核生物來源漆酶的異源表達研究進展[J]. 生物工程學報, 2017, 33(4):565-577.

