馬鈴薯晚疫病菌原生質體制備及再生體系的研究
王偉偉 肖燕 張藝夕 劉晶 唐唯 李燦輝
(1. 云南師范大學生命科學學院,昆明 650500;2. 云南師范大學馬鈴薯科學研究院,昆明 650500)
馬鈴薯(Solanum tuberosumL.)屬茄科一年生草本植物,原產地南美洲安第斯山區,是世界第三大糧食作物[1]。我國是世界上馬鈴薯主要生產國家之一,馬鈴薯也是我國第四大糧食作物。由致病疫霉引起的馬鈴薯晚疫病是一種毀滅性病害,已超過稻瘟病和小麥銹病,被視為國際第一大作物病害[2]。
致病疫霉(Phytophthora infestans)是半活體營養型卵菌,菌絲無色、無隔、多核,生活史包含有性生殖和無性生殖兩個過程,其無性生殖是田間侵染植物的主要方式。馬鈴薯晚疫病菌為二倍體,基因組大小約240 Mb,其中包含上千個與致病性相關的效應因子與毒性因子。
為進一步明確晚疫病菌的致病機理,需要建立高效的馬鈴薯晚疫病菌的遺傳轉化體系。早在1991年,Judelson等[3]參考植物葉肉細胞的轉化體系,首次在致病疫霉中建立了用聚乙二醇/氯化鈣(PEG/CaCl2)介導的原生質體轉化技術,目前PEG介導的原生質體轉化體系在其他卵菌中也獲得成功,其中包括大豆疫霉[4](Phytophthora sojae)、同絲水霉[5](Saprolegnia monoica)、棕櫚疫霉[6](Phytophthora palmivora)、煙草疫 霉[7](Phytophthora nicotianae)、蔥 疫 霉[8](Phytophthora porri) 以 及 橡 樹 疫 霉[9](Phytophthora ramorum)等。
影響原生質體制備的條件有很多,如酶的種類、酶的濃度、酶解時間和酶解溫度等。由于不同微生物細胞壁的組成成分不同,所以不同物種要選擇合適的酶進行酶解。Weiland[10]等使用纖維素酶(Cellulase)和葡聚糖酶(Dextranase)對坪草枯萎病腐霉進行酶解;陳孝仁[11]等使用崩潰酶(Driselase)和裂解酶(Lysing enzyme)對大豆疫霉菌進行酶解;付麗[12]等使用裂解酶(Lysing enzyme)和纖維素酶對辣椒疫霉進行裂解;劉士旺[13]等使用溶壁酶(Glucancx)、纖維素酶、破壁酶(Lywallzymc)和蝸牛酶(Snail enzyme)對綠色木霉進行酶解,其中Glucancx的裂解效果要比其他單一酶及其組合酶的效果好,可能是由于P. infestans的細胞壁含有纖維素和β-1,3-葡聚糖多聚物。本研究選用Driselase和Cellulase R-10兩種酶,分別在不同酶濃度、酶作用時間及不同菌齡條件下進行原生質體制備和再生的研究,旨在建立高效的馬鈴薯晚疫病菌原生質體制備和再生體系。
1 材料與方法
1.1 材料
1.1.1 供試菌株 致病疫霉(Phytophthora infestans)菌株110P于2017年分離自云南省昆明市尋甸縣,由云南師范大學馬鈴薯科學研究院保存。
1.1.2 培養基 致病疫霉生長培養基[14]:PDA培養基:將土豆去皮并切成小塊,稱200 g,加入500 mL水,煮20 min后過濾,取濾液,在濾液中加入15 g葡萄糖,用蒸餾水定容至1 L,用1%氫氧化鈉或鹽酸將PH調至6.8-7.2,加入15 g瓊脂粉,攪拌均勻,121℃滅菌20 min。黑麥V8液體培養基:60 g黑麥用蒸餾水浸泡36 h,煮沸1 h,4層紗布過濾后加V8蔬菜汁100 mL,蔗糖20 g,1 g CaCO3,攪拌均勻,用蒸餾水定容至1 L,調PH至7.0,121℃滅菌20 min。原生質體再生培養基[15]:黑麥V8固體培養基,在1 L黑麥V8液體培養基中加入15 g瓊脂,91.1 g甘露醇,調PH至7.0,121℃滅菌20 min。
1.1.3 原生質體洗液[16]滲透壓調節劑Ⅰ:0.35 mol/L氯化鈣,主要用于原生質體的制備。滲透壓穩定劑Ⅱ:0.1 mol/L氯化鈣,0.4 mol/L甘露醇,主要被用于沖洗酶液和稀釋原生質體。分別將這兩種滲透調節物質調節PH至6.2,并于121℃滅菌20 min。
1.1.4 細胞壁裂解酶 Driselase(Lot.No.1220E021)、Cellulase R-10(Lot.No.926E023)均購于 Solarbio 公司。裂解酶液用滲透壓調節劑Ⅰ配制,兩種酶分別配成終濃度為5 mg/mL、10 mg/mL和15 mg/mL,混勻后1 000 r/min離心2 min取上清,經0.22 μm的微孔濾膜除菌,現用現配。
1.2 方法
1.2.1 原生質體的制備 供試菌株置于PDA培養基上,18℃黑暗培養10-18 d,沿菌落邊緣切5 mm×5 mm的菌絲塊,挑10塊置于裝有100 mL的黑麥V8液體培養基的錐形瓶中,于18℃、120 r/min黑暗搖培8 d,400目篩子過濾收集菌絲體,用滅菌的無菌水沖洗3次后用全自動樣品快速研磨儀(Fstgrd-24,上海凈信科技)于30 Hz頻率下研磨90 s,再用400目的篩子過濾,收集的菌絲體用滅菌蒸餾水沖洗3次,滲透壓調節劑Ⅰ沖洗兩次,用滅菌濾紙吸干,稱重;將菌絲移至50 mL錐形瓶中,加入細胞壁裂解酶液5-15 mL,于26℃、100 r/min條件下裂解細胞壁。消化后的細胞懸浮液經400目篩子過濾,同時用滲透壓穩定劑Ⅱ洗滌沉淀3次,最后用滲透壓穩定劑Ⅱ重懸沉淀,均勻混合,即可得到原生質體。以上步驟均在無菌條件下操作。制備好的原生質體在光學顯微鏡下計數[11]。
1.2.2 原生質體的再生 在滅菌的超凈工作臺上,分別取50、100、150 μL原生質體懸浮液涂布于再生培養基上,18℃黑暗培養5 d,計數小菌落,按照下列公式計算原生質體再生率。實驗重復2次。
再生率=(再生培養基上生長的菌落數/涂布原生質體總數)×100%。
2 結果
2.1 原生質體的制備
2.1.1 馬鈴薯晚疫病菌無性孢子和原生質體的形態 在普通的光學顯微鏡下就可以觀察無性孢子(圖1-A)和原生質體(圖1-B)的區別,可以清晰的觀察到檸檬型的無性孢子、部分未被酶解呈絲狀的菌絲體和呈圓形的原生質體。在原生質體制備的過程中發現,有些菌絲體已經形成斷片,可以看到正在形成原生質體的菌絲體末端膨脹變大,釋放出呈圓球狀的原生質體;也可以觀察到有一些菌絲體不是從兩端釋放,而是從中間釋放出原生質體(圖2)。
2.2 原生質體制備條件的優化
裂解酶的確定。在酶濃度10 mg/mL、反應溫度在26℃條件下,Driselase、Cellulase R-10對致病疫霉細胞壁的裂解效果都達到了較高水平,其中Driselase在60 min時原生質體的產量達到9.0×104個/g,Cellulase R-10在45 min時原生質體的產量達到 8.5×104個 /g。

圖1 致病疫霉無性孢子與原生質體的區別
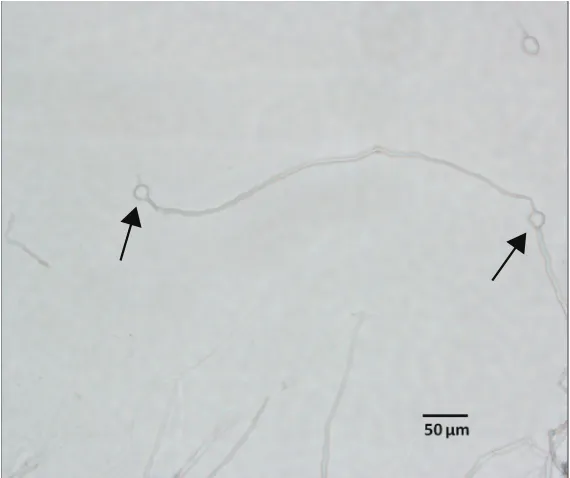
圖2 致病疫霉原生質體的形成方式
2.2.2 裂解酶濃度和反應時間的確定 用Driselase、Cellulase R-10分別裂解致病疫霉菌絲的細胞壁,制備的原生質體的數量隨著酶液濃度的增加而有明顯變化,10 mg/mL時產生的原生質體數量最多,15 mg/mL時產生的原生質體數量反而有所下降。因此進行大量原生質體制備時,酶濃度以10 mg/mL最為高效、經濟和適用。
從酶處理15 min開始,隨著處理時間的延長,原生質體產量也逐漸增加,Driselase在60 min時,原生質體產量最大,達到9×104個/g;而Cellulase R-10在45 min時,原生質體產量最大,達到8.5×104個/g;60 min后,隨著酶解時間的延長,原生質體產量呈下降趨勢(圖3、4)。因此,根據上述結果,致病疫霉原生質體制備最佳條件為Driselase以10 mg/mL的濃度裂解60 min。
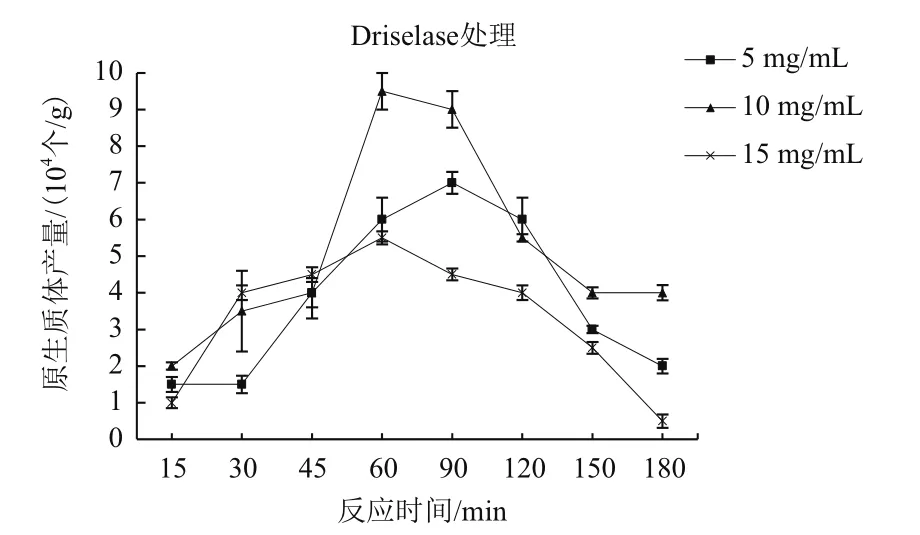
圖3 Driselase酶不同濃度和處理時間對原生質體的影響
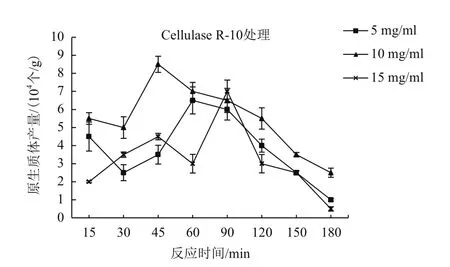
圖4 Cellulase R-10酶不同濃度和處理時間對原生質體的影響
2.2.3 菌齡對馬鈴薯晚疫病菌原生質體制備的影響 在最佳原生質體制備條件下,使用10 mg/mL Cellulase R-10和分別生長18 d、14 d、10 d的110P菌絲體進行原生質體的制備。結果顯示,3個菌齡的110P菌絲體中,生長18 d的菌絲體原生質體制備總量最高,為7×104個/g。各菌齡條件下原生質體制備量,見表1。
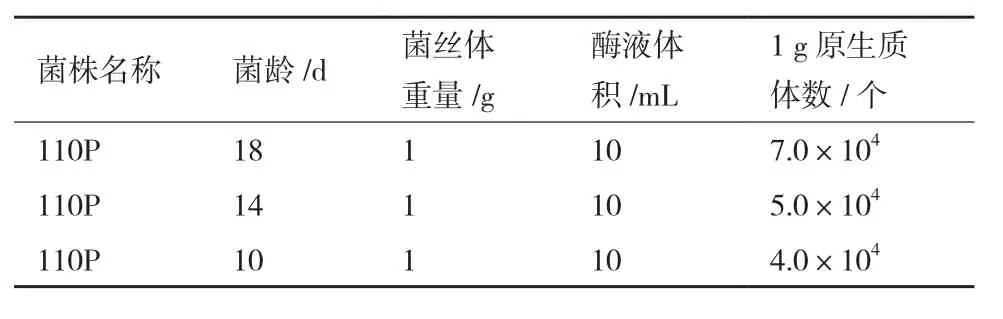
表1 原生質體制備量
2.3 原生質體的再生
致病疫霉110P用10 mg/mL的Driselase和Cellulase R-10處理60 min后,分別取 50 μL、100 μL、150 μL原生質體懸浮液涂布于再生培養基上,菌落在培養4-5 d時開始大量形成,對平板菌落計數后,原生質體再生率最高達3.1%。實驗重復2次。原生質體的再生率,見表2。

表2 原生質體的再生率
3 討論
探究馬鈴薯晚疫病菌原生質體制備和再生的適宜條件,菌齡、脫壁酶的選擇、酶解時間、酶濃度和滲透壓穩定劑等都會對原生質體的形成率和再生率產生不同影響。本實驗以培養18 d的菌絲體為材料,用10 mg/mL Driselase處理1 g菌絲60 min后,原生質體產量達8.5×104個/g;以0.1 mol/L氯化鈣和0.4 mol/L甘露醇作為滲透壓穩定劑,以黑麥V8固體再生培養基得到的原生質體再生率最高達3.1%。
由于不同種疫霉菌的細胞壁成分和結構不同,所以選擇合適的脫壁酶對原生質體的產量有很大的影響[17]。Weiland 等[10]使用 Cellulase和 Dextranase坪草腐霉進行酶解發現混合酶液的原生質體產量較高;陳孝仁等[11]使用Driselase和Lysing enzyme兩種酶對大豆疫霉菌進行酶解發現,在崩潰酶中加入裂解酶后原生質體產量明顯增多。卵菌的細胞壁主要有纖維素和β-1,3-葡聚糖多聚物組成,因此本研究參考選用了Driselase和 Cellulase R-10兩種細胞壁裂解酶。Driselase是一種復合酶,內含昆布多糖酶(Laminarinase)、木聚糖酶(Xylanase)和纖維素酶(Cellulase)[18],而 Cellulase R-10是一種單一的纖維素酶,一般來說,混合酶液比單一酶液的脫壁效果好,但Driselase是一種復合酶且含有纖維素酶,本研究用兩種酶分別探索對P. infestans的裂解效果,結果發現兩種酶制備效率差異不顯著(P>0.05),但Cellulase R-10價格便宜,在大量制備要求下較為經濟適用。
探索最佳酶解時間,是獲得最佳原生質體制備方法的重要數據之一。同時,還應該注意裂解作用的最適溫度,若溫度不當,可能會導致原生質體被破壞。在原生質體的制備過程中,酶濃度宜適中,酶濃度太大易使菌體凝集,不易形成原生質體,酶濃度太小使酶解不徹底。酶解時間也是影響原生質體制備的重要因素,如陳孝仁[11]等在制備大豆疫霉原生質體時,酶解時間在3 h時,原生質體的產量較高;黃玉茜[19]在制備綠色木霉時,酶解時間在24 h時,原生質體的產量較好。根據前人文獻報道發現原生質體的產量是隨著酶解時間的增加而增大,當達到最高量時,隨著酶解時間進一步延長,原生質體的產量逐漸降低,整個過程呈鐘型曲線趨勢,達到最高點原生質體產量下降的主要原因是因為酶活隨著作用時間增加而降低,或原生質體數目不斷增加,在酶解體系中會變得不穩定[20]。本研究所得致病疫霉菌絲酶解作用的最佳時間為Driselase 1 h,Cellulase R-10僅45 min,比已有文獻報道時間的疫霉屬卵菌裂解時間都短,因此,利用本優化條件,在制備原生質體的過程中效率更高。
菌齡不同的細胞,其細胞壁的薄厚程度以及結構差異較大,是影響原生質體制備影響的關鍵因素之一。菌齡短的菌絲體細胞壁成分相對簡單,細胞壁也相對薄,容易裂解,但并不是菌齡越短,原生質體的生成率越高。菌齡過短會造成菌絲量不足或影響原生質體的再生[21]。不同種類的卵菌酶解時的最佳菌齡是不一樣的,Yi等[16]的研究報道辣椒疫霉的菌齡在5 d時原生質體的生成率較高;Judelson等[4]的研究發現大豆疫霉的菌齡在11 d時原生質體的生成率較高。本研究探索的最佳菌齡為18 d,一個主要原因就是在最適培養基和最適溫度條件下,致病疫霉110P菌絲生長速率為6.4-7.5 mm/d(本研究測得),大豆疫霉菌絲生長速率為7-9 mm/d[22],辣椒疫霉為3-4 mm/d[23],致病疫霉的營養菌絲生長速率較低。
在原生質體的再生過程中,滲透壓穩定劑是原生質體釋放后維持活力的重要因素,對原生質體再生率影響顯著。卵菌的細胞壁成分是纖維素和葡聚糖,根據Yi等[16]的研究,用0.1 mol/L氯化鈣和0.4 mol/L甘露醇作為滲透壓穩定劑時,辣椒疫霉的原生質體再生率接近6%;董磊[20]用1 mol/L的氯化鎂、0.8 mol/L甘露醇作為滲透壓穩定劑時,致病疫霉的原生質體再生率較高,但低于Yi等[16]研究的辣椒疫霉的原生質體再生率;本研究選用0.1 mol/L氯化鈣和0.4 mol/L甘露醇作為滲透壓穩定劑,原生質體再生率最高達3.1%。
研究并建立卵菌高效遺傳轉化系統,原生質體制備和再生是必不可少的重要方法之一。以原生質體為核心的多種操作技術研究已經建立,包括原生質體的制備、再生、誘變、融合等方面,在基礎理論研究和實際生產應用中,這些技術都發揮著重要作用[24]。由于不同屬、不同種甚至不同生理小種在制備和再生過程中都存在一定的差異性,因此制備原生質體的具體方法和再生條件都有所不同,制備率和再生率波動也很大[11],因此,不同的致病疫霉菌株之間的差異也必然存在,在進一步研究中,應著重探索不同菌株間原生質體制備和再生條件差異、混合裂解酶的制備率,以及滲透壓穩定劑的優化。
4 結論
本研究以致病疫霉菌絲為材料,研究了不同菌齡、2種細胞壁裂解酶、3個裂解酶濃度、8個裂解時間梯度的原生質體制備條件和再生效率,建立了原生質體最佳制備條件,暨以培養18 d的菌絲體為材料,用10 mg/mL Driselase處理菌絲60 min后,原生質體產量達9.5×104個/g;同時研究還發現,以0.1 mol/L氯化鈣和0.4 mol/L甘露醇作為原生質體滲透壓穩定劑,以黑麥V8為再生培養基,得到的原生質體再生率能達到3.1%。
[1] 謝叢華. 馬鈴薯產業的現狀與發展[J]. 華中農業大學學報:社會科學版, 2012, 97(1):1-4.
[2] 胡同樂, 曹克強. 馬鈴薯晚疫病預警技術發展歷史與現狀[J].中國馬鈴薯, 2010, 24(2):114-119.
[3] Judelson HS, Tyler BM, Michelmore RW. Transformation of the oomycete pathogenPhytophthora infestansinvolves chromatin alterations[J]. Molecular Plant-Microbe Interactions, 1991, 4(6):602-607.
[4] Judelson HS, Coffey MD, Arredondo FR, et al. Transformation of the oomycete pathogenPhytophthora megaspermaf. sp.glycineaoccurs by DNA integration into single or multiple chromosomes[J].Current Genetics, 1993, 23(3):211-218.
[5] Mort-Bontemps M, Fevre M. Transformation of the oomyceteSaprolegnia monoicato hygromycin-B resistance[J]. Current Genetics, 1997, 31(3):272-275.
[6] Van West P, Kamoun S, Van’t Klooster J, et al. . Internuclear Gene Sliencing inPhytophthora infestans[J]. Molecular Cell, 1999, 3(3):339-348.
[7] Bottin A, Larche L, Villalba F, et al. Green fluorescent protein(GFP)as gene expression reporter and vital marker for studying development and microbe-plant interaction in the tobaccopathogen Phythphthora parasiticavar.nicotianae[J]. FEMS Microbiol Lett,1999, 176(1):51-56.
[8] Siammour A, Mauchmani B, Mauch F. Quantification of induced resistance againstPhytophthoraspecies expressing GFP as a vital marker:β-aminobutyric acid but not BTH protects potato andArabidopsisfrom infection[J]. Molecular Plant Pathology, 2003, 4(4):237-248.
[9] Riedel M, Calmin G, Belbahri L, et al. Green Fluorescent Protein(GFP)as a Reporter Gene for the Plant Pathogenic OomycetePhytophthora ramorum[J]. Journal of Eukaryotic Microbiology,2009, 56(2):130-135.
[10] Weiland JJ. Transformation ofPythium aphanidermatumto geneticin resistance[J]. Current Genetics, 2003, 2(2):191-199.
[11]陳孝仁, 張正光, 等. 大豆疫霉菌原生質體制備及再生菌株的生物學性狀[J]. 南京農業大學學報, 2000, 28(4):45-49.
[12] 付麗. 辣椒疫霉果膠裂解酶基因克隆及功能研究[D]. 泰安:山東農業大學, 2012.
[13] 劉士旺, 王政逸, 郭澤建. 綠色木霉的原生質體制備與轉化條件[J]. 農業生物技術學報, 2004, 12(1):96-101.
[14] 鄭小波. 疫霉菌及其研究技術[M]. 北京:中國農業出版社,1997:81-83.
[15] Mcleod A, Fry BA, et al. Toward Improvements of Oomycete Transformation Protocols[J]. Journal of Eukaryotic Microbiology,2008, 55(2):103-109.
[16] Yi SY, Kim YJ, Hwang BK. Protoplast Formation and Regeneration from Mycelia ofPhytophthora capsici[J]. The Korean Journal of Mycology, 1993, 21(1):1-8.
[17] 龍昊, 汪天虹, 劉萱, 等. 瑞氏木霉pyrG基因缺陷型菌株篩選以及GnTI和VHb基因表達研究[C]. 中國青年學者微生物遺傳學學術研討會文集, 2006.
[18] 張建萍, 朱凱, 楊爽, 等. 稗草生防潛力菌(Helminthosporiumgramineumf. sp. echinochloae)的原生質體制備和再生[J].浙江農業學報, 2010, 22(1):14-19.
[19] 黃玉茜, 梁春浩, 陳捷. 綠色木霉菌T23原生質體的制備與再生[J]. 吉林農業大學學報, 2007, 29(1):24-27.
[20] 董磊. 致病疫霉Pi-PIPK-D8功能的研究與分析[D]. 呼和浩特:內蒙古農業大學, 2015.
[21] 趙竟男, 江梅, 蘇曉慶. 滅蚊真菌貴陽腐霉原生質體的制備和再生研究[J]. 貴陽醫學院學報, 2008, 33(2):111-114.
[22] 江濤. 大豆疫霉營養生理及慢性生長菌株生物學特性研究[D]. 合肥:安徽農業大學, 2012.
[23] 李立鳳, 李小梅, 張景濤. 辣椒疫霉菌生長和產孢條件的研究[J]. 東北農業大學學報, 2010, 41(10):139-142.
[24] 雷虹, 曾偉民, 金忠斌, 等. 小白鏈霉菌(Streptomyces albulus)的原生質體制備研究[J]. 黑龍江大學:自然科學學報,2007, 24(3):306-309.

