有機相脂肪酶催化合成山梨酸乙酯的研究
,, ,
(1.浙江工業大學 生物工程學院,浙江 杭州 310014;2.浙江省生物有機合成技術研究重點實驗室,浙江 杭州 310014)
山梨酸乙酯是一類新型的山梨酸衍生物,是一種國際公認的低毒高效食品防腐劑,也是一種重要的農藥增效劑[1].目前山梨酸乙酯的合成主要是化學合成法.湯健[2]報道了一種仿自然衍生法制取山梨酸乙酯原液,制備工藝較繁瑣,山梨酸乙酯得率為85%.鄧繼勇等[3]研究了以氯化亞錫水合物為催化劑催化山梨酸乙酯的合成,山梨酸乙酯的分離處理復雜.梁紅冬等[4]報道了一種山梨酸乙酯的合成方法,反應在110 ℃溫度條件下進行,存在較大安全隱患.因此化學法合成反應條件苛刻,存在副反應多、設備腐蝕嚴重和后處理復雜等缺點.酶催化法[5]利用酶對催化反應的高度專一性,具有反應條件溫和、節能環保和催化效率高等優點,已顯示出巨大的發展潛力和廣闊的應用前景.
脂肪酶(EC 3.1.1.3)又稱甘油酯水解酶,是一類特殊的酯鍵水解酶,能夠催化酯化、酯水解、醇解和轉酯化等多種反應[6-8],在油水界面可催化脂肪分解為甘油和脂肪酸,在非水介質中則催化甘油和脂肪酸合成脂肪[9-10].脂肪酶具有界面活化現象,在油水界面的催化活性會得到顯著提高.在脂肪酶催化體系中,除了參與反應的酶和底物外,反應介質也有影響[9].與傳統的水相酶催化相比,在近乎無水的有機相中的酶催化反應,脂肪酶表現出優異的催化作用.筆者首次利用脂肪酶催化山梨酸和乙醇合成山梨酸乙酯,對該催化反應的影響因素進行了系統的優化研究.
1 材料與方法
1.1 材料與儀器
固定化CandidaanatarcticB脂肪酶(Novozym 435)、固定化Rhizomucormiehei脂肪酶(Lipase RM IM)和Thermomyceslanuginosus脂肪酶(Lipase TL IM)購于丹麥Novo Nordisk公司;Asperillusniger脂肪酶(A.nigerLipase)、Pseudomonasfauore脂肪酶(Lipase AK)、固定化Burkholderiacepacia脂肪酶(Lipase PS IM)購于日本Amano公司;Aspergillusoryzae脂肪酶(A.oryzaeLipase)中國典型培養物保藏中心M206105;Penicilliumexpansum脂肪酶(P.expansumLipase)購自深圳綠微康生物工程有限公司;山梨酸由寧波王龍科技股份有限公司贈送;山梨酸乙酯購于阿拉丁試劑(上海)有限公司;4A分子篩、無水乙醇、正己烷、乙酸乙酯等化學試劑均為分析純,國藥集團化學試劑有限公司.
臺式恒溫水浴搖床(M1248-0003,美國NBS公司);氣相色譜儀(Agilent 6890N,美國安捷倫科技公司);電子分析天平(PB203-N,上海世義精密儀器有限公司).
1.2 實驗方法
1.2.1 山梨酸乙酯的合成
在25 mL具塞反應瓶中,將1.0 mmol乙醇和0.5 mmol山梨酸溶解于5 mL有機溶劑中,混勻后加入50 mg脂肪酶粉.在搖床上以150 r/min轉速,37 ℃反應10 h后取出部分樣品進行檢測.其反應式為

1.2.2 反應過程的色譜分析
酶催化反應過程通過氣相色譜儀分析.取反應液100 μL,用環己烷稀釋至測定范圍進行分析,色譜柱HP-5(30 m×0.32 mm,0.25 μm)、載氣(N2)流速2.0 mL/min;進樣口溫度220 ℃,分流比20∶1;柱箱溫度120 ℃,恒溫保持2 min,以10 ℃/min 的速率上升到150 ℃,恒溫保持6 min.采用氫離子火焰檢測器,檢測器溫度250 ℃;山梨酸乙酯保留時間為4.1 min.
1.2.3 反應得率的測定
山梨酸乙酯摩爾分數測定后,算出其摩爾濃度.反應得率=(山梨酸乙酯摩爾濃度/山梨酸初始摩爾濃度)×100%.
1.2.4 產物的質譜分析方法
GC-MS分析條件(Agilent 7890N/5975C):氣相色譜柱型號HP-5 MS,進樣口溫度250 ℃;進樣量1 μL;分流比50∶1;柱流速1 mL/min;柱溫箱溫度100 ℃保留3 min,10 ℃/min升溫至200 ℃保留5 min;輔助加熱區溫度250 ℃;MS四極桿溫度150 ℃,離子源溫度230 ℃.EI+轟擊源,全掃描模式掃描,掃描質量范圍30~500 amu,發射電流200 μA,電子能量70 eV.
2 結果與分析
2.1 脂肪酶的篩選
筆者考察了Novozym 435,Lipase RM IM,Lipase TL IM,Lipase AK,A.nigerLipase,P.expansumLipase,A.oryzaeLipase和Lipase PS IM脂肪酶等8 種不同來源脂肪酶對該反應的催化效果,結果見表1.根據表1中數據可以看出:Novozym 435脂肪酶具有催化合成山梨酸乙酯活力,轉化率達到8.7%,因此確定山梨酸乙酯合成反應催化劑為Novozym 435.

表1 脂肪酶催化反應的篩選Table 1 Screening of lipase for the synthesis of ethyl sorbate
2.2 有機溶劑的影響
有機溶劑作為反應介質對底物的相對溶解度、酶的催化活性和穩定性有一定的影響,而酶的催化活性與溶劑的疏水性大小(logP)有很大關系[11].在一定程度上可以作為溶劑極性的定量表達,logP值越高,溶劑的疏水性越強,對酶催化的影響也越小[12].為了確定反應的最適反應介質,以Novozym 435脂肪酶催化反應,分別以環己烷、異辛烷、叔丁醇、甲基叔丁基醚、1,4-二氧六環、甲苯和二氯甲烷作為反應溶劑進行考察,它們的疏水性如表2所示(有機溶劑在25 ℃時的logP值數據來源于SciFinder Scholar).有機溶劑對酶催化反應的影響如圖1所示,可得出Novozym 435在叔丁醇、環己烷和異辛烷有機溶劑中催化活性較高,表明酶催化活性與溶劑疏水性參數logP有一定相關性,但并無必然關聯.其中叔丁醇中得率最高,故選取叔丁醇作為反應溶劑做下一步實驗.

表2 有機溶劑及其logP值Table 2 Organic solvents and their logP

1—環已烷;2—異辛烷;3—叔丁醇;4—甲基叔丁基醚;5—1, 4-二氧六環;6—甲苯;7—二氯甲烷圖1 不同有機溶劑對酶催化反應的影響Fig.1 Effect of various solvents on the enzymatic catalytic reaction
2.3 底物摩爾比對酶催化反應的影響
通過控制反應底物的摩爾比,可以改變反應速率來縮短反應所需時間,且降低下游提取工藝難度[13-14].脂肪酶催化的酯化反應為可逆反應,過多的乙醇加入使體系的山梨酸和脂肪酶濃度降低[15],從而降低山梨酸乙酯的得率,因此有必要通過對幾種不同底物摩爾比進行比較來確定最佳底物摩爾濃度比例.在叔丁醇反應體系中,以Novozym 435脂肪酶催化反應,用不同底物濃度比例反應的結果如圖2所示,在n(乙醇)∶n(山梨酸)<5∶1時,山梨酸乙酯的得率隨著比例的提高而升高,當底物摩爾比為5∶1時,轉化率達到最大為46.3%,故選用5∶1的比例進行下一步實驗.
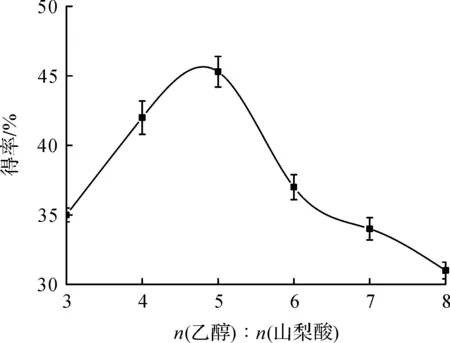
圖2 底物摩爾比對酶催化反應的影響Fig.2 Effect of substrate molar ratio on the enzymatic catalytic reaction
2.4 分子篩種類對酶催化反應的影響
在脂肪酶的酯化反應過程中,反應體系中的含水量會直接影響反應速率及反應平衡.水是維持脂肪酶活力的必需物質,含水量過低會降低酶的催化活性,含水量過高則破壞反應化學平衡,抑制反應平衡向產物方向移動[16-17],從而降低得率.因此反應體系中適宜的含水量對脂肪酶的催化反應中提高底物的轉化率具有重要的意義.本實驗叔丁醇反應體系中,以Novozym 435脂肪酶催化反應,n(乙醇)∶n(山梨酸)=5∶1,通過在反應體系中加入不同種類及不同濃度的分子篩來改變反應體系中的水分[18],以考察含水量對山梨酸乙酯得率的影響,結果如圖3所示.結果表明:當反應體系中加入4A分子篩及添加比例為1∶10時,山梨酸乙酯得率最大為79.6%.

1—4A 1∶5;2—5A 1∶5;3—4A 1∶10;4—5A 1∶10; 5—4A 1∶15;6—5A 1∶15圖3 分子篩種類對酶催化反應的影響Fig.3 Effect of zeolite on the enzymatic catalytic reaction
2.5 反應溫度對酶催化反應的影響
酶反應動力學得出溫度升高,反應速度加快[19].但過高的溫度會破壞酶的三級結構,進而降低反應速率,同時溫度的改變對于有機溶劑黏度的影響也會影響轉化率.因此最優反應溫度的考察就顯得十分必要.在叔丁醇反應體系中,利用Novozym 435脂肪酶催化反應,n(乙醇)∶n(山梨酸)=5∶1,添加4A分子篩比例為1∶10,不同溫度條件進行酶催化反應的結果如圖4所示.轉化率隨溫度的升高而升高,但超過60 ℃后,酶蛋白在高溫下逐漸失活,影響了催化反應,導致底物轉化率降低.因此最佳反應溫度選擇為60 ℃,此時山梨酸乙酯得率可達97.4%.

圖4 反應溫度對酶催化反應的影響Fig.4 Effect of reaction temperature on the enzymatic catalytic reaction
2.6 酶催化反應的時間曲線
在以上最佳單因素優化后的條件下進行酶催化試驗,不同反應時間后取樣檢測山梨酸乙酯,比較山梨酸乙酯得率,結果見圖5.由圖5得出:隨酶催化時間的增長,反應得率不斷升高,當酶催化反應進行10 h后,反應得率增加減緩,可能由于反應過程中產物的山梨酸乙酯大量積累后水解速率增加,導致酯化反應和水解反應達到平衡.因此,該酶催化反應選擇反應時間為10 h,此時得率可達97.4%.

圖5 酶催化反應的時間曲線Fig.5 Time course of enzyme-catalyzed reaction
2.7 產物的表征結果分析
酶催化反應合成得到的山梨酸乙酯利用氣相色譜-質譜聯用儀分析,得到產物的氣相質譜圖(圖6).根據質譜圖推測該產物為山梨酸乙酯,其中m/z=140.1為山梨酸乙酯的分子離子峰.

圖6 山梨酸乙酯的GC-MS質譜圖Fig.6 Mass spectrometry of ethyl sorbate
3 結 論
利用脂肪酶催化以山梨酸和乙醇為原料合成了重要的低毒高效食品防腐劑山梨酸乙酯,通過單因素試驗對該催化反應的影響因素(反應溶劑、溫度和底物摩爾比等)進行了系統的優化研究,確定了最佳合成工藝條件:脂肪酶Novozym 435作為催化劑,叔丁醇為反應溶劑,n(乙醇)∶n(山梨酸)=5∶1,吸水劑4A分子篩添加量10%,反應溫度60 ℃,當反應10 h后山梨酸乙酯得率可達到97.4%,產物經氣相質譜(GC/MS)結構鑒定.構建了一條酶法合成山梨酸乙酯的綠色工藝路線,為進一步商業化開發和綠色生產山梨酸乙酯提供良好的理論和實踐基礎.
參考文獻:
[1] 何建真,王健燕,陳競宇.山梨酸乙酯制備方法及其應用[J].廣西化工,1998,27(2):30-32.
[2] 湯健.山梨酸乙酯原液的生產方法:中國,99112561.4[P].2001-05-23.
[3] 鄧繼勇,周原,王煥龍.山梨酸乙酯的非酸催化合成[J].廣西化工,2000,29(3):7-10.
[4] 梁紅冬,陳建,范偉婷.山梨酸乙酯的合成研究[J].廣東石油化工學院學報,2013,23(1):67-72.
[5] 段章群,杜偉,劉德華.生物酶法制備1,3-甘油二酯[J].化學進展,2009,21(9):1939-1944.
[6] KRETZA E, PAPANEOPHYTOU C, PAPI R, et al. Lipase activity inThermusthermophilusHB8: purification and characterization of the extracellular enzyme[J]. Biotechnology and bioprocess engineering,2012,34(17):512-525.
[7] 馬玲芝,錢俊青.離子交換樹脂固定化脂肪酶催化合成蔗糖乙酯[J].浙江工業大學學報,2012,40(1):21-24.
[8] 錢俊青,蔣盛藍,秦德懷,等.214型離子交換樹脂固定化假絲酵母脂肪酶的研究[J].浙江工業大學學報,2013,41(3):244-247.
[9] ZAKS A, KLIBANOV M. Enzyme catalyzed processes in organic media at 100 ℃[J]. Abstracts of papers of the American chemical society,1984,81(188):1249-1251.
[10] SALWA KARBOUNE, MOHAMMAD SAFARI, BENA-MARIE LUE, et al. Lipase-catalyzed biosynthesis of cinnamoylated lipids in a selected organic solvent medium[J]. Journal of biotechnology,2005,119(156):281-290.
[11] 彭立鳳.有機溶劑對酶催化活性和選擇性的影響[J].化學進展,2000,12(3):103-105.
[12] 姚俠,鄭建永,應向賢,等.有機相脂肪酶催化合成乙酸肉桂酯[J].生物加工過程,2012,10(3):12-16.
[13] 杜理華,徐亮亮,成柄灼.一種脂肪酶催化柚皮苷酯化反應的研究[J].浙江工業大學學報,2014,42(6):627-631.
[14] 黃志良,戰宇,寧正祥,等.山梨酸酯的合成與抗菌作用研究[J].華南農業大學學報,2002,23(3):84-86.
[15] 黃小華,胡益民,王修然.山梨酸乙酯的制備[J].安微機電學院學報,1999,14(4):19-22.
[16] 王召賀,張云,孫愛君,等.一種深海微生物脂肪酶在非水介質中催化合成乙酸肉桂酯的應用研究[J].食品工業科技,2016,9(1):202-206.
[17] 孫平,卜慶珍,唐小華,等.脂肪酶催化麥芽糖硬脂酸酯合成的研究[J].中國食品添加劑,2009(2):108-111.
[18] 王曉梅,張建榮.分子篩脫除碳酸酯中微量水的應用研究[J].河北化工,2012,35(10):78-80.
[19] 閆倩云,李玲玲,叢方地,等.固定化脂肪酶生物反應器催化合成乙酸正己酯[J].食品工業科技,2015,36(9):171-174.

