循環水和網箱兩種養殖模式下黃姑魚生長、免疫及血清生化的差異
王孝杉,張晨捷,彭士明,施兆鴻,宋 泰
(中國水產科學研究院東海水產研究所,農業部東海與遠洋漁業資源開發利用重點實驗室,上海 200090)
海水魚類的養殖模式主要有池塘養殖、網箱養殖和陸基養殖3大類[1]。不同的養殖品種因各自的生態習性,對3種養殖模式有著不同的適應性,包括養殖種類對環境的適應性、不同養殖環境條件下的生長性能、抗病性能以及品質等。以石首魚類中的大黃魚(Larimichthys croceus)為例,采用同樣的配合飼料投喂,在工廠化循環水系統條件下,因水深、巡游范圍等限制因素,會導致大黃魚的活動減弱,抵抗力下降[2];而在近海大圍網養殖條件下,增加了水層的深度和擴大了魚的活動范圍,使得環境條件更符合大黃魚的生態習性,有效的提高了魚的品質,養殖效率顯著提高[3-4]。可見,在不同養殖模式條件下,同一種魚類的養殖效果會有顯著差異,對其進行比較研究有著重要的生態學意義。
血清中的葡萄糖(GLU)、乳酸(LD)和皮質醇(COR)等指標是魚類的血清生化指標,可反映其代謝水平及免疫狀況[5-6]。溶菌酶(LZM)可通過水解革蘭氏陽性細菌的細胞壁中粘肽的乙酰氨基多糖,并使之裂解并釋放出來形成一個水解酶體系,破壞和消除侵入體內的異物[7];免疫球蛋白(Ig)是一類重要的免疫效應分子,由免疫系統淋巴細胞產生的蛋白質,經抗原的誘導轉化為抗體,參與機體的防御功能。因此,LZM和Ig是研究魚類受脅迫后免疫反應的重要指標[8]。而魚類的肝臟是各種物質代謝的重要器官之一,除了合成和貯存功能外,同時也是氧化防御、中和并分解有毒物質的重要組織[9]。肝臟中含有大量的抗氧化酶類,如超氧化物歧化酶(SOD)、過氧化氫酶(CAT)、谷胱甘肽過氧化酶(GSH-Px),這些抗氧化酶類會隨不同的養殖環境而發生變化,來抵御環境脅迫所產生的氧化壓力[10]。總抗氧化能力(T-AOC)則表示魚體清除自由基能力的強弱,以及脂質過氧化產物多少。脂質過氧化物經分子內的環化、裂解等步驟產生的丙二醛(MDA),會與脂質、蛋白質、核酸等大分子進行交錯連結反應,進而對機體造成傷害。肝臟中的這些指標常被用來衡量機體抗氧化防御體系的作用大小[11-12]。可見這些血清生化指標和肝臟抗氧化指標,對研究不同養殖模式條件下魚類的生長代謝和免疫具有實際意義。
黃姑魚(Nibea albiflora)是石首魚類中優良的養殖品種之一,具有生長迅速、抗病能力強、肉質鮮美、食性廣、對環境的適應性好、抗逆性強等特點,喜好棲息在水體的中下層區域[13]。在我國沿海有良好的養殖基礎,養殖區域廣泛[14-15],長江以南地區以近海網箱養殖為多,其它地區也有在陸基循環水系統中進行養殖。本文選取黃姑魚為實驗對象,分別在循環水系統和淺海網箱條件下進行同步養殖實驗,從生長狀況、免疫和血清生化指標等方面進行比較研究,以期說明兩種養殖模式下黃姑魚的養殖生態學意義,為黃姑魚產業發展提供參考資料。
1 材料與方法
1.1 實驗用魚和實驗場地
實驗用黃姑魚購自福建省寧德市某水產有限公司,體長(9.19±0.69)cm、體質量(15.78±2.59)g,于2015年7月16日用活水車運抵福鼎沙埕港,將1×104尾魚平均放入循環水系統的4個直徑4 m、水深1.2 m的圓形水泥池中,另將1.2×104尾魚平均放入4個3×3×2.5 m的網箱中。
1.2 實驗條件和設計
實驗分為兩種養殖模式,分別在同一水域的陸基循環水養殖系統和近海網箱養殖系統。根據循環水系統的設計能力和當地網箱養殖黃姑魚的放養密度,兩種模式的養殖密度分別為165尾·m-3和135尾·m-3,實驗周期為300 d。循環水系統環境條件:水溫16~30℃,鹽度18~28,pH 7.4~8.3,溶解氧≥7.0 mg·L-1,循環水系統設計的養殖承載量為15 kg·m-3,4口實驗池共用一組水處理系統,每天循環2次,每次6 h,循環水量10.0~15.0 m3·h-1。網箱水域水溫12~30℃,鹽度18~28,pH 7.8~8.3,溶氧量≥7.0 mg·L-1,漲退潮時平均水流速約2 m·s-1,4個網箱按“田”字形對潮流排列。兩種養殖模式中均采用日本林兼株式會社生產的NOVA系列飼料。
每次取樣時分別在每個池(或網箱)中隨機取3ind魚,循環水系統和網箱中各取12尾魚,分別代表兩種養殖模式中的樣本情況。取樣時間點為實驗開始前(0 d)、50 d、100 d、200 d和實驗結束時(300 d)。
1.3 樣品采集與分析
先用200 mg·L-1的 MS222麻醉,隨后稱量體質量和體長,在冰盤上用常規方法抽取尾靜脈血制備血清、解剖并取肝臟置于5 mL的離心管內,血清和肝臟都放置在-70℃超低溫冰箱中凍存備用。
黃姑魚生長指標根據取樣情況和日常記錄統計計算:
特定生長率(%·d-1)=[ln(實驗末魚體質量)-ln(實驗初魚體質量)]/天數×100%
飼料系數=總投飼量/總增重量
存活率=(實驗結束魚尾數/實驗開始魚尾數)×100%
黃姑魚肝臟或血清中的SOD、CAT、GSH-Px、T-AOC、GLU、LD、COR、MDA、LZM的活性或濃度和Ig M含量采用南京建成生物工程研究所的試劑盒測定。測定方法參見說明書。
1.4 統計與分析
實驗結果用SPSS 19.0軟件進行統計與分析。運用單因素方差分析,先進行方差齊性檢驗,不滿足方差齊性時,對數據進行自然對數或平方根轉換,然后采用Duncan’s檢驗,進行多重比較。P<0.05為有顯著性差異,數據以平均值±標準差(Mean±SD)表示。用Excel 2013繪制圖表。
2 結果與分析
2.1 兩種養殖模式下的黃姑魚生長比較
黃姑魚在兩種不同養殖模式下的生長情況見圖1、圖2。實驗結束時,兩種模式下黃姑魚的體質量分別是(140.09±26.98)g和(151.69±17.67)g。循環水系統中黃姑魚的體質量特定生長率為0.32%,網箱中黃姑魚的體質量特定生長率為0.33%,其中50 d循環水系統和網箱中的特定生長率分別是1.01%和0.88%,中后期(200 d)分別為0.11%和0.16%。特定生長率在兩種養殖模式下都是前期生長快于中后期,其中前期循環水系統快于網箱,而中后期則是網箱快于循環水系統,兩種模式之間無顯著性差異(P>0.05)。
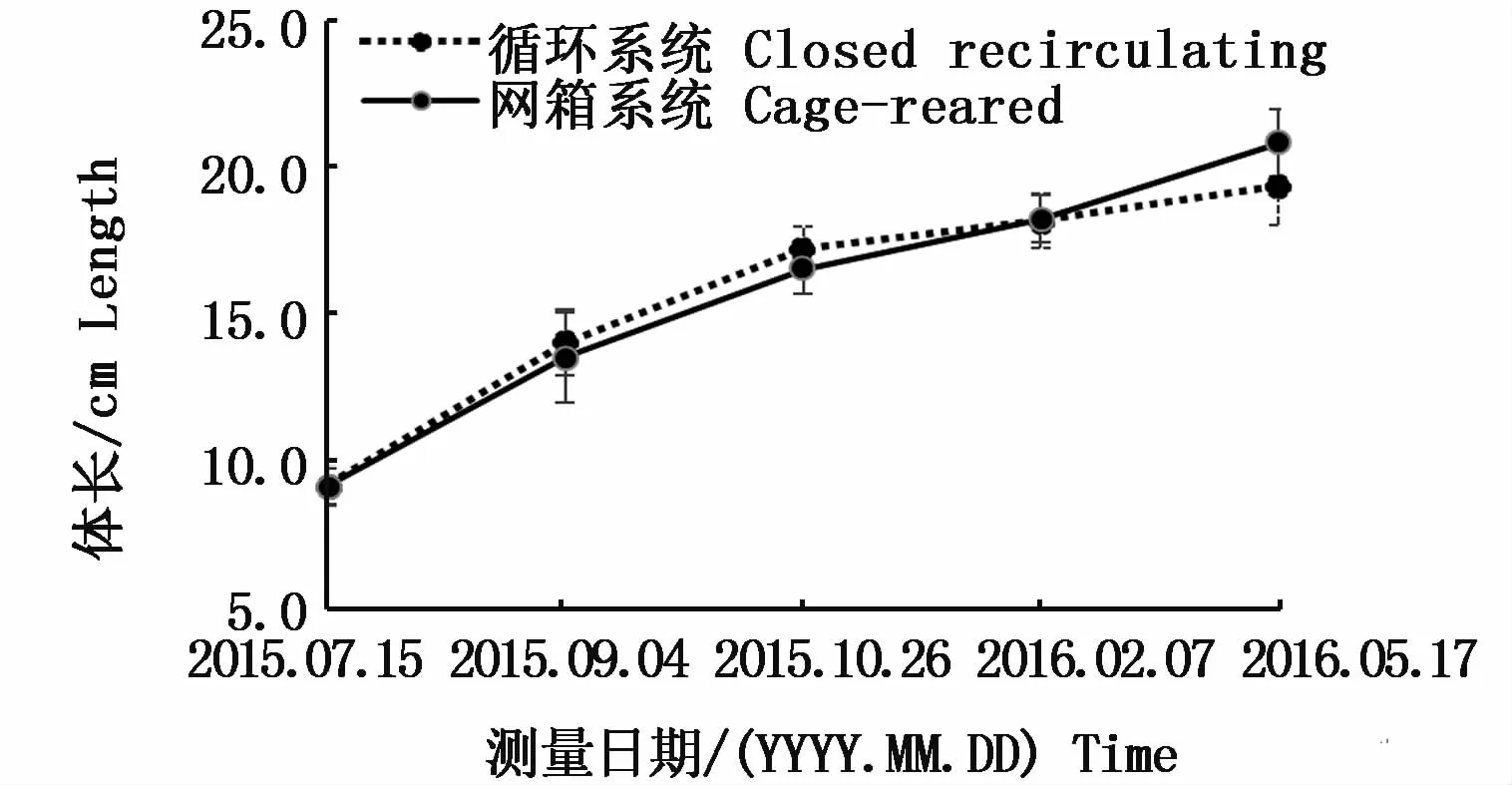
圖2 兩種養殖模式下黃姑魚的體長變化Fig.2 Body length growth of Nibea albiflora between recirculating aquaculture and offshore cage culture
實驗結束時,循環水系統中黃姑魚的總存活率(64.85±4.72)%,網箱為(77.50±5.32)%,網箱顯著高于循環水系統(P<0.05)。循環水系統中死亡高峰主要集中在前期入池后60 d、以及當池中的魚體質量接近或達到循環水系統的養殖承載量為15 kg·m-3的時期;網箱則無明顯死亡高峰。
循環水系統和網箱系統中的飼料系數分別為1.21和1.07。
2.2 兩種養殖模式下黃姑魚的免疫性能比較
兩種養殖模式下溶菌酶活力均呈不斷上升的趨勢,實驗開始時(0 d)與結束時(300 d)有顯著性差異(P<0.05)。實驗進行至50~100d時循環水系統中溶菌酶活力最大,且與網箱之間差異顯著(P<0.05)。
免疫球蛋白M兩種養殖模式在實驗開始時和結束時均沒有顯著差異(P>0.05),兩種養殖模式間也沒有顯著性差異(P>0.05),但在實驗中期(100 d),兩種模式均有顯著上升,分別達到了(1.737±0.365)mg· mL-1和(1.617±0.256)mg·mL-1,與其它各檢測時間點之間差異顯著(P<0.05)。
2.3 兩種養殖模式下黃姑魚的血清生化指標比較
由圖4-A中可見,血清中葡萄糖在兩種養殖模式下均有顯著升高,從開始時的(4.230±0.548)μg·mL-1上升至(7.026±0.641)μg·mL-1和(7.067±0.607)μg·mL-1,隨后有所下降,但實驗結束時仍顯著高于實驗開始時的血糖濃度(P<0.05)。乳酸與葡萄糖的變化趨勢相似,實驗前期網箱中乳酸高于循環水系統,并在實驗中期顯著高于循環水系統,隨后低于循環水系統中的乳酸含量,但差異不顯著(P>0.05)(圖4-B)。皮質醇在兩種養殖模式中未出現明顯的變化,僅在實驗結束時循環水系統中皮質醇回落至初始濃度,且與網箱差異顯著(P<0.05)(圖4-C)。循環水系統中丙二醛在整個實驗期間除在50 d時高于初始濃度外,其它各檢測點均沒有顯著性差異;網箱中丙二醛總的變化趨勢是不斷減小,并在實驗結束時與之前各檢測點間差異顯著(P<0.05),與循環水系統間也有顯著差異(P<0.05)。
2.4 兩種養殖模式下黃姑魚的肝臟抗氧化指標比較
循環水系統中各實驗池黃姑魚肝臟的抗氧化指標,在第1個檢測時間(50 d)均有顯著提高,并且均與網箱中黃姑魚肝臟的抗氧化指標有顯著性差異(P<0.05)。循環水系統中SOD活力先急速上升而后慢慢下降,而網箱則呈平穩上升趨勢。兩個系統中的CAT和GSH-Px活力均呈先上升后緩慢下降的變化。
循環水系統中黃姑魚肝臟中的總抗氧化能力從實驗開始時的(7.683±0.731)U·mgprot-1上升到 100d時的(60.808±12.937)U·mgprot-1,遠高于網箱的(8.204±0.167)U·mgprot-1,后期循環水系統中的總抗氧化能力為(18.849±6.442)U·mgprot-1,雖有所回落,但仍高于網箱中的(4.344±0.199)U·mgprot-1,而且存在顯著性差異(P<0.05)。網箱中黃姑魚肝臟的總抗氧化能力在實驗期間比較平穩,各檢測時間點無顯著性差異(P>0.05)。
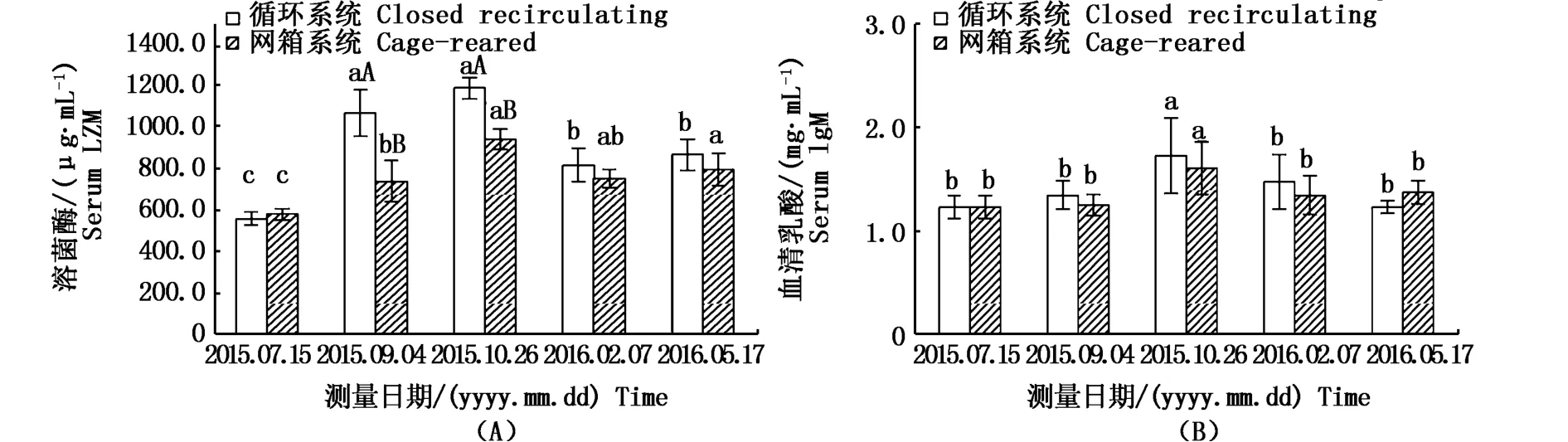
圖3 兩種養殖模式下黃姑魚免疫指標比較Fig.3 Comparison of immune indicators of Nibea albiflora between recirculating aquaculture and offshore cage culture注:A:溶菌酶;B:免疫球蛋白。不同小寫字母表示各時間之間差異顯著,不同大寫字母表示兩組間差異顯著Note:A:lysozyme;B:immunoglobulin M.Different lowercase letters indicate significant differences from each other at the same time(P<0.05).Different uppercase letters indicate significant differences from each other in the same experimental group(P<0.05)
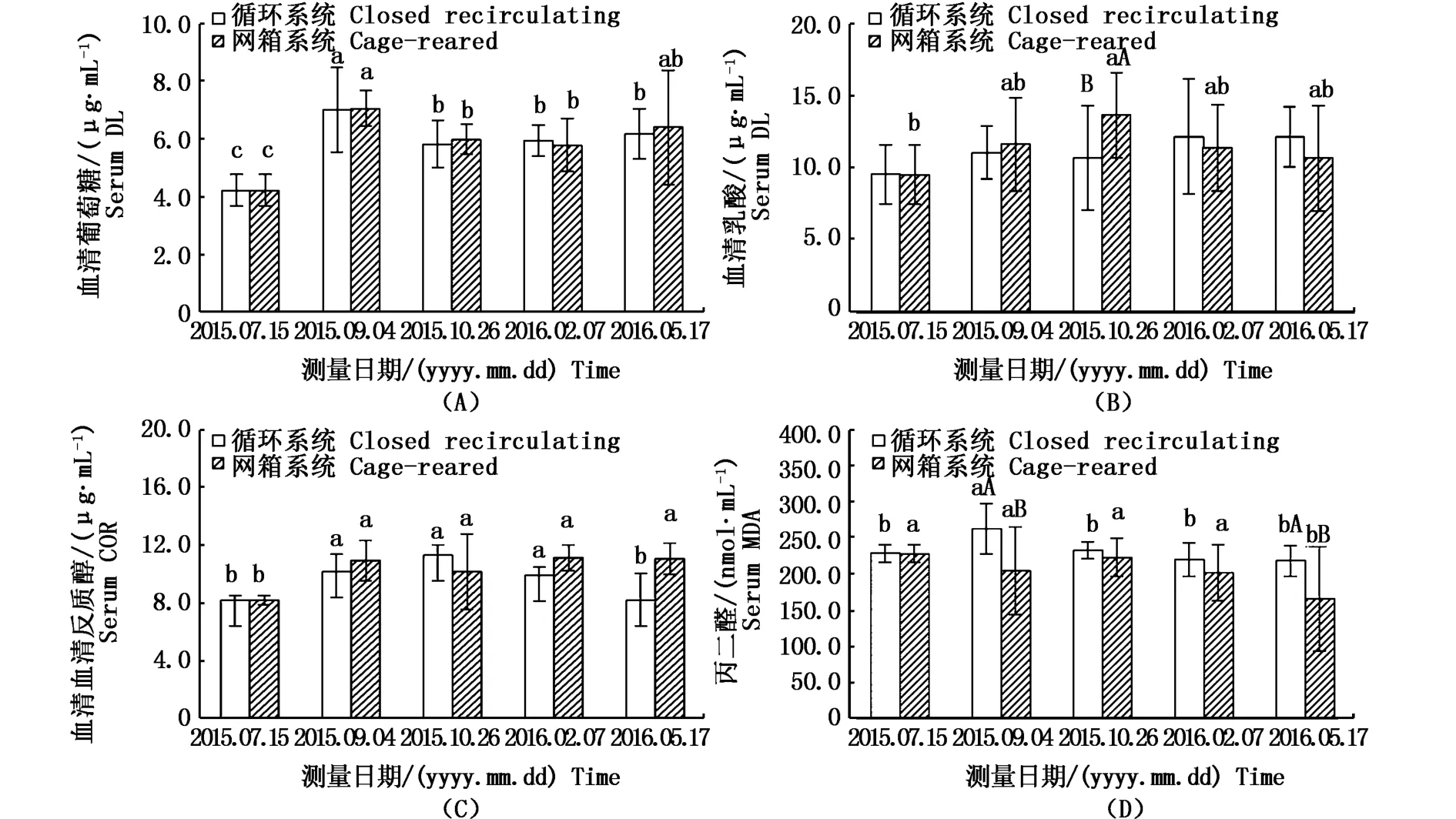
圖4 兩種養殖模式下黃姑魚血清生化指標Fig.4 Immunity and serum biochemical indexes of Nibea albiflora between recirculating aquaculture and offshore cage culture注:A:葡萄糖;B:乳酸;C:皮質醇;D:丙二醛;不同小寫字母表示時間之間的差異顯著,大寫字母表示組間的差異顯著Note:A:glucose,B:lactate,C:cortisol,D:malondialdehyde.Different lowercase letters indicate significant differences from each other at the same time(P<0.05).Different uppercase letters indicate significant differences from each other in the same experimental group(P<0.05)
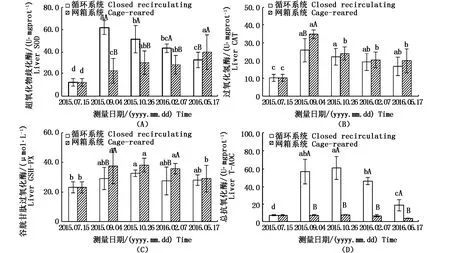
圖5 兩種養殖模式下黃姑魚肝臟抗氧化性能Fig.5 Total antioxidants capacities of Nibea albiflora between recirculating aquaculture and offshore cage culture注:A:超氧化物歧化酶;B:過氧化氫酶;C:谷胱甘肽過氧化酶;D:總抗氧化酶。不同小寫字母表示各時間之間的差異顯著,不同大寫字母表示兩組間的差異顯著Note:A:superoxide dismutase;B:catalase;C:glutathione peroxidase;D:total antioxidants capacities.Different lowercase letters indicate significant differences from each other at the same time(P<0.05).Different uppercase letters indicate significant differences from each other in the same experimental group(P<0.05)
3 討論
3.1 養殖模式對黃姑魚生長和免疫性能的影響
本實驗所選用的黃姑魚為春季繁育的苗種,實驗開始時(7月中旬)體長和體質量分別是(9.19±0.69)cm和(15.78±8.18)g。而實驗用循環水系統和網箱為苗種暫養專用、容積較小,循環水系統承載量僅15 kg·m-3,網箱也是小網箱。從養殖效果分析,兩種模式都基本達到了生產要求,但在實驗后期,循環水系統已經達到了系統設計的承載量,致使后期的死亡率不斷升高,系統中的pH值不斷下降,氨氮升高,也佐證了黃姑魚可能對密度脅迫產生了應激反應。許多研究表明,密度與生長性能相關,條石鯛(Oplegnathu sfasciatus)在高密度養殖條件下會導致生長率下降,餌料系數升高[16];過高的養殖密度可導致銀鯰(Phamdia quelen)的生長性能由于對空間和食物的競爭而顯著下降[17]。
魚類血清中溶菌酶在抵御外來病原菌方面發揮著重要作用,血清溶菌酶活力提高,其免疫能力也相應提高。本研究顯示,隨著黃姑魚的生長和養殖容量的不斷增加,兩種模式中黃姑魚的血清溶菌酶活力都逐漸上升,表明密度脅迫對黃姑魚溶菌酶活力有一定的促進作用,這與ROTLLANT等[21]得出的真鯛(Pagrus pagrus)在高密度組中的血清溶菌酶活力顯著高于低密度組的研究結果相似。但也有研究認為密度脅迫會導致血清溶菌酶活力降低[22],說明魚類血清溶菌酶的活力可能受諸多因素影響。有學者研究指出,溶菌酶活力可以作為魚類應激的信號,并且指出溶菌酶活力升高所持續的時間取決于脅迫的方法和強度[23]。圖3-A中兩種養殖模式的溶菌酶活力都隨養殖時間的延長而升高,可能是養殖密度對黃姑魚都形成了一定的脅迫,導致其產生了應激,兩種養殖模式下溶菌酶活力的差異可能是脅迫方法的不同所致。徐冬冬等[14]在網箱養殖黃姑魚的實驗中報道,其生長速度明顯高于本實驗的兩種養殖模式,除養殖的密度不同外,環境條件也存在顯著的差異。在本實驗中,循環水系統的養殖容量前期較后期低,而溶菌酶活力反而高于后期,這是否預示著溶菌酶活力并不僅受密度脅迫的影響,也可能與魚體長大、其抗逆能力增強有關,這有待實驗驗證。
3.2 黃姑魚血清生化指標對不同養殖模式的響應
在集約化養殖過程中,密度是一個潛在的慢性脅迫因子,可導致魚類生理生化指標及行為學的變化[24]。魚類為提供能量一般以增加血糖代謝為主,即由體內的糖元轉化為葡萄糖,再將葡萄糖分解成三磷酸腺苷(ATP)。應激反應可導致魚類血糖含量明顯升高,出現高血糖癥[25]。本研究發現,兩種養殖模式條件下血糖都出現了升高的現象,這說明在本實驗條件下養殖密度對黃姑魚產生了相應的脅迫,黃姑魚通過提高血糖來保證應激所需的能量。但兩種模式之間不具有生物統計學上的意義,可以認為兩種養殖模式下的養殖密度都處于一種臨界的脅迫狀態。
在脅迫環境下,水中缺氧、或血液循環緩慢以及劇烈運動都可使魚體內的乳酸含量升高[26]。本實驗中兩種養殖模式都保證了充足的氧氣供給和適當的水流速度,因此,推測乳酸的增高可能與密度的增大而導致魚活動加劇消耗能量有關。一般認為乳酸參與糖異生作用時魚類會通過糖異生作用來消耗蛋白質和脂肪等來滿足能量的需求,而乳酸則是糖異生反應的優先替代物[27]。乳酸含量的增高可能還是與提供能量有關,因此血清中乳酸和血糖等指標對于養殖密度研究都具有一定的預測價值。
一般認為皮質醇是評價魚類應激反應強弱的重要指標,皮質醇濃度過高或長期持續在較高濃度時,會對魚類造成負面影響[28]。URBINATI等[29]研究認為因密度增加使皮質醇含量升高,本實驗中皮質醇濃度隨養殖容量的增加而上升。其結果與URBINATI等[29]報道的結果類似。但也有研究認為皮質醇含量隨密度的增高而出現下降的趨勢[30],還有研究報道魚類在擁擠環境下皮質醇濃度在實驗初期會顯著升高,但隨著對擁擠環境的長期適應,又會回到原有的水平,如BARTON等[31]報道慢性擁擠脅迫的虹鱒(Oncorhynchus mykiss)血漿皮質醇水平先升高然后在8 d內恢復至正常水平。本實驗的養殖周期較長,兩種養殖模式下實驗開始后黃姑魚血清皮質醇濃度都保持在一定的水平,與實驗開始時相比具有顯著性差異。因本實驗是兩種模式間的比較研究,皮質醇濃度的變化是否是因為黃姑魚受到了脅迫并產生的應激反應,還有待于進一步研究。
隨著皮質醇等激素水平的上升,血糖水平也會升高[32-33],其原因可能在于皮質醇能激活糖異生中的關鍵酶(如葡萄糖-6-磷酸酶),從而促進糖異生和糖原分解[34]。有研究表明,血糖濃度伴隨著皮質類固醇含量的升高而升高[35]。本實驗也得出相似結論,即養殖生物量的增加使密度變大,皮質醇含量升高的同時也伴隨著血糖含量的升高,與實驗開始前差異顯著,都具有統計學意義。
血清中MDA濃度能間接地反映自由基攻擊細胞的程度。VINAGRE等[36]認為自由基作用于脂質發生過氧化反應時的氧化最終產物為MDA,它能引起蛋白質、核酸等生命大分子的交聯聚合,且具有生物毒性。本實驗的循環水系統中各檢測點之間丙二醛濃度沒有顯著性差異,而網箱中丙二醛濃度基本呈下降的趨勢,表明黃姑魚在兩種養殖模式中都可以通過調整而適應脅迫,具有一定的抗氧化能力。
3.3 黃姑魚肝臟抗氧化指標對不同養殖模式的響應
當魚類處于特定環境時,其必然會產生應激反應,通過增加機體耗能,加快新陳代謝,引發體內抗氧化酶的響應,以應對脅迫反應。魚體肝臟內含有超氧化物歧化酶、過氧化氫酶和谷胱甘肽過氧化酶等多種抗氧化酶。這些酶組成的抗氧化酶系統,可清除過多的自由基,減少脂質過氧化損傷[37-38]。本實驗循環水系統黃姑魚血清中的超氧化物歧化酶活性在前期顯著升高,可能與黃姑魚受脅迫后,激活了該誘導酶的活性有關。而過氧化氫酶活性與超氧化物歧化酶的變化規律相似。明建華等[39]認為可能與機體的負反饋調節機制有關,后期下降可能是脅迫抑制了該酶的活性。本研究發現,循環水系統中黃姑魚血清的這幾種酶在實驗開始后都顯著上升,隨后都有所回落,特別是總抗氧化能力下降顯著,但仍與開始前具有顯著差異,而網箱中總抗氧化能力活性始終保持在較低的水平。這些抗氧化指標與丙二醛的濃度也相對應。由此推測循環水系統中黃姑魚體內自由基含量始終保持在較高的水平,對抗氧化能力的依賴程度較大。可見上述指標具有一定的預測價值。
3.4 小結
通過研究黃姑魚在兩種養殖模式下的群體生長、免疫及血清生化指標對不同養殖環境的響應及變化規律,表明網箱中的個體優于循環水系統,但循環水系統則具有環境穩定、可控、風險小等優點。
參考文獻:
[1] 雷霽霖.海水魚類養殖理論與技術[M].北京:中國農業出版社,2005.LEI J L.Marine fish culture theory and techniques[M].Beijing:China Agriculture Press,2005.
[2] 朱 峰.大黃魚工廠化循環水養殖技術研究[D].廈門:集美大學.ZHU F.Studies on the techniques for culturing Pseudosciaena crocea in industrial recirculating aquaculture systems [D].Xiamen: Jimei University.
[3] 江國強.大黃魚Larimichthys crocea(Richardson)淺海圍網養殖技術研究[J].現代漁業信息,2011,26(1):3-4.JIANG GQ.A study on enclosure culture techniques for large yellow croaker,Larimichthys crocea(Richardson)in Epeiric Sea[J].Modern Fisheries Informantion,2011,26(1):3-4.
[4] 周飄蘋,金 敏,吳文俊,等.不同養殖模式、投喂不同餌料及不同品系黃魚營養成分比較[J].動物營養學報2014,26(4):969-980 ZHOU PP,JIN M,WU W J,et al.Comparison of nutrient components of large yellow croaker(Pseudosciaena crocea Richardson) cultured in different modes,fed different feeds and from different strains[J].Chinese Journal of Animal Nutrition,2014,26(4):969-980
[5] 薛寶貴,樓 寶,徐冬冬.密度脅迫對黃姑魚幼魚生長、代謝及非特異性免疫的影響[J].漁業科學進展,2013,34(2):45-52.XUE B G,LOU B,XU D D.Impact of density stress on growth,metabolism and non-specific immune functions of juvenile Nibea albiflora[J].Progress in Fishery Sciences,2013,34(2):45-52.
[6] 高露姣,施兆鴻,艾春香.不同脂肪源對施氏鱘幼魚血清生化指標的影響[J].海洋漁業,2005,27(4):319-323.GAO L J,SHI Z H,AI C X.Effect of dietary lipid sources on the serum biochemical indices of Acipenser schrenckii juvenile[J].Marine Fisheries,2005,27(4):319-323.
[7] 李 凌,吳灶和.魚類體液免疫研究進展[J].海洋科學,2001,25(11):20-22.LI L,WU Z H.Development of the humoral immunology in fish[J].Marine Sciences,2001,25(11):20-22.
[8] 艾春香,陳立僑,高露姣,等.Vc對河蟹血清和組織中超氧化物歧化酶及堿性磷酸酶活性的影響[J].臺灣海峽,2002,21(4):431-438.AI C X,CHEN L Q,GAO L J,et al.Effect of vitamin E on SOD,ALP and ACP activities of Chinese mitten-handed crab,Eriocheir sinensis[J].Journal of Oceanography in Taiwan Strait,2002,21(4):431-438.
[9] 初曉紅,濮俊毅,包慧君,等.斑馬魚正常肝臟顯微形態和超微結構的初步觀察[J].實驗動物與比較醫學,2010,30(1):17-23.CHU X H,PU JX,BAOH J,et al.Observation on micro-and ultra-structures of the liver in zebrafish(Brachvdanio rerio)[J].Laboratory Animal and Comparative Medicine,2010,30(1):17-23.
[10] KANAK E G,DOGAN Z,EROGLU A,et al.Effects of fish size on the response of antioxidant systems of Oreochromis niloticus following metal exposures[J].Fish Physiology and Biochemistry,2014,40(4):1083-1091.
[11] VIARENGO A,CANESI L,MARTINEZ P G,et al.Pro-oxidant processes and antioxidant defence systems in the tissues of the Antarctic scallop(Adamussium colbecki) compared with the Mediterranean scallop(Pecten jacobaeus) [J].Comparative Biochemistry and Physiology Part B:Biochemistry and Molecular Biology,1995,111(1):119-126.
[12] 陳海剛,馬勝偉,林 欽,等.氯化三丁基錫對黑鯛鰓和肝組織SOD、MDA和GPx的影響[J].南方水產,2009,5(2):23-27.CHEN H G,MA S W,LIN Q,et al.Effects of tributyltin chloride(TBTCI) on SOD activities,MDA contents and GPx activities in gill and liver of the black porgy(Sparus macrocephalus)[J].South China Fisheries Science,2009,5(2):23-27.
[13] HAN Z Q,GAO T X,YANAGIMOTO T,et al.Genetic population structure of Nibea albiflora in Yellow Sea and East China Sea[J].Fisheries Science,2008,74(3):544-552.
[14] 徐冬冬,詹 煒,樓 寶,等.網箱養殖黃姑魚生長特性初步研究[J]漁業現代化,2010,37(5):43-47.XU D D,ZHAN W,LOU B,et al.Preliminary study on growth characteristics of cage-cultured Nibea albiflora(Richardson)[J].Fishery Modernization,2010,37(5):43-47.
[15] 蔡厚才,林巋璇,陳傳再.南麂海區黃姑魚網箱養殖技術研究[J].浙江海洋學院學報,2001,20(1):66-70.CAI H C,LIN K X,CHEN C Z.Study on cage culture technology of Nibea albiflora(Richardson)in Nanji Sea Area[J].Journal of Zhejiang Ocean University(Natural Science),2001,20(1):66-70.
[16] 吳江泉,黃大宏,陳 威,等.飼養密度對條石鯛生長的影響[J].現代漁業信息,2010,25(3):25-27.WU J Q,HUANG D H,CHEN W,et al.Effect of stocking density on growth of Oplegnathus fasciatus(Temminck et Schlegel)[J].Modern Fisheries Information,2010,25(3):25-27.
[17] BARCELLOSL J G,KREUTZ L C,QUEVEDOR M,et al.Nursery rearing of jundiá,Phamdia quelen(Quoy and Gaimard)in cages;cage type,stocking density and stress response to confinement[J].Aquaculture,2004,232(1-4):383-394.
[18] PAPOUTSOGLOU SE,KARALATSOULIL N,PIZZONIA G,et al.Effects of rearing density on growth,brain neurotranamitters and liver fatty acid composition of juvenile white sea bream Diplodus sargus L.[J].Aquaculture Research,2006,37(1):87-95.
[19] 張 波,唐啟升.密度對黑鲪生長及能量分配模式的影響[J].海洋水產研究,2002,23(2):33-37.ZHANG B,TANG Q S.Influence of fish density on the growth rate and energy budget of Sebastodes fuscescens[J].Marine Fisheries Research,2002,23(2):33-37.
[20] 李 勇,孫國祥,柳 陽,等.溫度對高密度循環海水養殖大菱鲆攝食、生長及消化酶的影響[J].漁業科學進展,2011,32(6):17-24.LI Y, SUN G X, LIU Y, et al.Effects of temperature on feed intake,growth and digestive enzyme activity of turbot Scoph thatmus maximus L.in high stocking density of closed recirculation aquaculture system [J].Progress in Fishery Sciences.2011,32(6):17-24.
[21] ROTLLANT J,PAVLIDIS M,KENTOURIM,et al.Non-specific immune responses in the red porgy Pagrus pagrus after crowding stress[J].Aquaculture,1997,156(3-4):290-297.
[22] 王文博,汪建國,李愛華,等.擁擠脅迫后鯽魚血液皮質醇和溶菌酶水平的變化及對病原的敏感性[J].中國水產科學,2004,11(5):408-412.WANG W B,WANG J G,LI A H,et al.Changes of cortisol and lysozyme levels in Carassius auratus blood after crowding stress and the fish sensitivity to pathogen[J].Journal of Fishery Sciences of China,2004,11(5):408-412.
[23] FEVOLDEN SE,ROED K H.Cortisol and immune characteristics in rainbow trout(Oncorhynch chusmykiss)selected for high or low tolerance to stress[J].Journal of Fish Biology,1993,43(6):919-930.
[24] ELLIS T,NORTH B,SCOTT A P,et al.The relationshios between stocking density and welfare in farmed rainbow trout[J].Journal of Fish Biology,2002,61(3):493-531.
[25] IVERSEN M,FINSTAD B,MCKINLEY R S,et al.Stress responses in Atlantic salmon(Salmo salar L.)smolts during commercial well boat transports,and effects on survival after transfer to sea[J].Aquaculture,2005,243(1-4):373-382.
[26] OLSEN Y A,EINARSDOTTIR I E,NILSSEN K J.Metomidate anaesthesia in Atlantic salmon,Salmo salar,prevents plasma cortisol increase during stress[J].Aquaculture,1995,134(1-2):155-168.
[27] CHATTERJEE N,PAL A K,DAS T.Secondary stress response in Indian major carps Labeo rohita(Hamitton),Catla catla(Hamitton)and Cirrhinus mrigala(Hamitton) fry to increasing packing densiities[J].Aquaculture Research,2006,37(5):472-476.
[28] VIJAYAN M M,LEATHERLANGJF.High stocking density affects cortisol secretion and tissue distribution in brook charr,Salvelinus fontinalis[J].The Journal of endocrinology,1990,124(2):311-318.
[29] URBINATI E C,ABREU JS,DA SILVA CAMARGO A C,et al.Loading and transport stress of juvenile matrinxǎ(Brycon cephalus,Characidae)at various densities[J].Aquaculture,2004,229(1-4):389-400.
[30] VIJAYANM M,LEATHERLAND J F.Effect of stocking density on the growth and stress-response in brook charr,Salvelinus fontinalis original research aricie[J].Aquaculture,1988,75(1-2):159-170.
[31] BARTON B A,PETER R E,PAULENCU C R.Plasma cortisol levels of fingerling rainbow trout(Salmo gairdneri)at rest and subjected to handling confinement,transport,and stocking[J].Canadian Journal of Fisheries and Aquatic Sciences,1980,37(5):805-811.
[32] YIN Z,LAM T J,SIN Y M.The effects of crowding stress on the non-specific immune response in fancy carp(Cyprinus carpio L.)[J].Fish and Shellfish Immunology,1995,5(7):519-529.
[33] ORTUO J,ESTEBAN M A,MESEGUER J.Effects of short-term crowding stress on the gilthead seabream (Sparus aurata L.) innate immune response[J].Fish and Shellfish Immunology,2001,11(2):187-197.
[34] MOMMSEN T P,VIJAYAN M M,MOON T W.Cortisol in teleosts: dynamics, mechanisms of action,and metabolic regulation[J].Reviews in Fish Biology and Fisheries,1999,9(3):211-268.
[35] VIJAYAN M M,PEREIRA C,GRAU E G,et al.Metabolic responses associated with confinement stress in tilapia:the role of cortisol[J].Comparative Biochemistry and Physiology Part C:Toxicology&Pharmacology,1997(116):89-95.
[36] VINAGRE C,MADEIRA D,NARCISOL,et al.Effect of temperature on oxidative stress in fish:Lipid peroxidation and catalase activity in the muscle of juvenile seabass,Dicentrarchus labrax[J].Ecological Indicators,2012,23(11):274-279.
[37] 張晨捷,張艷亮,高權新,等.低鹽脅迫對黃姑魚幼魚肝臟抗氧化功能的影響[J].南方水產科學,2015,11(4):59-64.ZHANG CJ,ZHANGY L,GAO Q X,et al.Effect of low salinity stress on antioxidant function in liver of juvenile Nibea albiflora[J].South China Fisheries Science,2015,11(4):59-64.
[38] SIES H.Oxidative stress:oxidants and antioxidants[J].Experimental Physiology,1997,82(2):291-295.
[39] 明建華,謝 駿,徐 跑,等.大黃素、維生素C及其配伍對團頭魴抗擁擠脅迫的影響[J].水生生物學報,2011,35(3):400-413.MING J H,XIE J,XU P,et al.Effects of emodin,vitamin C and their combination on crowding stress resistance of Wuchang bream [J].Acta Hydrobiologica Sinica,2011,35(3):400-413.

