CYP46A1過表達對阿爾茨海默病轉基因模型小鼠的認知改善和抗炎癥作用
趙敏,孔彥瑩,嚴華成,劉樂斌,蘇建新,周志堅,于德憲,彭秋菊,謝麗
阿爾茨海默病(Alzheimer's disease,AD)是一種以記憶減退和認知功能障礙為特征的中樞神經退行性疾病,其病理學特征包括神經元外大量β-淀粉樣蛋白(β-amyloid protein,Aβ)沉積形成的老年斑、皮質神經元內τ蛋白異常聚集形成的神經原纖維纏結、膠質細胞增生以及腦內炎性浸潤等[1]。該疾病是最常見的一種癡呆類型,發病率隨年齡的增長而增加,但其病因及發病機制目前尚不清楚。
大量研究表明,腦內的膽固醇水平與AD的發病密切相關[2-3]。由于膽固醇不能通過血腦屏障,只有依靠其代謝產物才能保持在腦內的動態平衡[4],因此,膽固醇的主要代謝酶細胞色素P450 46A1(CYP46A1)[5-6]的表達水平及功能狀態直接影響其細胞內水平。此外,病例對照研究發現,不同人種的CYP46A1基因多態性均能顯著增加AD的發病風險[7],如果把CYP46A1的表達阻斷,小鼠腦內會出現更多的Aβ沉積或神經元死亡[8]。以上研究提示,CYP46A1可能在AD的發生發展中發揮重要作用,但CYP46A1對于AD的治療作用目前尚未見文獻報道。本研究以AD轉基因小鼠模型作為研究對象,通過慢病毒體系轉染使小鼠腦內過表達人源CYP46A1基因,檢測其行為學表現、Aβ沉積情況、星形膠質細胞數量、腫瘤壞死因子-α(tumor necrosis factor-α,TNF-α)和白細胞介素-1β(interleukin-1 beta,IL-1β)表達水平等評價指標,研究CYP46A1基因過表達對AD模型小鼠的治療作用。
1 材料與方法
1.1 實驗動物 5XFAD轉基因小鼠(雄性,3月齡,20~25g)由南方醫科大學神經生物學教研室贈予,共表達5種家族性AD基因突變[APP K670N/M6 71L(Swedish)+716V(Florida)+V717I(London)和PS1 M146L+L286V]的APP/PS1雙轉基因小鼠[9]。小鼠飼養于標準的實驗室環境內,溫度23±1℃、白天-黑夜循環(12h:12h)、鼠籠大小300mm×170mm×120mm,自由攝食。
1.2 實驗分組及處理 實驗一:5XFAD轉基因小鼠的功能檢測實驗。分別選取3月齡的5XFAD轉基因小鼠和野生型小鼠各12只,進行Morris水迷宮檢測,實驗結束后,每組隨機挑取3只小鼠進行ELISA檢測,另每組挑取6只小鼠進行免疫組化染色。實驗二:CYP46A1過表達干預實驗。選取3月齡的5XFAD轉基因小鼠24只,其中12只在雙側海馬注入含CYP46A1的慢病毒作為實驗組,另外12只則注射空載體作為對照組,感染2個月后,先進行T迷宮檢測,再進行Morris水迷宮檢測,行為學評價完成后,每組隨機選取6只取腦組織進行免疫組化染色,觀察腦內Aβ的沉積以及星形膠質細胞的表達情況;另外每組隨機挑選3只,通過ELISA法檢測海馬組織中Aβ40、Aβ42、TNF-α以及IL-1β的表達水平。
1.3 主要儀器和試劑 立體定位儀(Stoelting公司),Morris水迷宮(上海吉量軟件科技有限公司);RNAiso plus試劑和RT-PCR檢測試劑盒購自TaKaRa公司;抗CYP46A1抗體購自Proteintech公司;抗Aβ抗體購自Covance公司;抗GFAP 抗體購自Abcam公司;小鼠源性Aβ40ELISA試劑盒(KMB3481)、小鼠源性Aβ42ELISA試劑盒(KMB3411)購自Invitrogen公司;小鼠源性TNF-α ELISA試劑盒(EK0527)和小鼠源性IL-1β ELISA試劑盒(EK0394)購自武漢博士德生物工程有限公司;免疫組化染色試劑盒(SP法)購自中杉金橋公司。
1.4 5XFAD轉基因小鼠的鑒定 剪取出生后1周的待鑒定小鼠組織(按標記部位剪取:尾巴3mm左右,耳朵米粒大小,前肢或后肢取1根腳趾),提取組織DNA,基因鑒定的PCR擴增條件如下:94℃ 2min;94℃ 30s,54℃ 1min,72℃ 1min,共45個循環。引物序列如下:App5為目的片段,上游引物為5'-AATAGAGAACGGCAGGAGCA-3',下游引物為5'-GCCATGAGGGCACTAATCAT-3',基因擴增產物為608bp;對照基因的上游引物為5'-CTAGGCCACAGAATTGAAAGATCT-3',下游引物為5'-GCCATGAGGGCACTAATCAT-3',基因擴增產物為324bp。PCR產物加入1.5%瓊脂糖凝聚電泳進行分析,若只出現324bp位置的條帶,則判定為野生型;若在324bp以及608bp這兩個位置均有條帶,則判定為5XFAD基因攜帶小鼠。圖1A為基因鑒定圖片。
1.5 病毒包裝及處理 常規方法制備CYP46A1過表達的慢病毒,滴度為3×108TU/ml。通過立體定位儀將病毒定位注射到3月齡的雄性5XFAD小鼠雙側海馬組織中(n=12),對照組(n=12)則注射空載體到相應的部位,通過RT-PCR、Western blotting實驗驗證CYP46A1的過表達效果。2個月后,采用T迷宮實驗以及Morris水迷宮評價小鼠的認知狀況,通過免疫組化法觀察腦內Aβ的沉積以及星形膠質細胞的表達情況,通過ELISA法檢測海馬Aβ及炎癥因子的表達水平。
1.6 RT-PCR檢測CYP46A1基因mRNA的表達Trizol法提取海馬總RNA。反轉錄和PCR擴增均按照TaKaRa公司的試劑盒的說明書進行操作,CYP46A1基因引物序列如下:CYP2J2為目的片段,上游引物為5'-AGAAGTATGGTCCTGTTGTA-3',下游引物為5'-ACATTCAGACACCAAGCC-3',基因擴增產物為212bp;18S rRNA作為內參,上游引物為5'-GATCTGGCACCACACCTT-3',下游引物為5'-TACAGGGACAGCACAGCCT-3',基因擴增產物為177bp。PCR擴增條件為:94℃ 1min;94℃ 30s,55℃ 30s,72℃ 1min,35個循環;72℃ 2min,4℃保持。
1.7 ELISA檢測 參照文獻[10]的方法,用10%水合氯醛深度麻醉小鼠,斷頭取腦,快速分離海馬,并加入2ml/g的蛋白裂解緩沖液(137mmol/L NaCl,20mmol/L Tris,1% NP-40,10%甘油,1mmol/L苯甲基磺酰氟,10μg/ml胰蛋白酶抑制劑,0.5mmol/L釩酸鈉)。研磨勻漿,4℃下2500r/min離心15min,收集上清,按照TNF-α(或IL-1β、Aβ40、Aβ42)的ELISA試劑盒操作說明書進行檢測,最后用酶標儀測定450nm處吸光度(OD)值,計算出對應的濃度。
1.8 免疫組織化學染色 參照文獻[10]的方法,用10%水合氯醛深度麻醉小鼠,剪開胸腔暴露心臟,用4%多聚甲醛經主動脈灌注固定后取腦,放入30%蔗糖溶液中24~48h,沉底后行40μm厚冰凍切片,按照標準的SP法步驟行免疫組織化學染色。一抗分別為小鼠源性抗Aβ抗體(SIG-39220-200)和兔源性抗GFAP抗體(ab7260),1:400稀釋;二抗分別為山羊抗小鼠IgG-HRP和Alexa Fluor 488標記的山羊抗兔IgG,1:1000稀釋。Aβ抗體通過DAB染色,在普通顯微鏡下觀察,GFAP抗體直接在熒光顯微鏡下觀察。
1.9 Morris水迷宮檢測 參照文獻[11]的方法,簡述如下:每次訓練分4個步驟進行,每步均從新的入水點放入,入水前令小鼠面向池壁,記錄小鼠從入水到爬上平臺的時間(潛伏期),如果小鼠在90s內未找到平臺,則由實驗者將其引導上平臺,并記作90s,小鼠爬上平臺后休息30s后再進行下一次實驗,取4次訓練成績的算術平均數記為當天的潛伏期時間。經過4d訓練之后,第5天時將平臺撤掉,讓小鼠在水池里游泳90s并記錄其軌跡,分析每只小鼠在平臺所在的象限內游泳時間及路程占總時間和總路程的百分比。為排除感覺、視覺或運動功能障礙對空間學習記憶的影響,實驗結束后,讓平臺位置露出水面2cm,并貼上黃色膠帶,其余操作同隱蔽平臺試驗,即可視平臺試驗(cued test)。
1.10 T迷宮檢測 檢測方法[12-13]簡述如下:首先將小鼠放置在T迷宮的起始臂,讓其自由探索;當小鼠進入其中一側目標臂(以四肢均進入為標準)時,馬上關閉閘門,記錄首次進入的目標臂(左側或右側);關閉25s后,將小鼠放回鼠籠,打開所有閘門;再次將小鼠放入起始臂,讓其自由探索;記錄小鼠第2次所進入的目標臂,然后將其放回鼠籠。如果測試小鼠第2次進入了一個不同的目標臂,計得分正確1次,否則為錯誤。每只小鼠訓練2次/d,連續10d。最后計算各組小鼠在20次訓練中的平均正確率。
1.11 統計學處理 采用SPSS 13.0軟件進行統計分析。Morris水迷宮訓練中的逃避潛伏期以及游泳平均速度進行重復測量數據的方差分析,并使用LSD-t法或Tamhane'sT2法進行兩兩比較。其余數據的比較采用Student'st檢驗。所有實驗結果均采用表示。P<0.05為差異有統計學意義。
2 結 果
2.1 5XFAD轉基因小鼠的鑒定及功能檢測 圖1A為基因鑒定時的示意圖,5XFAD轉基因小鼠在電泳圖中顯示有2條帶,而野生型小鼠則僅1條帶。Morris水迷宮檢測發現,與野生型小鼠相比,3月齡的5XFAD轉基因小鼠在隱蔽平臺訓練中的逃避潛伏期顯著延長(P<0.01,n=12,圖1B),而在可視平臺試驗中的潛伏期并無明顯差異,提示該組小鼠的學習記憶能力明顯下降。行為學檢測結束后,每組各隨機選取3只小鼠取其腦組織進行ELISA檢測,另各取6只小鼠進行大腦切片并行免疫組化染色。結果發現,3月齡的5XFAD轉基因小鼠腦內TNF-α(P<0.001,n=3,圖1C),IL-1β(P<0.01,n=3,圖1C),Aβ(P<0.01,n=6)表達水平以及星形膠質細胞的數量(P<0.01,n=6,圖1D)均比野生型小鼠有顯著上調。
2.2 腦內過表達CYP46A1對5XFAD轉基因小鼠認知障礙的改善作用 RT-PCR和Western blotting檢測結果顯示,過表達人源CYP46A1(pLV-CYP46A1)的5XFAD轉基因小鼠,其海馬組織中CYP46A1 mRNA和蛋白表達水平均明顯高于對照組(圖2A、B)。T迷宮實驗顯示,pLV-CYP46A1組小鼠的平均正確率比對照組顯著增高(P<0.05,圖2C)。Morris水迷宮實驗顯示,pLV-CYP46A1組小鼠在獲得性訓練期間找到平臺的潛伏期比對照組小鼠顯著縮短(P<0.05,圖2D),而兩組小鼠的游泳速度以及可視平臺試驗的潛伏期比較差異均無統計學意義(P>0.05,圖2E);在探查訓練期間,pLV-CYP46A1組小鼠在目標象限的時間和路程占總時間(P<0.05,圖2F)及總路程的百分比(P<0.05,圖2G)均明顯高于對照組,而其穿越的平臺次數雖比對照組有增多的趨勢,但差異無統計學意義(P=0.079,圖2H)。
此外,Aβ免疫組化染色以及斑塊面積統計顯示,pLV-CYP46A1組小鼠海馬區的淀粉樣斑塊面積顯著減少(P<0.01,圖3A、B);ELISA實驗發現,該小鼠海馬區的Aβ40(P<0.05)及Aβ42的表達(P<0.01,圖3D)均明顯下降。

圖1 5XFAD轉基因小鼠的基因鑒定及各項指標檢測Fig. 1 Genetic identification and functional detection of 5XFAD transgenic mice
2.3 過表達CYP46A1對5XFAD轉基因小鼠腦內星形膠質細胞數量及炎癥浸潤的影響 免疫組化染色發現,pLV-CYP46A1組小鼠海馬區域的星形膠質細胞數量比對照組相應部位顯著減少(P<0.05,圖3A,C);ELISA實驗發現,pLV-CYP46A1組小鼠海馬區域的IL-1β和TNF-α表達水平也比對照組顯著下降(P<0.05,圖3E)。
3 討 論
AD病情呈進行性發展,但由于其病因及發病機制尚不清楚,因而尚無特效的治療藥物或方法,患者通常在確診的3~9年死亡,是本世紀危害人類健康的最嚴重疾病之一。
大腦是體內膽固醇含量最高的組織,其膽固醇占機體總量的23%,而腦重量只占體重的2.1%。此外,膽固醇為合成神經細胞膜所必需,在髓鞘內含量很高,并形成脂質筏,后者是裝配β和γ分泌酶,以及將淀粉樣前體蛋白(amyloid precursor protein,APP)加工為Aβ的平臺[14]。當酯化膽固醇過多時,膜脂轉運減少,可致Aβ生成和聚集增多而清除減少,導致AD發生。在腦內,CYP46A1是膽固醇代謝的主要酶[5-6],由于膽固醇不能通過血腦屏障,它只能依靠CYP46A1將其代謝為24s-羥基膽甾醇,然后再由后者透過血腦屏障來保持其在腦內的動態平衡[4]。在正常大腦中,CYP46A1主要表達在額葉皮質的椎體神經元上,而在AD患者中,此區域的神經元大量丟失或萎縮,推測血漿24s-羥基膽甾醇的減少很有可能是由于此處含CYP46A1神經元的死亡造成的[15]。
此外,AD的發生發展通常伴隨著星形膠質細胞的激活以及慢性炎癥反應,前者表現為星形膠質細胞數量增加、體積增大以及能動性增強,而后者則是神經元死亡的重要原因[16]。研究發現,在AD患者大腦的皮質和皮質下結構,存在著廣泛的星形膠質細胞激活[17],而激活的星形膠質細胞能夠分泌多種炎癥因子,包括IL、TNF、干擾素(interferons,IFN)、一氧化氮(nitric oxide,NO)等,它們大部分(如IL-1β、IL-6、TNF-α等)對神經細胞具有毒性作用,進而可引起神經細胞的凋亡或壞死[19-20]。
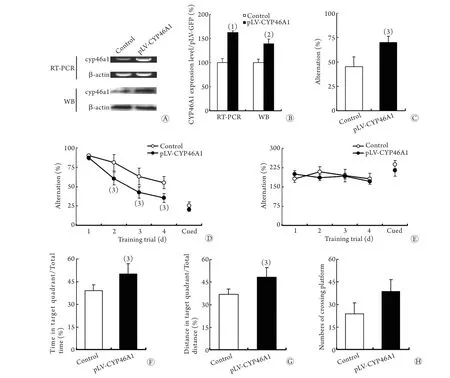
圖2 腦組織過表達CYP46A1對5XFAD轉基因小鼠認知障礙的改善作用Fig. 2 Overexpression of CYP46A1 in brain tissue improved the cognitive impairment in 5XFAD transgenic mice
本研究采用5XFAD轉基因小鼠作為AD模型小鼠,該小鼠攜帶3個APP 突變基因和2個PS1突變基因[9]。本研究結果顯示,3月齡的5XFAD轉基因小鼠即出現學習記憶能力下降、腦內老年斑塊、膠質細胞增生以及IL-1β和TNF-α等炎癥因子表達升高(圖1B–D),提示該轉基因小鼠與AD具有相似的功能學及病理變化特征。此外,本研究還發現,過表達人源CYP46A1后,5XFAD轉基因小鼠的認知障礙得到顯著改善(圖2),其海馬區域的Aβ斑塊面積及星形膠質細胞數量顯著減少(圖3A–C),同時,Aβ40、Aβ42、IL-1β和TNF-α的表達水平也均出現顯著下降(圖3D,E),提示CYP46A1在AD的發生發展過程中具有重要作用,其機制可能與減少Aβ沉積、降低腦內炎癥反應水平有關。本研究的結果與國內外在CYP46A1基因多態性增加AD的發病風險[7]以及阻斷CYP46A1的表達可加重AD的相關癥狀[8]等研究結果一致,并進一步證實了CYP46A1對于AD的治療價值。本研究結果為揭示AD的發生機制奠定了基礎,并為AD的預防和治療提供了理論基礎和新的靶點。
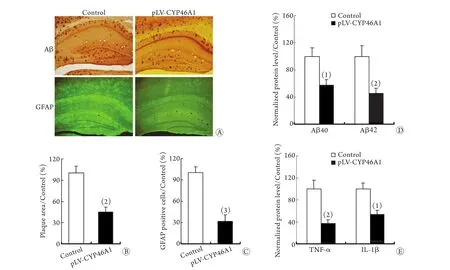
圖3 過表達CYP46A1對5XFAD轉基因小鼠腦內Aβ沉積及炎癥浸潤的影響Fig. 3 Overexpression of CYP46A1 ameliorated the Aβ deposition and inflammatory infiltration in 5XFAD transgenic mice
【參考文獻】
[1]Minter MR, Taylor JM, Crack PJ. The contribution of neuroinflammation to amyloid toxicity in Alzheimer's disease[J].J Neurochem, 2016, 136(3): 457-474.
[2]Allinquant B, Clamagirand C, Potier MC. Role of cholesterol metabolism in the pathogenesis of Alzheimer's disease[J]. Curr Opin Clin Nutr, 2014, 17(4): 319-323.
[3]Maulik M, Westaway D, Jhamandas JH,et al. Role of cholesterol in APP metabolism and its significance in Alzheimer's disease pathogenesis[J]. Mol Neurobiol, 2013, 47(1): 37-63.
[4]Papassotiropoulos A, Lutjohann D, Bagli M,et al. Plasma 24S-hydroxycholesterol: a peripheral indicator of neuronal degeneration and potential state marker for Alzheimer's disease[J]. Neuroreport, 2000, 11(9): 1959-1962.
[5]Mast N, Charvet C, Pikuleva IA,et al. Structural basis of drug binding to CYP46A1, an enzyme that controls cholesterol turnover in the brain[J]. J Biol Chem, 2010, 285(41): 31783-31795.
[6]Russell DW, Halford RW, Ramirez DM,et al. Cholesterol 24-hydroxylase: an enzyme of cholesterol turnover in the brain[J]. Annu Rev Biochem, 2009, 78: 1017-1040.
[7]Garcia AN, Muniz MT, Souza e Silva HR,et al. Cyp46 polymorphisms in Alzheimer's disease: a review[J]. J Mol Neurosci, 2009, 39(3): 342-345.
[8]Djelti F, Braudeau J, Hudry E,et al. CYP46A1 inhibition, brain cholesterol accumulation and neurodegeneration pave the way for Alzheimer's disease[J]. Brain, 2015, 138(Pt 8): 2383-2398.
[9]Oakley H, Cole SL, Logan S,et al. Intra-neuronal beta-amyloid aggregates, neurodegeneration, and neuron loss in transgenic mice with five familial Alzheimer's disease mutations: potential factors in amyloid plaque formation[J]. J Mol Neurosci, 2006,26(40): 10129-10140.
[10]Yan HC, Qu HD, Sun LR,et al. Fuzi polysaccharide-1 produces antidepressant-like effects in mice[J]. Int J Neuropsychopharmacol, 2010, 13(5): 623-633.
[11]Vorhees CV, Williams MT. Morris water maze: procedures for assessing spatial and related forms of learning and memory[J].Nat Protoc, 2006, 1(2): 848-858.
[12]Deacon RM, Rawlins JN. T-maze alternation in the rodent[J].Nat Protoc, 2006, 1(1): 7-12.
[13]Senior SL, Ninkina N, Deacon R,et al. Increased striatal dopamine release and hyperdopaminergic-like behaviour in mice lacking both alpha-synuclein and gamma-synuclein[J]. Eur J Neurosci, 2008, 27(4): 947-957.
[14]Ehehalt R, Keller P, Haass C,et al. Amyloidogenic processing of the Alzheimer beta-amyloid precursor protein depends on lipid rafts[J]. J Cell Biol, 2003, 160(1): 113-123.
[15]Dutheil F, Beaune P, Loriot MA. Xenobiotic metabolizing enzymes in the central nervous system: Contribution of cytochrome P450 enzymes in normal and pathological human brain[J]. Biochimie, 2008, 90(3): 426-436.
[16]Zhu L, Jie X, Liu AT,et al. Response of NG2 positive cells and other glial cells in the microenvironment of facial nucleus after facial nerve axotomy[J]. Med J Chin PLA, 2017, 42(3): 196-201. [朱鴷, 結祥, 劉安堂, 等. 面神經離斷傷后核團微環境中NG2陽性細胞及各類膠質細胞的反應[J]. 解放軍醫學雜志,2017, 42(3): 196-201.]
[17]Holmes C. Review: systemic inflammation and Alzheimer's disease[J]. Neuropath Appl Neuro, 2013, 39(1):51-68.
[18]Carter SF, Scholl M, Almkvist O,et al. Evidence for astrocytosis in prodromal Alzheimer disease provided by11C-deuterium-L-deprenyl: a multitracer PET paradigm combining 11C-Pittsburgh compound B and 18F-FDG[J]. J Nucl Med, 2012, 53(1): 37-46.
[19]Medeiros R, LaFerla FM. Astrocytes: conductors of the Alzheimer' disease neuroinflammatory symphony[J]. Exp Neurol, 2013, 239: 133-138.
[20]Liu JJ, Cao N, Di JL,et al. Role of bone marrow mesenchymal stem ceils in repair of neural cell injury induced by okadaic acid[J]. Med J Chin PLA, 2017, 42(5): 377-382. [劉嘉婧, 曹寧,翟晶磊, 等. 骨髓間充質干細胞對岡田酸致神經細胞損傷的修復作用[J]. 解放軍醫學雜志, 2017, 42(5): 377-382.]

