miRNA-146a和Toll樣受體2對幼鼠細菌性腦膜炎的影響
王艷萍,華 穎,徐曉華,王健彪
(江蘇省無錫市兒童醫(yī)院兒神經(jīng)內(nèi)科 214023)
細菌性腦膜炎是常見的中樞神經(jīng)系統(tǒng)感染性疾病,其中常見病原菌為肺炎鏈球菌(streptococcus pneumoniae,SP)[1]。Toll樣受體2(Toll-like receptor 2,TLR2)是革蘭陽性菌的天然模式識別受體,介導(dǎo)宿主對SP等革蘭陽性菌的免疫炎性反應(yīng)[2]。微小RNA146a(miRNA-146a)是第1個被發(fā)現(xiàn)于免疫系統(tǒng)中的具有調(diào)節(jié)作用的miRNA[3],其下游基因參與炎癥免疫的發(fā)生與發(fā)展。研究表明miRNA-146a參與了細菌性腦膜炎的發(fā)病機制[4],很有可能成為治療細菌性腦膜炎的最新靶點。本實驗以SP性腦膜炎為模型,探討miRNA-146a、TLR2及其信號通路在細菌性腦膜炎免疫病理機制中的作用。
1 材料與方法
1.1材料 SPF級健康雄性3周齡C57BL/6小鼠24只,南京醫(yī)科大學(xué)實驗動物中心提供[許可證號:SCXK(蘇)2015-0005],飼養(yǎng)于實驗動物中心,室溫(22±2)℃,光照時間8:00~20:00,自由飲水進食。實驗過程中對動物的處置遵照科技部發(fā)布的《關(guān)于善待實驗動物的指導(dǎo)性意見》規(guī)定。
1.2方法
1.2.1SP混懸液和模型制備 將SPⅢ型菌株(31003-16,購自北京中國藥品生物制品鑒定所),接種于血瓊脂糖培養(yǎng)基,于37 ℃ 50 mL/L CO2環(huán)境中生長過夜后,接種于腦心浸液,置于37 ℃恒溫?fù)u床(250 r/min)孵育過夜,生長至對數(shù)生長中期收菌,用生理鹽水沖洗離心(3 000 r/min)2次,再進行倍比稀釋,制成細菌混懸液(1010/L)。采用側(cè)腦室注射法制備腦膜炎小鼠模型[5]:水合氯醛0.15~0.20 mL/100 g體質(zhì)量腹腔麻醉后,固定于立體定位儀(AP:-0.2~0.5 mm,L:1.0 mm,H:2.5~3.0 mm)。在充分麻醉動物后,按以上方法向側(cè)腦室內(nèi)注射滂安天藍溶液30 μL,頸椎脫臼法處死動物后進行解剖,見藍色擴散于顱底、小腦延髓池、雙側(cè)側(cè)腦室、脊髓腔等結(jié)構(gòu)為定位準(zhǔn)確。
1.2.2實驗分組與標(biāo)本收集 小鼠分為3組:對照組、Pam3CSK4預(yù)處理組(Pam3CSK4購自美國InvivoGen公司)和模型組。對照組不進行任何干預(yù),Pam3CSK4預(yù)處理組腹腔注射Pam3CSK4,每只100 μg。24 h后Pam3CSK4預(yù)處理組和模型組進行側(cè)腦室注射細菌混懸液。標(biāo)本收集:接種24 h后各組動物多聚甲醛麻醉后,采用眼球采血法收集血液標(biāo)本,然后快速斷頭,在冰上取腦組織,立即放置液氮冷凍,隨后移入-80 ℃冰箱保存?zhèn)溆谩z測前將腦組織進行液氮研磨,勻漿,10 000 r/min離心20 min,取上清液備測。血清3 500 r/min 離心20 min后取上清液備測。
1.2.3酶聯(lián)免疫吸附法(ELISA)法檢測 采用ELISA法檢測外周血清腫瘤壞死因子-α(TNF-α),白細胞介素-6(IL-6)、單核細胞趨化蛋白-1(MCP-1)水平,操作步驟按照試劑盒說明書,試劑盒購自南京建成生物工程研究所。
1.2.4熒光實時定量PCR(QRT-PCR)檢測 應(yīng)用Trizol提取RNA,并采用紫外分光光度計測其吸光度(OD)值大于1.8。按試劑盒說明書操作進行反轉(zhuǎn)錄合成cDNA,隨后進行QRT-PCR擴增。TLR2:上游5′-AAACTGTGTTCGTGCTTTCTGA-3′,下游5′-CTTTCTTCTCAATGGGTTCCAG-3′,擴增產(chǎn)物170 bp;髓樣分化因子88(MyD88):上游5′-ATAGGCAACCAGCAGAAACAG-3′,下游5′-TATCATTGGGGCAGTAGCAGA-3′,擴增產(chǎn)物181 bp,腫瘤壞死因子受體相關(guān)因子-6(TRAF-6):上游5′-AGCCACAATCCCATG-3′,下游5′-GTCACGGAAAGGCGC-3′,擴增產(chǎn)物194 bp;核因子kappa(NF-κB):上游5′-GATTTCGTTTCCGTTATGT-3′,下游5′-TTTGCTGGTCCCACATAG-3′,擴增產(chǎn)物125 bp;GAGAPDH:上游5′-CCACCCATGGCAAATTCC-3′,下游5′-TGGGATTTCCATTGATGACAAG-3′,擴增產(chǎn)物167 bp。miRNA-146a上游引物序列為:5′-GCTGAGAACTGAATTCCATGGGT-3′,下游引物為試劑盒提供的通用引物,擴增產(chǎn)物76 bp,內(nèi)參為U6,由試劑盒一起提供;引物設(shè)計與合成由上海生物工程公司完成。實驗數(shù)據(jù)采用2-△△CT法進行分析。
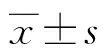
2 結(jié) 果
2.1各組血清TNF-α、IL-6和MCP-1水平變化 與對照組比較,在注射SP 24 h后模型組小鼠血TNF-α、IL-6和MCP-1水平明顯增高(P<0.01);與模型組比較,Pam3CSK4預(yù)處理組TNF-α、IL-6和MCP-1明顯下降(P<0.01),見表1。
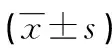
表1 各組TNF-α、IL-6和MCP-1水平變化
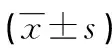
表2 各組TLR2、MyD88、TRAF-6、NK-κB和miRNA-146a mRNA表達比較
2.2腦組織TLR2、MyD88、TRAF-6、NK-κB和miRNA-146a mRNA表達 與對照組比較,在注射SP 24 h后模型組小鼠腦組織的TLR2、MyD88、TRAF-6、NK-κB和miRNA-146a mRNA表達明顯增高(P<0.01),與模型組比較,則Pam3CSK4預(yù)處理組腦組織的TLR2、MyD88、TRAF-6、NK-κB和miRNA-146a mRNA表達水平明顯下降(P<0.01),見表2。
3 討 論
細菌性腦膜炎是兒童中常見的中樞神經(jīng)系統(tǒng)急性感染病,幸存患兒常出現(xiàn)神經(jīng)系統(tǒng)后遺癥,包括認(rèn)知障礙、聽力喪失、視力受損和腦積水等,早期診斷和治療,減輕腦膜炎性反應(yīng),對于改善預(yù)后具有重要意義[6]。SP是細菌性腦膜炎的常見致病菌之一,本研究發(fā)現(xiàn),模型組小鼠血清TNF-α、IL-6和MCP-1水平明顯增高,腦組織的TLR2、MyD88、TRAF-6、NK-κB mRNA表達也明顯增多,采用TLR2受體拮抗劑Pam3CSK4預(yù)處理后,Pam3CSK4預(yù)處理組各項指標(biāo)明顯下降,提示TLR2受體及信號通路在細菌性腦膜炎的病理機制中發(fā)揮關(guān)鍵作用。Pam3CSK4預(yù)處理后,miRNA-146a的mRNA表達水平也明顯下調(diào),提示miRNA-146a參與TLR2受體及信號通路的調(diào)節(jié)。
TLRs是天然免疫應(yīng)答的病原分子識別受體[7],能夠識別病原體,介導(dǎo)信號傳導(dǎo)途徑,啟動機體的天然免疫反應(yīng),誘導(dǎo)宿主防御功能相關(guān)功能活化,包括促炎性細胞因子,抗炎性細胞因子等,從而清除病原微生物。其中TLR2是TLRs中分布最廣泛的受體[8-9],廣泛分布于機體免疫系統(tǒng)的防御第一線,在肺部、心臟、大腦等組織中均有表達,具有廣泛的致病微生物識別譜,可識別革蘭陽性菌、革蘭陰性菌、螺旋菌、霉菌、真菌,甚至能識別原生動物和病毒。有學(xué)者研究結(jié)果表明,TLRs在兒童感染性、腦膜炎的免疫反應(yīng)中具有重要意義[10-11],TLR2可隨著CRP水平增加而升高,有望成為兒童感染性疾病的診斷指標(biāo)之一。
TLR2分為胞內(nèi)域、跨膜域和胞外域,其中胞外域包含亮氨酸富集重復(fù)序列(leucine-rich repeats,LRRs),主要用于識別PAMPs;胞內(nèi)域為Toll/IL-1受體(Toll/IL-1 receptor,TIR)結(jié)構(gòu)域,主要用來激活下游信號通路。MyD88是TLR2信號通路的關(guān)鍵分子[12],MyD88與TIR結(jié)構(gòu)形成蛋白復(fù)合體后,其死亡結(jié)構(gòu)域募集下游的IL-1受體相關(guān)激酶(interleukin-1 receptor associated kinase,IRAK)、TRAF-6等信號分子,促使NK-κB活化,激活NF-κB轉(zhuǎn)錄依賴途徑,繼而促進多種促炎性分子基因的轉(zhuǎn)錄,如TNF-α、IL-6和MCP-1等,通過炎性反應(yīng)清除病原體感染,從而提高患兒生存率,減少不良反應(yīng)。
miRNA-146a是一種與炎癥密切相關(guān)的miRNA,在T淋巴細胞、單核細胞和巨噬細胞等多種免疫和炎癥細胞中高表達。研究表明,miRNA-146a基因的啟動子序列中含有多個NF-κB結(jié)合位點[13]。IL-1和TNF-α等多種免疫和炎癥相關(guān)因子可以通過NF-κB依賴的方式促進miRNA-146a的表達,但是相關(guān)的結(jié)合位點及結(jié)合時間點仍不清楚,有待進一步研究。TRAFs和IRAK是TLRs的下游調(diào)節(jié)因子,在介導(dǎo)細胞因子和TLR受體誘導(dǎo)的NF-κB活化和炎癥過程中發(fā)揮重要作用,而TRAF6和IRAK1均為miRNA-146a的靶基因[14],研究表明,過表達miRNA-146a可下調(diào)二者的蛋白表達,從而降低NF-κB的活性,因此,miRNA-146a可通過調(diào)控TRAF6和IRAK1,作用于TLR及其NF-κB信號通路,形成負(fù)反饋調(diào)節(jié)環(huán)路,調(diào)控炎癥與免疫反應(yīng)。miRNA-146a和Toll樣受體2信號通路的研究工作為兒童化膿性腦膜炎的診斷和治療提供了新思路,目前miRNA-146a在兒童化膿性腦膜炎的臨床研究少見報道,仍需進一步完善相關(guān)研究以指導(dǎo)臨床工作。
[1]王藝,王傳清,王曉紅.細菌性腦膜炎266例病原學(xué)與耐藥性分析[J].實用兒科臨床雜志,2006,21(6):355-356,366.
[2]REYNOLDS J M,DONG C.Toll-like receptor regulation of effector T lymphocyte function[J].Trends Immunol,2013,34(10):511-519.
[3]LUO X,HAN M,LIU J,et al.Epithelial cell-derived micro RNA-146a generates interleukin-10-producing monocytes to inhibit nasal allergy[J].Sci Rep,2015(5):15937.
[4]OMRAN A,PENG J,ZHENG C,et al.The expression of interleukin-1b and miRNA-146a in the cerebral cortex of acute escherichia Coli meningitis immature rat model[J].Afr J Infect Dis,2012,6(2):41-47.
[5]SHAPIRO M A,DONOVAN K D,GAGE J W.Comparative therapeutic efficacy of clinafloxacin in a pneumococcal meningitis mouse model[J].J Antimicrob Chemother,2000,45(4):489-492.
[6]YANG Y,LENG Z,SHEN X,et al,Acute bacterial meningitis in children in Hefei,China 1990-1992[J].Chin Med J(Engl),1996,109(5):385-388.
[7]SUGIYAMA K,MUROI M,KINOSHITA M,et al.NF-κB activation via MyD88-dependent Toll-like receptor signaling is inhibited by trichothecene mycotoxin deoxynivalenol[J].J Toxicol Sci,2016,41(2):273-279.
[8]YI M,KOHANAWA M,ZHAO S,et al.Contribution of toll-like receptor 2 to the innate response against staphylococcus aureus infection in mice[J].PLoS One,2013,8(9):e74287.
[9]NANDI A,DEY S,BISWAS J,et al.Differential induction of inflammatory cytokines and reactive Oxygen species in murine peritoneal macrophages and resident fresh bone marrow cells by acute staphylococcus aureus infection:contribution of toll-like receptor 2 (TLR2)[J].Inflammation,2015,38(1):224-244.
[10]KENZEL S,HENNEKE P.The innate immune system and its relevance to neonatal sepsis[J].Curr Opin Infect Dis,2006,19(3):264-270.
[11]VIEMANN D,DUBBEL G,SCHLEIFENBAUM S,et al.Expression of toll-like receptors in neonatal sepsis[J].Pediatr Res,2005,58(4):654-659.
[12]詹雪靈,高杰,吳補領(lǐng).Toll樣受體2和4信號通路在炎癥治療中的作用和意義[J].國際口腔醫(yī)學(xué)雜志,2014,41(3):304-308.
[13]LUKIW W J.NF-κB-regulated micro RNAs (miRNAs) in primary human brain cells[J].Exp Neurol,2012,235(2):484-490.
[14]HUNG P S,LIU C J,CHOU C S,et al.miR-146a enhances the oncogenicity of oral carcinoma by concomitant targeting of the IRAK1,TRAF6 and NUMB genes[J].PLoS One,2013,8(11):e79926.

