基于香豆素衍生物的反應型硫化氫熒光探針的合成與應用
侯鵬 董玉晶 劉磊 夏春輝 李爽
摘要:該文基于光誘導電子轉移(PET)機制,利用H2S誘導探針分子結構中的2,4-二硝基苯醚水解,抑制PET過程,合成一種反應型H2S熒光探針。利用NMR和MS對探針1的結構進行表征。通過光譜學測試和生物學細胞實驗證實,相對于其他測試物質(陰、陽離子及生物分子),它對H2S具有良好的選擇性和靈敏度,可以在生理條件下檢測H2S。當H2S加入到探針溶液后,溶液呈現出綠色熒光,在490nm熒光強度恢復75倍,當探針的濃度為10.0μmol/L時,其對H2S的檢測限為3.0×10-8mol/L;同時,探針成功實現細胞內H2S的熒光成像,為其在生物學及醫學中的實際應用奠定實驗基礎。
關鍵詞:硫化氫:香豆素;熒光檢測;探針
文獻標志碼:A
文章編號:1674-5124(2018)02-0056-06
0引言
硫化氫(H2S)作為生物體內重要的活性硫物種,在許多生理過程中發揮著重要的作用,如血管生成、神經調節、細胞凋亡等。研究表明,H2S已成為繼一氧化氮和一氧化碳后第3個重要的生物信號分子,一些疾病包括老年癡呆、唐氏綜合癥、糖尿病以及肝硬化都會造成H2S含量的改變,生物體內內源性硫化氫在正常生理人血清中含量為30-100μmol/L,人腦中的含量高達160μmol/L;因此,有效監測H2S水平,可為疾病的早期診斷提供監察手段,定性及定量檢測生物信號分子已經成為一個活躍和富有成果的研究領域。
目前,已報導的檢測H2S方法包括電化學法、比色法、氣相色譜法等。其中,熒光檢測通過實現對生物客體中重要物種(離子、分子、DNA、蛋白質和細胞器等)分布和變化的實時檢測,揭示生物學功能,已經成為了醫學診斷和生物學研究中最有效的分析手段之一。熒光探針因廉價易得,具有細胞膜穿透性,合成技術可控,分子量小不容易干擾周圍蛋白等生理環境,所以應用的領域最為廣泛。為了闡明H2S水平對健康和疾病狀態的影響,通過熒光方法在生物樣品中選擇性地跟蹤H2S具有重要的意義。
本文設計的H2S熒光探針1,以2,4-二硝基苯基為識別基團,香豆素類染料為信號表達基團。在熒光探針1中,由于熒光團與2,4-二硝基苯基之間的光誘導電子轉移(PET)過程,導致探針1的熒光被淬滅,所以探針1本身無熒光或發射出很弱的熒光。當加入待測物H2S后,由于硫化氫具有較強的親核性,能與探針1發生親核取代反應從而使識別基團2,4-二硝基苯基離去,體系內PET過程失效;同時,生成具有強烈綠色熒光的香豆素類染料3。通過反應前后熒光光譜的變化,可以建立一種檢測硫化氫的分析方法。具體響應過程如圖1所示,該過程為一種熒光增強型硫化氫熒光探針。
1實驗部分
1.1儀器與試劑
Bruker AV400光譜儀(400mHz)和Bruker ultraflex II基質輔助時間飛行質譜(美國Bruker);LS45-熒光分光光度計(美國Perkin);UV2450型紫外-可見分光光度計(日本島津)。
4-二乙胺基水楊醛,瑪雅試劑公司;2,4-二硝基氟苯,安耐吉試劑有限公司;碳酸鉀,天津市福晨化學試劑廠;二氯甲烷,天津市東麗區天大化學試劑廠;丙二腈,純度99%,安耐吉試劑有限公司;三乙胺,二甲基亞砜,十六烷基三甲基溴化銨,上海國藥試劑有限公司;碳酸鈉,氟化鈉,氯化鈉,溴化鈉,碘化鈉,磷酸二氫鈉,硝酸鈉,醋酸鈉,碳酸氫鈉,硫酸鈉,亞硫酸鈉,次氯酸鈉,氯化鈣,氯化銅,氯化鎂,氯化鋅,硫氫化鈉(HzS的來源),半胱氨酸,谷胱甘肽均購置于上海國藥試劑有限公司。
1.2熒光探針1的合成
將4-二乙胺基水楊醛193mg(1mmol),2,4-二硝基氟苯220mg(1.2mmol)和碳酸鉀170mg(1.2mmol),溶解在15mL乙腈溶液中。將反應液升溫至85℃反應8h,反應結束后,降至室溫,倒入100mL水中,用50mL二氯甲烷萃取,飽和氯化鈉洗滌,有機層用無水硫酸鈉干燥。40℃旋去溶劑,得到淡黃色液體為化合物2。將化合物2溶于15mL二氯甲烷溶液中,向反應液中加入丙二腈51mg(0.78mmol),三乙胺2滴,室溫攪拌5h,反應結束后,用35mL二氯甲烷萃取,無水硫酸鈉干燥,粗產物進行柱層析分離(石油醚:乙酸乙酯=2:1,填料硅膠),得到淡黃色固體即為熒光探針1(收率:67%)。1HnMR(400MHz,DMSO)δ8.92(d,J=2.6Hz,1H),8.47(dd,J=9.3,2.7Hz,1H),8.27(d,J=9.4Hz,1H),8.04(s,1H),7.24(d,J=9.3Hz,1h),6.96(d,J=9.5hz,1h),6.60(s,1h),3.52~3.42(m,4H),1.10(t,J=7.1hz,6H)。HRMS(EI)m/zcalcdfor[C20H17N5O5+H]+:408.1239,Found:408.1241。
1.3光譜性質測試
探針母液的配制:將適量探針溶解于少量的二甲基亞砜(DMSO)中,然后用含有3×10-3mol/L十六烷基三甲基溴化銨(CTAB)的PBS緩沖液配制成1.0×10-3mol/L的溶液,4℃冷藏備用。
被分析物質溶液的配制:將被分析物質Na2CO3、NaF,NaCl,NaBr,NaI,NaH2PO4,NaNO3,NaOAc,NaHCO3、Na2SO4,Na2SO3、NaCIO、Cys、GSH、CaCl2,CuCl2,MgCl2、ZnCl2、NaHS分別經二次水溶解,配制成1×10-2mol/L的溶液,4℃冷藏備用。
測試溶液的配制及熒光測試參數的設定:將0.03mL探針母液移取至含有3×10-3mol/LcTAB的PBS緩沖液的試管中,隨后加入被分析物,定容至3.0mL,混合均勻,靜置15min,進行光譜測試。激發光和發射光的狹縫寬度均為5.0nm,電壓為700V。
1.4細胞培養及探針分子的熒光成像
將A549細胞(腺癌人類肺泡基底上皮細胞)置于10%胎牛血清和1%雙抗的細胞培養基中,37℃和5%CO2的條件下孵育,實驗前,將狀態良好的細胞消化,接種至激光共聚焦的細胞培養皿內,37℃和5%CO2的條件下繼續孵育12h,至細胞貼壁,進行探針分子在細胞內的熒光成像實驗。第1組實驗:細胞經緩沖溶液PBS反復漂洗后,向盛放細胞的培養皿中加入5.0μmol/L探針溶液,帶細胞孵育30min后,用PBS緩沖液反復漂洗細胞,進行熒光成像實驗。第2組實驗:細胞經緩沖溶液PBS反復漂洗后,向盛放細胞的培養皿中加入30.0μmol/Lh2S溶液,帶細胞孵育30min后,用PBS緩沖液反復漂洗細胞,繼續向盛放細胞的培養皿中加入5.0μmol/L探針溶液,帶細胞孵育30min后,用PBS緩沖液反復漂洗細胞,進行熒光成像實驗。
2結果與分析
2.1熒光光譜研究
探針在pH7.4、含1.5mmol/LcTAB的50.0mmol/LPBS緩沖溶液中對H2S的響應情況如圖2所示。基于光誘導電子轉移機制,探針分子結構中的羥基被2,4-二硝基苯基保護,導致探針分子的熒光淬滅,因此單獨的探針分子溶解在緩沖溶液中未呈現出熒光發射峰;然而,當加入H2S后,H2S將進攻探針分子結構中的酯鍵,釋放出具有強烈熒光的香豆素染料3,此時PET機制受阻,溶液呈現出綠色熒光,隨著滴加H2S濃度的增大(0,1,2,3,4,5,6,7,8,9,10,20,30,40,50,60,70μmol/L),探針溶液在490nm處呈現的熒光發射峰強度逐漸增強。當加入H2S的濃度為70μmol/L,此時探針溶液在490nm處的熒光強度可以恢復(F/F0)75倍(F:探針分子與H2S作用后的熒光強度,F0:探針分子的熒光強度)。從探針溶液在490nm處熒光發射峰的熒光強度與H2S濃度關系(圖3)中可以看出,在0~7.0μmol/L之間,熒光強度與H2S濃度具有很好的線性關系,擬合后得到方程為y=9.2617+11.350x,線性相關系數為0.9987。根據IUPAC規定,信噪比S/N=3可以計算出探針分子1(10μmol/L)對H2S的檢測限為3.0×10-8mol/L。由此表明文中制得的探針能夠在水溶液中定性和定量檢測H2S。對比探針溶液加入H2S前后的顏色變化,在紫外燈照射下,探針溶液顏色由無色變為綠色。
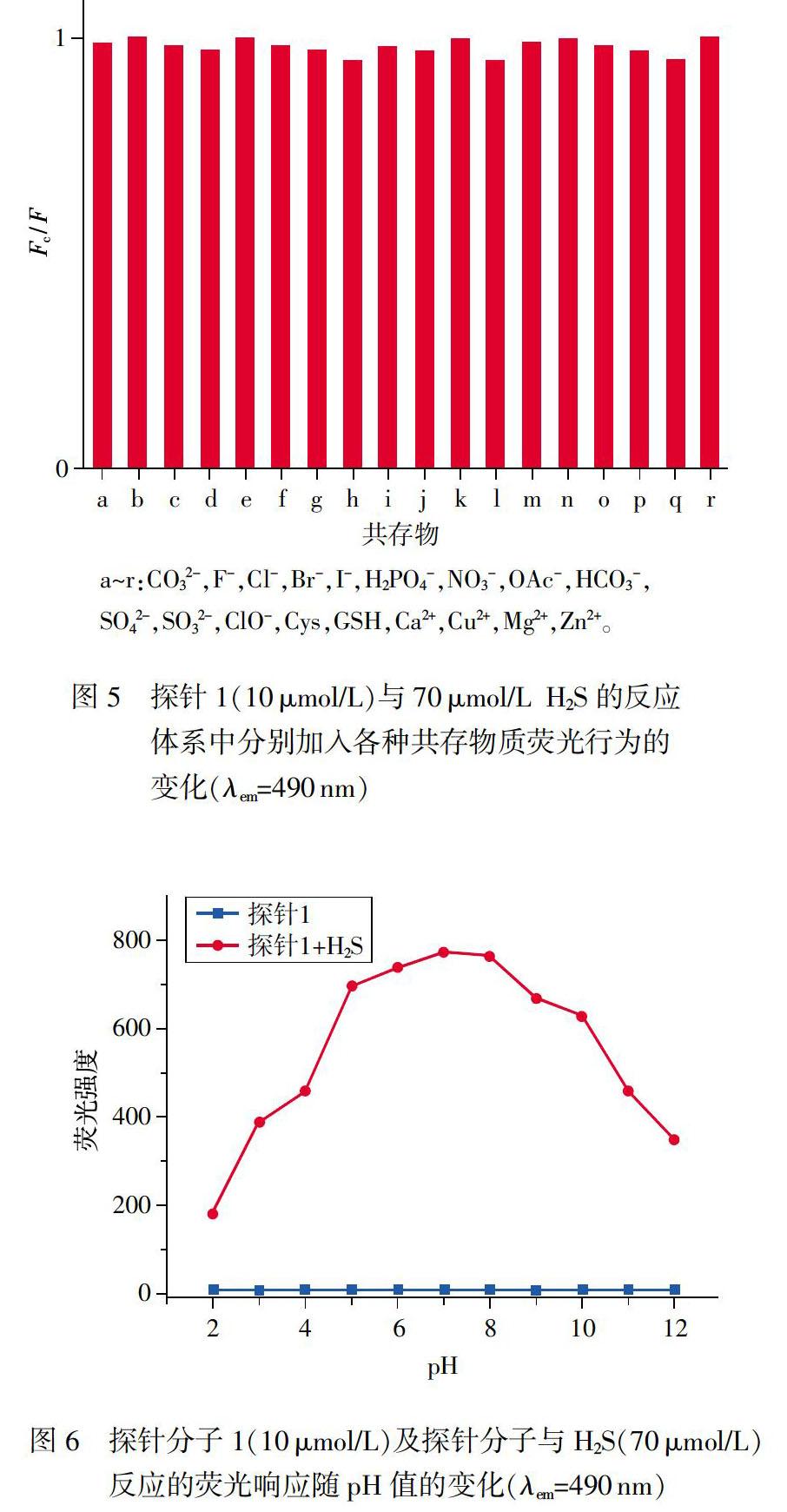
2.2選擇性和干擾實驗
為了證明文中制備的探針分子對復雜檢測環境中H2S的識別能力具有專一性,實驗中對探針的選擇性及抵抗其他物質干擾的能力進行了詳細研究。實驗中將生物環境中18種常見的陰、陽離子及生物分子和s2-分別加入到探針的溶液中,充分反應后,檢測光譜變化。如圖4所示,向探針1的溶液中分別加入等量的上述陰、陽離子及生物分子后,光譜行為顯示加入H2S的探針溶液的熒光強度顯著增強,溶液發出強烈的綠色熒光:而其他測試物質分別加入到探針溶液中,均沒有引起探針溶液熒光的顯著增強。同時,實驗中分別將CO32-,F-,Cl-,Br-,I-,H2PO4-,NO3-,OAc-,HCO3-,SO42-,SO32-,CIO-,Cys,GSH,Ca2+,Cu2+,Mg2+,Zn2+作為共存物與H2S混合,觀察加入的共存物質對探針與H2S二者反應體系熒光行為的干擾情況。結果顯示,探針分子1對H2S的檢測幾乎沒有受到共存物質的影響,表現出探針1具有較強的抵抗外界干擾并特異性識別H2S的能力。
2.3 pH的影響
反應型熒光探針的光學性質往往會受到檢測環境的pH值影響,因此文中詳細探究了不同pH條件下探針對H2S的檢測能力,優化出探針能夠檢測H2S最佳的工作pH范圍。實驗中考察了探針分子在不同pH值環境中的熒光行為,在pH 2-12范圍內,探針分子本身的熒光強度無明顯變化,說明單獨的探針未受pH改變的影響,具有良好的穩定性。同時考察了探針分子與H2S反應體系溶液的熒光強度隨pH值不同的變化,如圖6所示,當pH為2-5時,隨著pH的增大反應溶液的熒光強度也迅速增強;當6-10時,溶液有明顯的熒光增強,表明探針可以在較寬的pH區域對H2S進行檢測;當反應體系的pH值繼續增大,反應體系溶液的熒光強度逐漸降低。因此,實驗中確定生理pH值7.4作為探針1與H2S反應體系的pH值。
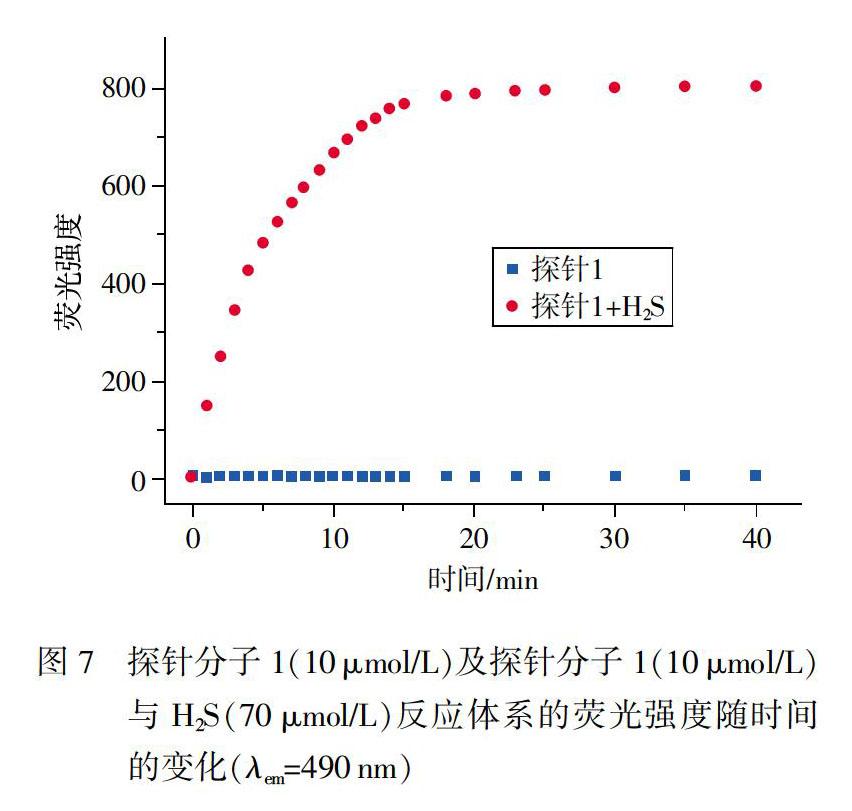
2.4穩定性
實驗中將探針溶解在含有1.5×10-3mmol/LCTAB的50.0mmol/L PBS緩沖溶液中,靜置一段時間(40min),期間檢測熒光強度,制得的探針溶液在室溫下放置熒光強度無明顯變化,具有良好的光穩定性。在探針溶液中加入70μmol/Lh2S后,檢測490nm處的熒光強度隨時間的變化,如圖7所示。二者混合后,迅速反應,探針分子結構中的酯鍵受到H2S的進攻,釋放出香豆素染料3,表現為490nm處的熒光強度迅速增強,大約15min反應達到平衡,同時,二者反應的產物在室溫下也呈現出良好的光穩定性,轉化成產物的熒光強度隨時間變化基本恒定不變。由此表明,光學性能穩定的探針分子1適用于實際樣品的H2S檢測。
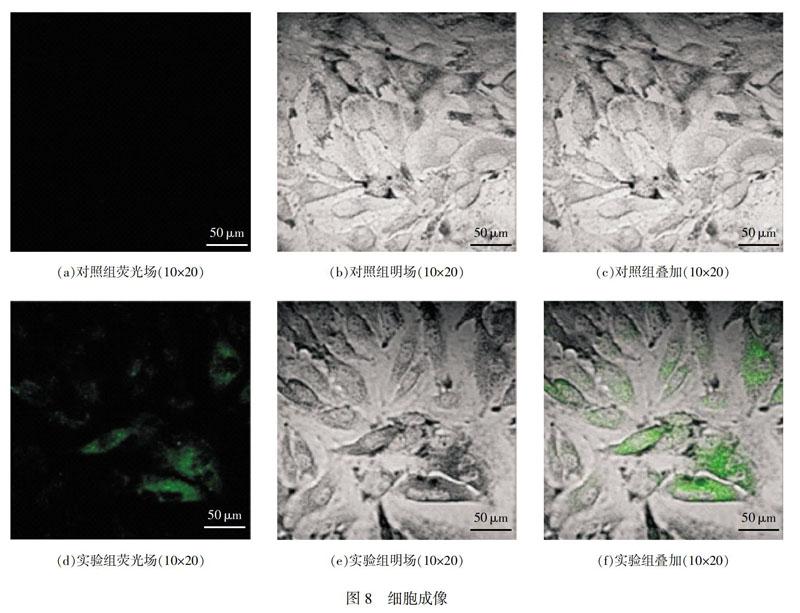
2.5細胞成像研究
實驗中將A549細胞作為載體,考察探針分子在細胞中對H2S的檢測能力,將狀態良好的A549細胞首先置于H2S(30μmol/L)溶液,37℃培養30min,經緩沖液PBS沖洗3次后,再加入探針溶液(5.0μmol/L),孵育30min,經緩沖液PBS沖洗后,置于激光共聚焦顯微鏡下,可以觀察到細胞呈現出強烈的綠色熒光信號。對照實驗,將細胞處于探針溶液(5.0μmol/L)中37℃培養30min,經緩沖液PBS沖洗3次后,置于激光共聚焦顯微鏡下,細胞內幾乎沒有熒光發出。由此表明,文中制得的探針分子能夠穿透細胞膜實現對細胞內H2S的光學響應,具有很好的生物學應用前景。
3結束語
本文以2,4-二硝基苯基為識別基團,香豆素類染料為信號表達基團,基于光誘導轉移(PET)機制,合成了反應型H2S熒光探針。相對于其他測試物質(陰、陽離子及生物分子),該探針對H2S具有良好的選擇性和靈敏度,可以在生理條件(pH 7.4)下檢測H2S。當探針的濃度為10μmol/L時,其對H2S的檢測限為3.0×10-8mol/L,在890nm熒光強度最大增強75倍,以上研究表明,探針在環境及生物學檢測方面具有潛在的應用能力。

