PUF蛋白的研究進展
張 靜,王文珍,蒲首丞,孫梅好
(浙江師范大學化學與生命科學學院,浙江金華321000)
細胞能夠精準地控制mRNA在恰當的時候在特定的位置產生定量的蛋白質,而RNA結合蛋白(RNA-binding proteins,RBPs) 和小 RNA(miRNA)控制著這些進程。它們結合特定的mRNAs,從而控制mRNA的穩定性、翻譯過程和定位[1]。一個RNA結合蛋白能夠結合許多的RNA,從而建造一個龐大的RNA網絡來調控特定的生物學功能。蛋白質結合RNA有多種多樣的方法,并且通常都難以預料是以怎樣的方式結合。目前,存在一些與RNA作用并對其產生影響的工具的使用,類似于短干擾RNA和小分子RNA的使用,但這些工具的使用會降低目標RNA的多樣性和在細胞中的表達量[2]。因此,能夠被設計的工程性RNA結合蛋白是十分具有吸引力的,因為它們能與任何想要的效應結構域相結合,能夠選擇性結合一種特定的RNA目標,從而來研究或者控制某一方面的新陳代謝作用。最早在果蠅D.melanogaster中和線蟲C.elegans中分別發現的PUMILIO和FBF,并以此來命名的PUF蛋白就是這樣一類蛋白質[3-4]。PUF蛋白普遍存在于真核生物中,從酵母、果蠅到小鼠、人類都存在同源基因,并且在細胞分裂、分化及生殖發育方面有著非常重要的作用。PUF家族蛋白通過結合于目的mRNA的3′UTR的特定序列,并聚集其他促進mRNA降解或影響其翻譯表達的蛋白質來調節其表達。PUF蛋白家族大致能夠分為4個分支,其中2個分支是細胞質蛋白[5]。啤酒酵母(Saccharomyces cerevisiae)中的PUF3p,PUF4p和PUF5p是細胞質中PUF蛋白的代表,人類中的PUM1也屬于胞質類[4]。
果蠅PUMILIO是最原始的一種PUF蛋白,其識別的RNA序列特異性較為簡單,并且可被預測。而FBF顯示出與PUMILIO不同的RNA識別特性。Hunchback(hb)mRNA是其中最早發現的一個可被PUF蛋白識別的目標,在果蠅中被PUMILIO識別,其包含一連串的納米響應原件(Nanos Response Element,NRE),NRE 序列在 hb mRNA 的表達過程和胚胎極性建立的過程中是必不可少的[6]。hb NRE的核心序列(5′-U1G2U3A4-U/C5-A6U7A8-3′)是 PUF 蛋白識別目標位點的模型。所有的PUF蛋白都包含一個特異性序列,即RNA結合域,也被稱為Pumilio同源域(Pumiliohomology domain,PUM-HD)或PUF結構域。研究發現[7-8],PUM-HD包含8個串聯的α-螺旋PUF重復單元,整體呈月牙型。PUF蛋白的RNA識別序列起始于5′-UGUR(R代表嘌呤),緊接著是一些可變的3′序列,其中可能包含著一些保守元素[4]。人類PUMILIO1(PUM1)結合于hb RNA的PUM-HD的晶體結構顯示了PUF重復單元識別RNA序列的大致原理[9]。RNA結合于PUM1的內凹面,每個PUF重復通過3個保守側鏈識別一個RNA堿基,其中,2個側鏈與RNA的堿基邊緣形成氫鍵或者分子間作用力,第3個側鏈堆疊在同一堿基或前一個堿基。RNA與蛋白質之間“反向平行”,核酸鏈的1~8位與蛋白質的8~1位分別相互識別(圖1-a)[10]。這種簡單的一個PUF重復識別一個堿基的識別模式就是典型PUF蛋白識別RNA的基本原理。
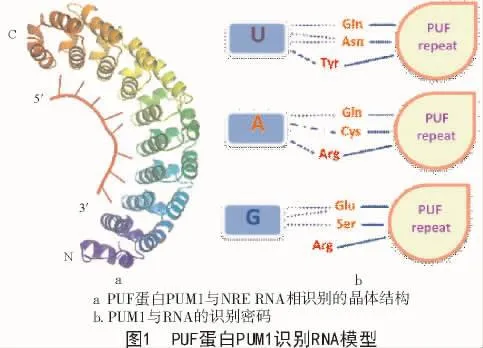
1 PUF蛋白的研究現狀
1.1 結構研究
人類PUM1與RNA復合體的晶體結構說明特定的PUF重復識別特定的堿基。這種簡潔的識別模式暗示著PUF蛋白結合序列的堿基特異性可被定點誘變。這種思路已被用于連接效應器結構域或熒光分子與MS2外殼蛋白,但這需要在目的RNA中插入MS2發卡序列[11]。OPPERMAN[12]研究發現,蠕蟲中的2種PUF蛋白可以識別不同長度的核心序列。其中PUF-8識別8個堿基的序列,與hb NRE序列相似,而另一種PUF蛋白FBF更傾向于識別9個堿基的序列,與hb NRE序列相似,但在其第4,5個堿基之間還含有一個額外的堿基。一些研究已經證明,自然環境可以改變PUF蛋白所識別的RNA的特異性。STUMPF等[13]的試驗結果顯示,在線蟲中RNA特異性極其相似的PUF5和PUF6蛋白都含有10個堿基的核心序列,以5′UGU開始3′UGU結束,而這2個蛋白都只含有8個重復序列,說明這些蛋白不是采用一個重復結合一個RNA堿基的模式,其堿基特異性已經被環境所改變。同樣,在啤酒酵母中也存在類似的證據。酵母共表達6種PUF蛋白,這些蛋白調節不同的目的RNA[14-15],基因組學已經發現,其中的PUF4和PUF5分別識別9個和10個堿基的RNA序列。結構生物化學研究進一步闡釋了PUF蛋白的特異性如何適應更長的序列。MILLER等[16]用酵母PUF4與其識別RNA序列的晶體結構,揭示了9個堿基的RNA序列如何被8個PUF重復所識別。有了PUF4的晶體結構,就知道了它是如何結合9個堿基的目的序列的,而修飾對特異性的改變是否有影響,相同的原理是否適用于其他PUF蛋白呢?對此,OPPERMAN[12]通過構建嵌合蛋白,證明了PUF蛋白的特異性可以通過改變嵌入堿基附近的蛋白質組分而得到轉變。GUPTA[17]用另一種方式研究PUF蛋白對RNA識別序列的適應性,通過研究PUM1結合非同源RNA序列,結果顯示,PUM1與2條非同源的RNA序列有相對較高的親和力,證明了PUF蛋白具有通過游離堿基而優化識別目標的能力,也暗示著PUF蛋白可以進化,從而識別更長的RNA序列。
目前,PUF蛋白與RNA識別特點越來越清晰,我們也更清楚地知道,RNA結合模型是如何識別比從PUM1結構中預期的更大范圍的序列。單個重復的適應性和通過把額外的核苷酸游離于RNA結合面以外的適應能力揭示了為什么PUF蛋白間的RNA結合序列是高度保守。
1.2 功能研究
隨著PUF蛋白與RNA識別模式的深入研究,更多人把研究重點放在了PUF蛋白的作用上。不同的生物體間編碼PUF基因的數量差異非常大,它們在細胞水平上的功能也不盡相同,目前研究的功能已經包括了細胞分化和發育[18-19]、生殖細胞[20]、神經功能與記憶[21-23]、細胞周期[21]以及線粒體生物合成[23]。一直以來,關于PUF的研究都認為,PUF蛋白的典型作用是作為轉錄后抑制子[4],除了這個作用,在不同的生物體中,PUF蛋白表現出不同的作用。有試驗表明,PUF蛋白還有助于mRNA的激活表達[24-27]和亞細胞定位[28-30]。
WICKENS等[4]首次闡述了PUF蛋白抑制mRNA表達的機制,研究顯示,酵母Puf5特異性地直接結合于Ccr4-Pop2-NOTmRNA腺嘌呤酶復合物的Pop2亞基,從而引導腺嘌呤酶到mRNA,這種細胞質核酸外切酶縮短mRNA poly(A)尾巴[31],對mRNA的穩定性和翻譯都產生影響。PUF蛋白的激活子功能是一個新的概念,但在不同的生物體中有越來越多的證據表明PUF蛋白具有該功能[24-27]。目前,基于PUF蛋白的激活機制還沒有很明確的定義。有證據顯示[24-27],PUF蛋白對于mRMA的激活作用可能是直接的,PUF蛋白依賴性的調節作用取決于mRNA 3′UTR上的PUF結合位點。果蠅中的FBF被提到可激活另一個mRNA gel4,但其機制還不清楚,很有可能是通過PUF蛋白和microRNA共同合作實現的[26]。非洲爪蟾蜍也是PUF激活轉錄的一個例子,在其卵母細胞中,Pum結合元件(Pum-binding element,PBE)能促進轉錄激活,由細胞質聚腺嘌呤基化(cytoplasmic polyadenylation element-binding,CPEB)和其同源的細胞質聚腺苷酸化元件(cytoplasmic polyadenylation element,CPE)介導[24]。但其轉錄激活的要求非常嚴格,如果CPE是非典型的,或CPEB出現二聚體,其激活都會失敗,這說明Pum的激活作用可能是因為協同作用,從而使CPEB與轉錄子結合更穩定[24]。動質體目原生動物的寄生蟲布氏錐蟲(Trypanosoma brucei)中也存在基于PUF蛋白的mRNA激活[27]。Puf9能夠在其細胞周期的S期穩定mRNA,Puf9的消耗會減少與其相互作用mRNA的多樣性,說明Puf9能夠穩定其目標,但若突變Puf9的結合區會導致mRNA的穩定性增加[27]。對此最簡單的解釋是Puf9與轉錄抑制子相互競爭目標mRMA 3′UTR序列[27]。對于是否所有的PUF蛋白都是激活子和抑制子,或者僅限定于某些PUF蛋白,這仍然是一個值得研究的問題。
PUF蛋白還具有mRNA定位的功能,對表達的空間控制具有一定的作用。目前,大多數關于PUF蛋白的定位功能都來自于酵母。其Puf3將mRNA定位到線粒體[22,32],Puf6對ASH1轉移到酵母出芽過程中能夠促進其不對稱定位[15],Puf5與過氧化物酶體影響PEX14 mRNA的定位[29]。此外,在果蠅的嗅覺神經元中FBF能夠激活周圍胞體和感覺纖毛egl-4 mRNA的翻譯[26],在哺乳動物中Pum2可能參與定位神經元中mRNA翻譯[30,33]。有科學家研究了酵母中Puf6和Puf3的作用機制,研究發現,Puf6調節ASH1 mRNA的翻譯和定位[15],ASH1編碼一個只在子細胞中表達的轉錄抑制子,并不在酵母母細胞中表達。這是由于非對稱和編碼的mRNA的表達[15]。Puf6結合于ASH1的3′-UTR,通過與翻譯起始因子elF5B/Fun12相互作用,從而抑制其在轉移到胚芽過程中的翻譯[28]。當ASH1 mRNA到達了胚芽的目標位置,Puf6被CK2激酶磷酸化,這影響了Puf6與mRNA的結合,從而開啟了ASH1抑制。Puf3與編碼線粒體蛋白的mRNA相互作用[14],并促進其在線粒體中的定位[22]。有試驗證明了Puf3在線粒體中的作用,Puf3與線粒體定位mRNA發生免疫共沉淀[14]、puf3誘變體中會出現mRNA的錯誤定位[23]、Puf3與線粒體的結合是通過其與ERMES(ER-Mitochondria Encounter Structure)的亞基Mdm12相互作用[32]。除了有助于mRNA的定位,Puf3還會抑制其mRNA并使其脫腺苷化[32,34-35],目前,還不清楚 Puf3在mRNA定位和抑制間有什么聯系。
1.3 在植物中的研究進展
目前,大多數基于PUF蛋白的研究都集中在酵母、果蠅等模式生物中,也有科學家研究了擬南芥和水稻中的PUF基因家族,發現這2種模式植物的PUF基因家族成員比其他模式物種多得多,可能是由于整個基因組的復制導致了大量的PUF基因[4]。這些大量的PUF蛋白家族成員暗示著它們在細胞中對相關RNA的穩定和翻譯是非常重要的。植物PUF蛋白早期只在關于植物發展史形成的文獻中稍有提及[4,36-38],也有個別文獻[39]提到擬南芥中PUF蛋白潛在目標mRNA的鑒定。近年來,有文獻[40-41]針對植物中PUF蛋白的作用進行了研究。而植物中由于PUF基因家族數目的龐大,其功能涉及廣泛,目前還未研究透徹。
2 結論
最近證據顯示,PUF是多功能的mRNA調節子,可以作為抑制子、激活子以及mRNA定位因子。基于這些調節子對細胞分化、發育以及干細胞維持等過程的影響,可以認為,PUF蛋白家族采用多種機制來調節目標RNA,從而行使不同的細胞功能。PUF家族對于RNA定位的廣泛作用和其識別作用與mRNA的抑制和激活是如何相互協調的都還不是很清楚。所以,目前需要解決的是PUF蛋白是如何調節眾多特定的目標mRNA,是激活還是抑制,或者二者都有?PUF依賴的調節對于細胞內外的信號又是怎樣變化的?更多的是,我們應該形成一種mRNA靶向功能的共同認識,這就能更清晰地知道PUF目標mRNA的亞細胞定位以及這種定位是如何依賴于PUF的,并且有助于啟發我們去探索基因的時空表達與PUF作用的相互聯系。
參考文獻:
[1]PORTERDF.Target selection by natural and redesigned PUF proteins[J].Proceedings of the National Academy of Sciences of the U-nited States of America,2015,112(52):15868.
[2]BEITZINGERM,MEISTERG.MicroRNAs:Fromdecay todecoy[J].Cell,2010,140(5):612-614.
[3]WHARTONRP,AGGARWAL A K.mRNA regulation by Puf domain proteins[J].Science S Stke,2006,2006:e37.
[4]WICKENS M,AL E.A PUF family portrait:3′UTRregulation as a way of life[J].Trends in Genetics,2002,18:150-157.
[5]KERNERP.Evolution of RNA-binding proteins in animals:insights from genome-wide analysis in the sponge Amphimedon queenslandica[J].Molecular Biology&Evolution,2011,28(8):2289.
[6] MURATA Y,WHARTON R P.Binding of pumilio to maternal hunchback mRNA is required for posterior patterning in Drosophila embryos[J].Cell,1995,80(5):747-756.
[7] EDWARDS T,PYLE S,WHARTON R,et al.Structure of Pumilio reveals similarity between RNA and peptide binding motifs[J].Cell,2001,105(2):281.
[8] WANG X,ZAMORE P,HALL T E.Crystal structure of a pumilio homology domain[J].Molecular Cell,2001,7(4):855.
[9]WANGX.Modular recognition of RNA by a human pumilio-homology domain[J].Cell,2002,110(4):501-512.
[10]LUG,DOLGNERS J,HALL TMT.Understanding and engineering RNA sequence specificity of PUF proteins[J].Current Opinion in Structural Biology,2009,19(1):110-115.
[11] BERTRAND E.Localization of ASH1 mRNA particles in living yeast[J].Molecular Cell,1998,2(4):437.
[12] OPPERMANL.A single spacer nucleotide determines the specificities of two mRNA regulatory proteins[J].Nature Structural&Molecular Biology,2005,12:945-951.
[13]STUMPF CR,KIMBLE J,WICKENS M.A Caenorhabditis elegans PUF protein family with distinct RNA binding specificity[J].Rna-a Publication of the Rna Society,2008,14(8):1550-1557.
[14]GERBERA P,HERSCHLAGD,BROWNP O.Extensive association of functionally and cytotopically related mRNAs with Puf family rNA-binding proteins in yeast[J].Plos Biology,2012,2(3):E79.
[15] GU W.A new yeast PUF family protein,Puf6p,represses ASH1 mRNA translation and is required for its localization[J].Genes&Development,2004,18(12):1452-1465.
[16] MILLER M T,HIGGIN J J,HALL T M T.Basis of altered RNA-binding specificity by PUF proteins revealed by crystal structures of yeast Puf4p[J].Nature Structural&Molecular Biology,2008,15(4):397.
[17]GUPTA Y K.Structures of human Pumilio with noncognate RNAs reveal molecular mechanisms for binding promiscuity[J].Structure,2008,16(4):549-557.
[18] CHOP F.Cap-dependent translational inhibition establishes two opposing morphogen gradients in drosophila embryos[J].Current Biology Cb,2006,16(20):2035-2041.
[19] PRINZ S.Control of signaling in a MAP-kinase pathway by an RNA-binding protein[J].PloS One,2007,2(2):e249.
[20]KADYROVA L Y.Translational control of maternal Cyclin B mRNA by nanosin the drosophila germline [J].Development,2007,134(8):1519.
[21] TRAVEN A.The yeast PUF protein puf5 has Pop2-independent roles in response to DNA replication stress[J].PloS One,2009,5(5):e10651.
[22]ELIYAHU.Tom20 mediates localization of mRNAs tomitochondria in a translation-dependent manner[J].Molecular&Cellular Biology,2010,30(1):284-294.
[23] KERSHNER A M,KIMBLE J.Genome-wide analysis of mRNA targets for Caenorhabditis elegans FBF,a conserved stem cell regulator[J].Proceedings of the National Academy of Sciences of the United States of America,2010,107(8):3936-3941.
[24]PIQUé M.A combinatorial code for CPE-mediated translational control[J].Cell,2008,132(3):434.
[25] SUH N Y.FBF and its dual control of gld-1 expression in the caenorhabditis elegans germline [J].Genetics,2009,181(4):1249-1260.
[26]KAYE J A.A 3′UTRPumilio-binding element directs translational activation in olfactory sensory neurons[J].Neuron,2009,61(1):57.
[27] ARCHER S K.Trypanosoma brucei PUF9 regulates mRNAs for proteins involved in replicative processes over the cell cycle[J].PloS Pathogens,2009,5(8):e1000565.
[28]DENGY,SINGERRH,GUW.Translation of ASH1 mRNA is repressed by Puf6p-Fun12p/eIF5B interaction and released by CK2 phosphorylation [J]. Genes& Development,2008,22 (8):1037-1050.
[29]ZIPORG.Localization of mRNAs coding for peroxisomal proteins in the yeast,Saccharomyces cerevisiae[J].Proceedings of the National Academy of Sciences of the United States of America,2009,106(47):19848-19853.
[30]VESSEYJ P.Mammalian Pumilio2 regulates dendrite morphogenesis and synaptic function[J].Proceedings of the National Academy of Sciences of the United States of America,2010,107(7):3222-3227.
[31] TUCKER M.The transcription factor associated Ccr4 and Caf1 proteins are components of the major cytoplasmic mRNA deadenylase in Saccharomyces cerevisiae[J].Cell,2001,104(3):377-386.
[32]GARCíARODRíGUEZL J,GAY A C,PONL A.Puf3p,a Pumilio family RNA binding protein,localizes to mitochondria and regulates mitochondrial biogenesis and motility in budding yeast[J].Journal of Cell Biology,2007,176(2):197-207.
[33] VESSEY J P.Dendritic localization of the translational repressor Pumilio2 and its contribution todendritic stress granules[J].Journal of Neuroscience,2006,26(24):6496-6508.
[34]LEE D.PUF3 acceleration of deadenylation in vivocan operate independently of CCR4 activity,possibly involving effects on the PAB1-mRNP structure[J].Journal of Molecular Biology,2010,399(4):562.
[35]OLIVAS W,PARKERR.The Puf3 protein is a transcript-specific regulator of mRNA degradation in yeast[J].EmboJournal,2000,19(23):6602.
[36]GERBER A P.Genome-wide identification of mRNAs associated with the translational regulator PUMILIO in Drosophila melanogaster[J].Proceedings of the National Academy of Sciences of the United States of America,2006,103(12):4487-4492.
[37] SPASSOV D S,JURECIC R.The PUF family of RNA-binding proteins:does evolutionarily conserved structure equal conserved function?[J].Iubmb Life,2003,55(7):359.
[38] SPASSOV D S,JURECIC R.Cloning and comparative sequence analysis of PUM1 and PUM2 genes,human members of the Pumilio family of RNA-binding proteins[J].Gene,2002,299(1/2):195.
[39]FRANCISCHINI CW,QUAGGIORB.Molecular characterization of Arabidopsis thaliana PUF proteins--binding specificity and target candidates[J].Febs Journal,2009,276(19):5456.
[40]TAMP P.The Puf family of RNA-binding proteins in plants:phylogeny,structural modeling,activity and subcellular localization[J].Bmc Plant Biology,2010,10(1):44.
[41] HUANG T,KERSTETTER R A,IRISH V F.APUM23,a PUF family protein,functions in leaf development and organ polarity inArabidopsis[J].Journal of Experimental Botany,2014,65(4):1181-1191.

