膿毒癥生物標志物的臨床診斷價值
王立朋 伊茂禮 徐繡宇 陳 磊
(青島大學醫學院附屬煙臺毓璜頂醫院檢驗科,山東 煙臺 264000)
膿毒癥是由于免疫系統對于侵襲性感染的應答而成為一種異質性綜合征。當伴隨器官系統性功能紊亂或心血管性休克,會出現嚴重的膿毒癥或膿毒癥性休克,這是嚴重病患發病率和死亡率的主要原因。報道顯示,膿毒癥是非冠脈ICU病患最主要的死因〔1〕。在過去的二十年里,膿毒癥的發病率在發展中國家及歐美發達國家呈上升趨勢。發達國家發病率為2%(所有住院病患)及6%~30%(ICU病患);發展中國家的情況更為嚴重〔2〕。膿毒癥是住院病患最常見的死因,北美及歐洲死亡率在28.3%~41.1%〔3〕。2012年國際嚴重膿毒癥及膿毒性休克診療指南推薦抗感染治療,比如抗生素治療及手術源控制應當盡快開始以取得最佳預后〔4〕。鑒于及時啟動合適的抗生素治療以優化膿毒癥預后的重要性,臨床醫師必須取得感染的快速診斷,而標準微生物培養(血培養)缺乏靈敏度,在取得微生物學培養和臨床可行動的結果之間存在固有延遲。此外,一旦診斷膿毒癥開啟標準治療,區分監測病患的預后通常十分困難。生物標志物能夠通過提供額外的信息指導臨床醫師快速診斷及標準治療以外的擴大治療。現在有上百種生物標志物對于膿毒癥診斷及預后有潛在的價值。但僅有一小部分被應用于常規臨床實踐,因為許多缺乏足夠靈敏度和特異性,而尚有一些處在研究階段。本文對于目前膿毒癥診斷具有較大潛在價值標志物的發展現狀進行綜述。
1 C反應蛋白(CRP)
健康者CRP濃度低于5 mg/L;其水平可診斷區分病毒或細菌感染。因為其急性炎癥時升高幅度較大,故這種標志物已應用于包括膿毒癥在內的表征炎癥或感染性疾病的存在〔5〕。在急性炎癥中的作用機制并不明確,可能是結合到微生物的磷脂成分,促進巨噬細胞的清除。在感染過程中,有抗炎及促炎的雙重作用,介導病原體的清除,同時抑制內皮細胞和白細胞之間的相互作用。釋放開始于刺激后的4~6 h,峰值在36 h;當有效的抗生素治療開始后的48 h,開始下降〔6〕。Simon等〔7〕的Meta分析顯示,CRP區分細菌性感染及非感染性病因系統性炎癥反應綜合征(SIRS)靈敏度是0.75,特異度是0.67。ICU病患中,CRP區分(非)膿毒癥病患僅有中等程度的效能,不如降鈣素前體(PCT);CRP在診斷急診嚴重膿毒癥病患有一定能力,亦不如PCT或白細胞介素(IL)-6。CRP水平作為死亡率差的預后指標監測價值較小,Li等〔8〕的研究顯示,CRP預測膿毒癥病患28 d死亡率的靈敏度為0.81,特異度僅為0.48。CRP作為成人膿毒癥標志物缺乏特異性,廣泛應用于篩查新生兒膿毒癥的早發。CRP在某些系統性自身免疫病,一些腫瘤,手術或是組織受損后的重大創傷也會升高。
2 PCT
感染時PCT調節異常導致的大量PCT被釋放到血液中,且釋放程度與膿毒癥嚴重程度相關。細菌毒素反應可在2~4 h內導致血清水平升高(最高可達5 000倍),12~48 h濃度達到最高,生物半衰期是22~26 h,與CRP及其他急性時相反應蛋白相比是優勢〔9〕。與之相反,病毒感染病患PCT通常不增高或輕度增高,可用于鑒別診斷。
最近的一項meta分析顯示PCT區分感染/非感染病因的膿毒癥靈敏度可達0.77,特異度則是0.79,靈敏度和特異度均高于CRP〔10〕。PCT水平在0.1~0.5 ng/ml提示存在類似下呼吸道感染,需要接受抗生素治療。對于病情危重者,膿毒癥診斷的臨界值有很大不同(四分位數差0.5~2.0)〔10〕,膿毒癥休克病患有最高的PCT水平,范圍在4~45 ng/ml〔11〕。
高水平PCT與死亡率增高及嚴重性評分〔急性生理學和慢性健康狀況評分系統(APACHE)、序貫器官衰竭評分(SOFA)及簡化急性生理學評分(SAPS)〕存在相關性。PCT水平下降與生存率升高相關,而持續升高的PCT水平則對不良預后有預測價值,Liu等〔12〕的meta分析顯示PCT用于膿毒癥預后監測靈敏度為0.76,特異度為0.64,在ICU膿毒癥病患中靈敏度為0.76,特異度為0.69;PCT用于嚴重膿毒癥或膿毒癥休克預后監測靈敏度為0.77,特異度為0.61。監測PCT不僅能夠指導開始或停止抗生素治療的時機,還能在不影響發病率和死亡率的情況下幫助縮短抗生素治療的療程,降低治療費用〔13,14〕。PCT在非感染性疾病中亦可升高,比如嚴重創傷、外科手術或心搏驟停后。
3 CD64
CD64感染指數是高敏感、高特異的診斷感染性疾病的早期標志物,有助于區分感染性炎癥和活動性自身免疫性疾病,監測抗菌藥物療效并預測術后感染。對于細菌感染較為特異,對膿毒癥有診斷效用。
Cid等〔15〕的Meta分析顯示,CD64作為膿毒癥診斷標志物的總體靈敏度是0.79,而特異度則是0.91。Icardi等〔16〕研究顯示CD64用于臨床實驗室診斷的靈敏度及特異度分別為0.946,0.887。Livaditi等〔17〕針對成人ICU病患的回顧性研究發現24 h內出現膿毒癥者的CD64表達水平明顯高于健康對照,且增高水平與膿毒癥嚴重程度相關(通過APACHE-Ⅱ量表衡量)。CD64并不是常規應用標志物(CRP)的替代者,而CD64可能反映出膿毒癥病理生理的不同方面,常規CRP加上CD64表達監測能夠提高CRP識別膿毒癥的診斷準確性。CD64對于膿毒癥病患預后監測也有價值,Chen等〔18〕研究顯示,CD64在預測ICU膿毒癥病患死亡率的靈敏度為0.605 5,特異度為0.802 3。危重病患CD64表達每日監測可用于ICU獲得性感染的診斷、評估抗生素應用合理性及預后動態監測。
4 IL-6
IL-6是促炎細胞因子,產生于多種類型細胞,包括單核細胞、成纖維細胞、內皮細胞、角質細胞、T細胞及腫瘤細胞;在接觸脂多糖(LPS)或活菌4~6 h后,IL-6迅速釋放入血,可作為膿毒血癥的早期警告指標。隨后24~48 h濃度會逐漸下降,在血流中持續時間比腫瘤壞死因子(TNF)和IL-1更長〔1〕。趙永禎等〔19〕的研究顯示,IL-6用于診斷膿毒癥的靈敏度及特異度分別為0.81,0.61,用于診斷膿毒癥的靈敏度及特異度分別為0.658,0.706。Oberhoffer等〔20〕的研究中,IL-6的臨界值>500 pg/ml在區分ICU病患膿毒癥及非感染性SIRS上與PCT有相似的辨別力,而在急診病患中,與PCT/CRP相比,IL-6在診斷膿毒癥上的識別價值最低〔21〕。在類似的研究中,PCT及IL-6均是嚴重膿毒癥有意義的獨立預測指標。
血清IL-6水平與膿毒癥病患的嚴重程度與預后密切相關。術后病患的IL-6濃度能預示是否有手術并發癥的產生。連續監測ICU病人血清或血漿中IL-6的水平能有效地評估SIRS的嚴重程度,膿毒血癥及膿毒血癥休克的預后情況。Li等〔8〕的研究結果表明IL-6預測膿毒癥病患28 d死亡率的靈敏度、特異度分別為0.881、0.467。盡管IL-6在膿毒癥病理生理中扮演重要角色,細胞因子作為膿毒癥標記物仍需進一步研究的確證。在膿毒癥本身診斷這一點上,多數研究表明CRP及PCT比細胞因子更為靈敏和特異〔1〕,且細胞因子監測炎癥反應較為昂貴。
5 Presepsin
CD14是表達于單核和巨噬細胞上的糖蛋白,作為LPS及其結合蛋白(LBP)受體在固有免疫系統中通過激活促炎信號級聯發揮作用。在炎癥反應時,血漿蛋白酶活性生成了可溶性的CD14片段(sCD14-ST,或是presepsin)通常在健康個體中血清的濃度很低,但當出現細菌感染時,濃度會升高。Presepsin可通過化學發光酶免疫測定檢測,有成為診斷性和預后性標志物的潛能。Presepsin在膿毒癥病患中升高,但在G+與G-感染之間差異無統計學意義〔1〕。Ulla等〔22〕研究發現其增加的程度與膿毒癥的嚴重程度相關,Presepsin在感染者最早時間點的水平最高,使之成為理想診斷標志物候選。Endo等〔23〕在多中心進行的前瞻性研究結果顯示其在膿毒癥診斷的靈敏度特異度分別為0.79、0.62。Masson等〔24〕的回顧性研究發現,嚴重膿毒癥和膿毒癥休克者的Presepsin水平在死亡者中明顯高于生存者。Presepsin與ICU 28 d死亡率獨立相關。Endo等〔25〕研究也表明了與常見的膿毒癥標志物(IL-6,CRP,PCT)相比,Presepsin水平與膿毒癥嚴重程度相關,在預后良好組,超過7 d后測試的標志物均出現下降,而預后不良組只有Presepsin水平未下降,說明其作為預后標志物的實用性。Ulla等〔22〕的研究表明,其用于膿毒癥死亡預測的靈敏度達到0.72,特異度則達到了0.70。
6 血漿可溶性髓樣細胞觸發受體(sTREM)-1
sTRME-1為免疫球蛋白超家族成員,在暴露于細菌和真菌后,能夠發出誘導細胞因子、趨化因子、活性氧產生的信號,促進炎癥反應。此外,還能發出信號,導致中性粒細胞脫顆粒,對吞噬細胞起上調作用。膿毒癥時,活化的吞噬細胞釋放了可溶形式的sTREM-1,在體液中可被檢測,作為潛在的膿毒癥診斷性標志物。最近的一項meta分析顯示其靈敏度及特異度分別為0.79及0.80〔26〕;研究者認為sTREM-1區分膿毒癥及SIRS有中等程度的診斷準確性。Jiyong等〔27〕的meta分析顯示:感染部位取樣和檢測TREM-1的升高,高度提示細菌感染,然而其對于尿路感染并不敏感,建議sTREM-1的低水平可支持臨床醫師在等待培養結果期間保留抗生素應用。有報道顯示,膿毒癥死亡者比生存者有更高水平的sTREM-1〔28〕。多變量回歸分析表明,sTREM-1水平是28 d死亡率的獨立預測因素,其用于28 d死亡率預測的靈敏度可達0.857,特異度可達0.757〔8〕。盡管是一個實用的輔助指標,但其在診斷膿毒癥中的角色尚未明確,在臨床應用前仍需要大量研究數據佐證。
7 可溶性尿激酶型纖維蛋白原激活劑受體(suPAR)
suPAR是最近被提出作為免疫激活的潛在標志物。本質是一種基膜蛋白,表達于包括單核,巨噬在內的多種類型細胞,且與炎癥細胞從血流到組織的遷移有關。它的游離形式suPAR可在血液,尿液及腦脊液(CSF)中可被檢測出來。繼發于免疫系統的激活增加的炎癥會引起體液中suPAR濃度的提升。水平增高見于腫瘤,感染性及免疫性疾病。suPAR水平的增加存在于急性病人,但這種增加并不特異于膿毒癥。然而,其被多項最近的研究證明有預后的價值,是這個領域有前途的標志物。Suberviola等〔29〕的研究表明,suPAR對于ICU病患死亡率預測的靈敏度為0.805,特異度為0.458;Donadello等〔30〕的研究表明,ICU病患高水平的suPAR是28 d死亡率的獨立預測因子,其對于ICU病患死亡率預測的靈敏度為0.66,特異度為0.64。該研究還指出,在伴有終末器官成年ICU病人中發現連續偏高血清suPAR濃度,與生存者相比,死亡比例中的suPAR明顯更高,高水平的suPAR與死亡率呈正相關,進一步表明了suPAR的預后實用性。
8 LBP
該復合物結合到CD14及Toll樣受體4/MD2復合物,導致細胞因子及其他促炎介質的轉錄。作為急性時相反應的一部分產生于肝臟。生理狀態下,在血清中LBP的濃度為5~10 μg/ml。在急性時相反應時會增高若干次;膿毒癥時,LBP水平在24 h內增長到峰值中位數為30~40 μg/ml,這些特點使其成為診斷膿毒癥有希望的標志物〔31〕。Ratzinger等〔32〕研究表明其靈敏度為0.575,特異度為0.671〔32〕。后續的研究確認,LBP并不是一個十分特異的炎癥反應標志物。
9 腎上腺髓質素原(pro-ADM)
由52個氨基酸組成的多肽,有免疫調節、代謝、血管擴張活性,維持器官血液供應。此外,ADM有殺菌活性,有助于評估監測膿毒癥診斷和預后。激素原片段(pro-ADM)比完整多肽更加穩定,在生物體液中可以通過自動化的方法進行檢測。pro-ADM是具有預后價值的生物標志物,可用于識別需要ICU監護危重病患。Suberviola等〔29〕的研究結果顯示pro-ADM在預測ICU病患死亡率的靈敏度及特異度分別為0.61、0.68,優于CRP及PCT在該研究中的表現。
10 細胞游離(cell free)DNA
細胞凋亡或壞死所釋放的DNA片段,在血液中可被量化。膿毒癥時,細胞死亡十分常見,釋放的DNA片段可作為膿毒癥標志物。Rhodes等〔33,34〕的研究表明ICU病患相比于健康對照組有較高濃度的細胞游離DNA,此外,膿毒癥者比其他疾病有更高水平的游離DNA,后期死亡病患的游離DNA明顯高于幸存者。Dwivedi等〔35〕研究表明,與中等預測能力的臨床積分系統(多器官衰竭及APACHE-Ⅱ)相比,細胞游離DNA對ICU死亡率有最強的預測能力。此外,死亡病例有持續升高的游離DNA水平,相比而言生存者持續低水平的細胞游離DNA。Huttunen等〔36〕的研究顯示游離DNA預測死亡率的靈敏度達到0.83,而特異度則為0.79,血漿cfDNA是一個菌血癥特異獨立死亡預測標志物。見表1。
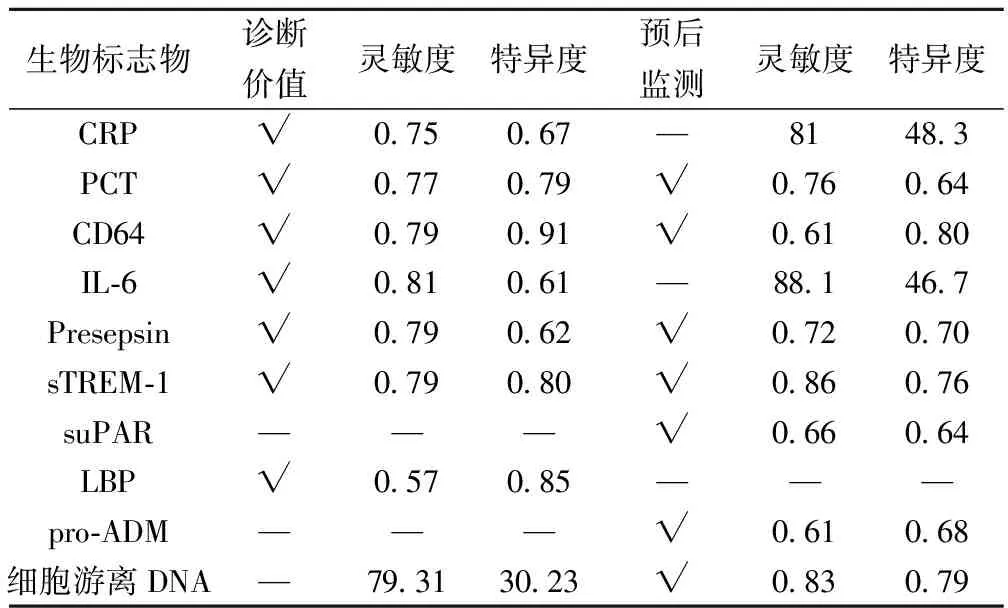
表1 生物標志物文獻評價
—:價值較小,不宜作為診斷或預后監測使用
綜上,膿毒癥是缺乏可靠診斷金標準的異質性疾病。由于血培養的陽性率較低,許多病例的診斷依賴于相對主觀的臨床環境,導致診斷出現變異性。診斷和啟動治療仍需要通過評估病史,感染癥狀及進展為急性器官衰竭可能性。然而,生物標志物能幫助縮短這一過程,有提高膿毒癥診斷和治療的潛在價值。膿毒癥標志物的未來在于這些新型標志物在異質群體中的大量確證性的研究,未來探究標志物結合使用可能增加醫師診斷和預后監測能力。一個成功標志物的主要特質是高靈敏度特異度,床旁檢測的可能性及經濟可及性。鑒于判定膿毒癥的標準,標志物調查研究、確認及臨床整合對于提升膿毒癥病患的關懷十分重要。高通量技術,包括轉錄組學、蛋白質組學及代謝組學在發現和發展新型標志物中提供了堅實的框架支持〔37~39〕。膿毒癥的實驗室診斷是不同技術方法的一個嵌合體,其對于后續膿毒癥病患臨床癥狀和預后十分關鍵。
11 參考文獻
1Prucha M,Bellingan G,Zazula R.Sepsis biomarkers〔J〕.Clin Chim Acta.2015;440:97-103.

3Levy MM,Artigas A,Phillips GS,etal.Outcomes of the surviving sepsis campaign in intensive care units in the USA and Europe:a prospective cohort study〔J〕.Lancet Infect Dis,2012;12(12):919-24.
4Dellinger RP,Levy MM,Rhodes A,etal.Surviving sepsis campaign:international guidelines for management of severe sepsis and septic shock,2012〔J〕.Intensive Care Med,2013;39(2):165-228.
5Arnaud C,Burger F,Steffens S,etal.Statins reduce interleukin-6-induced C-reactive protein in human hepatocytes:new evidence for direct anti-inflammatory effects of statins〔J〕.Arterioscler Thromb Vasc Biol,2005;25(6):1231-6.
6Bloos F,Reinhart K.Rapid diagnosis of sepsis〔J〕.Virulence,2014;5(1):154-60.
7Simon L,Gauvin F,Amre DK,etal.Serum procalcitonin and C-reactive protein levels as markers of bacterial infection:a systematic review and meta-analysis〔J〕.Clin Infect Dis,2004;39(2):206-17.
8Li Z,Wang H,Liu J,etal.Serum soluble triggering receptor expressed on myeloid cells-1 and procalcitonin can reflect sepsis severity and predict prognosis:a prospective cohort study〔J〕.Mediators Inflamm,2014;2014:641039
9Henriquez-Camacho C,Losa J.Biomarkers for sepsis〔J〕.Biomed Res Int,2014;2014:547818.
10Wacker C,Prkno A,Brunkhorst FM,etal.Procalcitonin as a diagnostic marker for sepsis:a systematic review and meta-analysis〔J〕.Lancet Infect Dis,2013;13(5):426-35.
11Reinhart K,Meisner M.Biomarkers in the critically ill patient:procalcitonin〔J〕.Crit Care Clin,2011;27(2):253-63.
12Liu D,Su L,Han G,etal.Prognostic value of procalcitonin in adult patients with sepsis:a systematic review and meta-analysis〔J〕.PLoS One,2015;10(6):e0129450.
13Schuetz P,Albrich W,Christ-Crain M,etal.Procalcitonin for guidance of antibiotic therapy〔J〕.Expert Rev Anti Infect Therapy,2010;8(5):575-87.
14Nobre V,Harbarth S,Graf JD,etal.Use of procalcitonin to shorten antibiotic treatment duration in septic patients:a randomized trial〔J〕.Am J Respir Crit Care Med,2008;177(5):498-505.
15Cid J,Aguinaco R,Sánchez R,etal.Neutrophil CD64 expression as marker of bacterial infection:a systematic review and meta-analysis〔J〕.J Infect,2010;60(5):313-9.
16Icardi M,Erickson Y,Kilborn S,etal.CD64 index provides simple and predictive testing for detection and monitoring of sepsis and bacterial infection in hospital patients〔J〕.J Clin Microbiol,2009;47(12):3914-9.
17Livaditi O,Kotanidou A,Psarra A,etal.Neutrophil CD64 expression and serum IL-8:sensitive early markers of severity and outcome in sepsis〔J〕.Cytokine,2006;36(5-6):283-90.
18Chen Q,Shi J,Fei A,etal.Neutrophil CD64 expression is a predictor of mortality for patients in the intensive care unit〔J〕.Int J Clin Exp Pathol,2014;7(1):7806-13.
19趙永禎,李春盛.生物標志物組合對急診膿毒癥和重度膿毒癥患者的診斷價值〔J〕.中華危重病急救醫學,2014;26(3):153-8.
20Oberhoffer M,Russwurm S,Bredle D,etal.Discriminative power of inflammatory markers for prediction of tumor necrosis factor-alpha and interleukin-6 in ICU patients with systemic inflammatory response syndrome (SIRS) or sepsis at arbitrary time points〔J〕.Intensive Care Med,2000;26(Suppl2):S170-4.
21Tsalik EL,Jaggers LB,Glickman SW,etal.Discriminative value of inflammatory biomarkers for suspected sepsis〔J〕.J Emerg Med,2012;43(1):97-106.
22Ulla M,Pizzolato E,Lucchiari M,etal.Diagnostic and prognostic value of presepsin in the management of sepsis in the emergency department:a multicenter prospective study〔J〕.Crit Care,2013;17(4):R168.
23Endo S,Suzuki Y,Takahashi G,etal.Usefulness of presepsin in the diagnosis of sepsis in a multicenter prospective study〔J〕.J Infect Chemother,2012;18(6):891-7.
24Masson S,Caironi P,Spanuth E,etal.Presepsin (soluble CD14 subtype) and procalcitonin levels for mortality prediction in sepsis:data from the Albumin Italian Outcome Sepsis trial〔J〕.Crit Care,2014;18(1):R6.
25Endo S,Suzuki Y,Takahashi G,etal.Presepsin as a powerful monitoring tool for the prognosis and treatment of sepsis:a multicenter prospective study〔J〕.J Infect Chemother,2014;20(1):30-4.
26Wu Y,Wang F,Fan X,etal.Accuracy of plasma sTREM-1 for sepsis diagnosis in systemic inflammatory patients:a systematic review and meta-analysis〔J〕.Crit Care,2012;16(6):R229.
27Jiyong J,Tiancha H,Wei C,etal.Diagnostic value of the soluble triggering receptor expressed on myeloid cells-1 in bacterial infection:a meta-analysis〔J〕.Intensive Care Med,2009;35(4):587-95.
28Jeong SJ,Song YG,Kim CO,etal.Measurement of plasma sTREM-1 in patients with severe sepsis receiving early goal-directed therapy and evaluation of its usefulness〔J〕.Shock,2012;37(6):574-8.
29Suberviola B,Castellanos-Ortega A,Ruiz Ruiz A,etal.Hospital mortality prognostication in sepsis using the new biomarkers suPAR and proADM in a single determination on ICU admissions〔J〕.Intensive Care Med,2013;39(11):1945-52.
30Donadello K,Scolletta S,Taccone FS,etal.Soluble urokinase-type plasminogen activator receptor as a prognostic biomarker in critically ill patients〔J〕.J Crit Care,2014;29(1):144-9.
31Sakr Y,Burgett U,Nacul FE,etal.Lipopolysaccharide binding protein in a surgical intensive care unit:a marker of sepsis〔J〕? Crit Care Med,2008;36(7):2014-22.
32Ratzinger F,Schuardt M,Eichbichler K,etal.Utility of sepsis biomarkers and the infection probability score to discriminate sepsis and systemic inflammatory response syndrome in standard care patients〔J〕.PLoS One,2013;8(12):e82946.
33Rhodes A,Wort SJ,Thomas H,etal.Plasma DNA concentration as a predictor of mortality and sepsis in critically ill patients〔J〕.Crit Care,2006;10(2):R60.
34Saukkonen K,Lakkisto P,Pettila V,etal.Cell-free plasma DNA as a predictor of outcome in severe sepsis and septic shock〔J〕.Clin Chem,2008;54(6):1000-7.
35Dwivedi DJ,Toltl LJ,Swystun LL,etal.Prognostic utility and characterization of cell-free DNA in patients with severe sepsis〔J〕.Crit Care,2012;16(4):R151.
36Huttunen R,Kuparinen T,Jylh?v? J,etal.Fatal outcome in bacteremia is characterized by high plasma cell free DNA concentration and apoptotic DNA fragmentation:a prospective cohort study〔J〕.PLoS One,2011;6(7):e21700.
37Rifai N,Gillette MA,Carr SA,etal.Protein biomarker discovery and validation:the long and uncertain path to clinical utility〔J〕.Nat Biotechnol,2006;24(8):971-83.
38Maslove DM,Wong HR.Gene expression profiling in sepsis:timing,tissue,and translational considerations〔J〕.Trends Mol Med,2014;20(4):204-13.
39Mickiewicz B,Vogel HJ,Wong HR,etal.Metabolomics as a novel approach for early diagnosis of pediatric septic shock and its mortality〔J〕.Am J Respir Crit Care Med,2013;187(9):967-76.

