年輕乳腺癌和絕經后乳腺癌患者病理和腫瘤分子特征對比
陳曉越(惠州市中心人民醫院乳腺外科,廣東 惠州 516001)
乳腺癌是常見的女性惡性腫瘤之一,好發于中老年人群,但近年來女性乳腺癌發病呈年輕化趨勢,其發病率明顯上升,預后差,嚴重影響女性健康生活甚至危及生命[1]。不同年齡階段乳腺癌患者腫瘤分化程度和惡性程度有差異性,臨床中掌握不同年齡階段乳腺癌患者病理和腫瘤分子特征,對診治乳腺癌有重要意義。為深入探討年輕女性和絕經后女性乳腺癌腫瘤分子分型及臨床病理特點,為臨床個體化治療女性乳腺癌患者及判斷預后提供理論依據,現報告如下。
1 資料及方法
1.1一般資料:回顧性選取我院2014年1月~2017年7月收治的乳腺癌患者100例作為研究對象。入選標準:根據病史、臨床表現、術前超聲、影像學檢查及腫瘤標志物等初次診斷為乳腺癌;均在醫師告知下自愿行手術治療,術后組織活檢明確診斷為原發性乳腺癌。排除乳腺癌遠處轉移者;排除既往診斷過乳腺癌并進行放化療等輔助治療者。絕經后中老年女性乳腺癌患者設為A組(65例),年輕(≤35歲)女性乳腺癌患者設為B組(35例)。A組年齡45~79歲;B組年齡23~35歲。
1.2方法
1.2.1手術方法:患者入院后均積極完善相關術前準備,根據患者病情擬定手術方案,包括乳腺癌改良根治術、乳腺癌保乳手術、乳腺癌單切+前哨淋巴結活檢術。術后腫瘤組織均術中冰凍送檢。
1.2.2女性乳腺癌組織ER、PR、HER-2、Ki-67測定方法:經手術切除的所有腫瘤組織標本均經10%甲醛固定、石蠟包埋等處理,連續切片成約4 μm厚,檢測方法:免疫組化Envision二步法。ER、PR表達:腫瘤細胞核染色呈棕黃色顆粒為陽性,ER(+)、PR(+)表示陽性細胞≥1%,ER(-)、PR(-)表示陽性細胞<1%。HER-2表達:HER-2(-)表示<10%腫瘤細胞無著色或細胞膜染色不完整、微弱,HER-2(+)表示>10%腫瘤細胞膜染色。Ki-67蛋白表達:腫瘤細胞核染色呈棕黃色顆粒為Ki-67蛋白陽性,高表達表示陽性細胞≥14%,低表達表示陽性細胞<14%。
1.2.3乳腺癌腫瘤分子分型方法:根據乳腺癌組織ER、PR、HER-2、Ki-67表達情況,并參照乳腺癌分子分型標準[2]:①腔面A型:ER(+)和(或)PR(+),HER-2(-),低表達Ki-67;②腔面B型:包括HER-2陰性型,即ER(+)和(或)PR(+),HER-2(-),高表達Ki-67和 HER-2陽性型,即ER(+)和(或)PR(+),HER-2(+),任何水平Ki-67;③HER-2過表達型:ER(-)、PR(-),HER-2(+),任何水平Ki-67;④三陰型:ER(-)、PR(-),HER-2(-),任何水平Ki-67。
1.2.4乳腺癌病理分型、組織學分級及臨床病理分期:病理分型、組織學分級:參照WHO乳腺癌病理學分類標準[3]將病理類型分為導管內癌、浸潤性小葉癌、浸潤性導管癌、其他特殊癌;組織學分級包括Ⅰ、Ⅱ、Ⅲ級。臨床病理分期:參照乳腺癌TNM分期標準[4]分為Ⅰ、Ⅱ、Ⅲ、Ⅳ期。
1.3統計學方法:所有數據采用SPSS24.0統計學軟件進行分析,計數資料采用以率(%)表示,行χ2檢驗,P<0.05則差異具有統計學意義。
2 結果
2.1兩組ER、PR、HER-2、Ki-67表達情況比較:A組ER、PR、HER-2、Ki-67表達情況與B組相比,差異具有統計學意義(P<0.05)。見表1。
2.2兩組腫瘤分子亞型比較:兩組腫瘤分子亞型均以腔面B型為主,A組腔面A型及B型比例雖高于B組,但差異無統計學意義(P>0.05);A組HER-2過表達型、三陰型比例明顯低于B組,差異有統計學意義(P<0.05)。兩組腫瘤分子亞型比較差異無統計學意義(P>0.05)。見表2。
表1兩組ER、PR、HER-2、Ki-67表達情況比較(例)
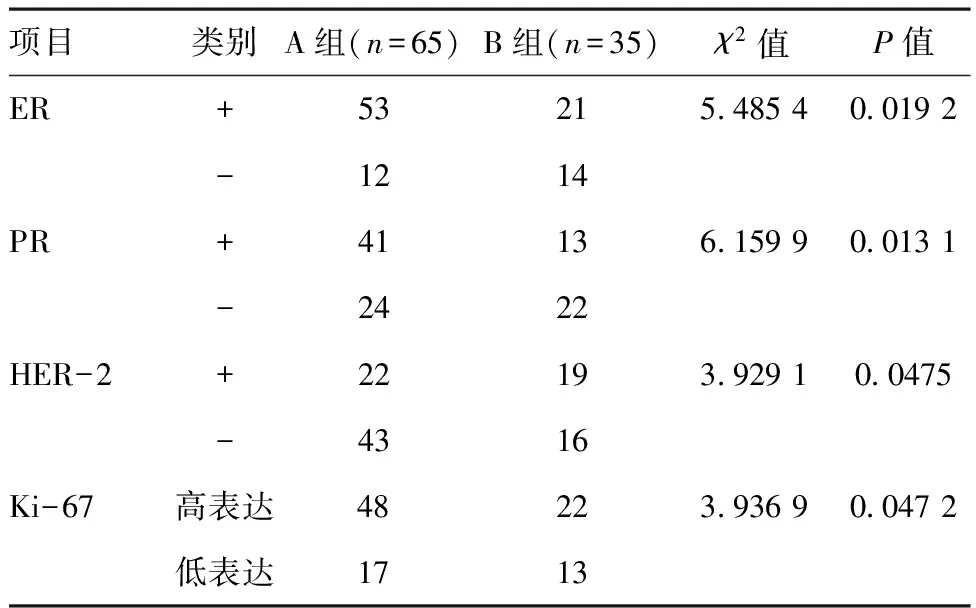
項目類別A組(n=65)B組(n=35)χ2值P值ER+53215485400192-1214PR+41136159900131-2422HER-2+22193929100475-4316Ki-67高表達48223936900472低表達1713
表2兩組腫瘤分子亞型比較(例)

組別例數腔面A型腔面B型HER-2過表達型三陰型A組6523①28①6②8②B組3571459χ2值47799P值01886
注:A組腔面A型、腔面B型比例與B組比較,①P>0.05;A組HER-2過表達型、三陰型比例與B組比較,②P<0.05
2.3兩組腫瘤病理分型、組織學分級及病理分期比較:A組病理分型與B組比較,差異無統計學意義(P>0.05);A組組織學分級與B組比較,差異有統計學意義(P<0.05),且B組Ⅱ級+Ⅲ級比例顯著高于A組,差異有統計學意義(P<0.05);A組病理分期與B組比較,差異無統計學意義(P>0.05),但B組Ⅲ期+Ⅳ期比例顯著高于A組,差異有統計學意義(P<0.05)。見表3。
表3兩組腫瘤病理分型、組織學分級及病理分期比較(例)

組別例數病理分型導管內癌浸潤性小葉癌浸潤性導管癌其他特殊癌組織學分級(級)Ⅰ Ⅱ Ⅲ病理分期(期)Ⅰ Ⅱ Ⅲ ⅣA組656114622022①23①93612②8②B組3538231315①17①31410②8②χ2值052056362142438P值091440041502363
注:B組Ⅱ級+Ⅲ級比例與A組比較,①P<0.05;B組Ⅲ期+Ⅳ期比例與A組比較,②P<0.05
3 討論
近年來女性乳腺癌發病率呈明顯上升趨勢,且趨于年輕化。手術是主要治療方式,包括乳腺癌改良根治術、乳腺癌保乳手術、乳腺癌單切+前哨淋巴結活檢術等。既往研究顯示,由于年齡差異化,女性乳腺腫瘤組織雌激素、孕激素受體:ER及PR、人表皮生長因子受體2(HER-2)、腫瘤細胞增殖相關核抗原Ki-67蛋白表達差異較大。故腫瘤分子亞型、病理分型、組織學分級及臨床病理分期也有所區別,而臨床常根據上述腫瘤組織分子分型及病理特點決定乳腺癌術后放化療方式,也由此判定其預后是否良好[5]。本研究顯示,A組ER、PR、HER-2、Ki-67表達情況與B組相比,差異有統計學意義(P<0.05)。兩組腫瘤分子亞型均以腔面B型為主,A組腔面A型、及B型比例雖高于B組,但差異無統計學意義(P>0.05);A組HER-2過表達型、三陰型比例明顯低于B組,差異有統計學意義(P<0.05)。臨床認為乳腺癌預后危險因素與腫瘤分子亞型密切相關,腔面A型及 B型較HER-2過表達型及三陰型預后良好。同時,本研究中A組病理分型與B組比較,差異無統計學意義(P>0.05);A組組織學分級與B組比較,差異有統計學意義(P<0.05),且B組Ⅱ級+Ⅲ級比例顯著高于A組,差異有統計學意義(P<0.05);A組病理分期與B組比較,差異無統計學意義(P>0.05),但B組Ⅲ期+Ⅳ期比例顯著高于A組,差異有統計學意義(P<0.05)。說明病理分型雖不能較好評估女性乳腺腫瘤的惡性程度及術后預后,但腫瘤組織學分級高低卻能反映腫瘤細胞分化程度,一般其分化越差,腫瘤分期越接近晚期,腫瘤遠處轉移及復發率顯然提高,與秦穎等研究結果[6]高度相仿。
綜上所述,年輕女性和絕經后中老年女性乳腺癌患者腫瘤分子特征無顯著區別,但年輕女性乳腺腫瘤細胞分化較差,分期較晚,故其病理特征可為臨床個體化治療乳腺癌患者及判斷預后提供理論依據。
4 參考文獻
[1] 沈夢露,韓記真,劉 瑩,等.乳腺癌患者223例分子分型與新輔助化療后MP評價的關系[J].實用醫學雜志,2017,33(9):1397.
[2] 劉 偉,李健斌,王 濤,等.乳腺癌分子亞型與新輔助化療療效及預后的相關性分析[J].中華醫學雜志,2016,96(36):2898.
[3] 周海豐,范玉宏,武雪亮,等.不同分子亞型乳腺癌的臨床病理特征[J].中國老年學雜志,2015,46(19):5528.
[4] 孫 瑩,于 晶,魏軍民,等.35歲以下女性乳腺癌患者的臨床病理特征[J].山東大學學報(醫學版),2014,52(7):71.
[5] 韋常宏,陳 伊,寧淑芳,等.絕經后及年輕女性乳腺癌患者腫瘤分子分型及臨床病理特征對比觀察[J].山東醫藥,2016,56(43):93.
[6] 秦 穎,張同先,張 巍,等.青年乳腺癌臨床病理特點分子分型及預后分析[J].中國腫瘤臨床,2014,41(4):231.

