蛋氨酸限制和膠原蛋白肽對高脂飲食小鼠脂代謝和氧化應(yīng)激的聯(lián)合作用
王雅楠,張佳紅,郭海濤,樂國偉,2,*,施用暉,2
肥胖是由機(jī)體能量攝入量大于能量消耗量引起的一種慢性營養(yǎng)代謝失調(diào)癥,特別是高能量攝入以及低能量支出更易引發(fā)肥胖[1]。目前肥胖的發(fā)病率正以指數(shù)形式增加,已經(jīng)成為了全球面臨的最嚴(yán)重的健康和經(jīng)濟(jì)問題[2]。大量研究表明,長期高脂飲食使活性氧(reactive oxygen species,ROS)過量生成,機(jī)體氧化還原平衡被打破,引起脂質(zhì)過氧化,誘發(fā)脂代謝紊亂和肥胖,并導(dǎo)致心血管疾病、癌癥等的發(fā)生[3]。因此,研究如何有效控制和改善高脂飲食誘發(fā)肥胖的方法成為熱點(diǎn),除了手術(shù)和藥物等方法外,人們更加關(guān)注飲食方式干預(yù)的方法,一方面是通過飲食中營養(yǎng)成分的限制,近20 年來飲食蛋氨酸限制(methionine restriction,MR)引起了廣泛的關(guān)注,因?yàn)轱嬍矼R不需要進(jìn)行食物限制,就可以減少機(jī)體脂肪的積累[4-5],增加能量支出和代謝的靈活性[6],增加胰島素敏感性,改善脂類代謝[7],降低炎癥反應(yīng)[8],并且可以顯著延長多種生物體的壽命[9-11];另一方面是通過生物活性物質(zhì)的添加,大量研究表明,飲食中添加生物活性物質(zhì)可以抑制高脂飲食誘導(dǎo)的肥胖,減少機(jī)體氧化應(yīng)激及脂代謝的失調(diào)[12-14]。研究報(bào)道膠原蛋白肽具有抗氧化、抑制血壓上升、減緩動脈硬化和預(yù)防骨質(zhì)疏松等功能[15],李亞欣等[16]研究也表明膠原蛋白肽可有效提高小鼠機(jī)體抗氧化能力,緩解高脂飲食造成的氧化應(yīng)激,改善血脂代謝。C57BL/6小鼠飲食MR可以抵抗飲食誘導(dǎo)的肥胖和胰島素抵抗,但是小鼠具有較低的骨密度[7],研究報(bào)道膠原蛋白肽可以改善骨密度和骨質(zhì)疏松[17-18]。膠原蛋白肽聯(lián)合MR對于骨小梁的厚度及單位骨強(qiáng)度的改善作用已有研究,但是飲食MR與生物活性物質(zhì)膠原蛋白肽,對高脂飲食條件下肝臟氧化應(yīng)激及脂代謝是否具有更好的改善作用鮮有報(bào)道。本實(shí)驗(yàn)以C57BL/6小鼠為研究對象,利用高脂飲食研究飲食MR和膠原蛋白肽的聯(lián)合作用對于小鼠氧化還原狀態(tài)和脂代謝的影響,為肥胖脂代謝和氧化還原狀態(tài)的失衡提供營養(yǎng)學(xué)干預(yù)的參考。
1 材料與方法
1.1 動物、材料與試劑
SPF級4 周齡雄性C57BL/6小鼠:SCXK(蘇)2015-0001,初始體質(zhì)量為18~20 g,購自南京生物醫(yī)藥研究院。
蛋氨酸(食品級,蛋氨酸質(zhì)量分?jǐn)?shù)99.93%)、豬骨膠原蛋白肽(食品級,純度99%)均為市售;總抗氧化能力(total antioxidant capacity,T-AOC)試劑盒、丙二醛(malondialdehyde,MDA)試劑盒、谷胱甘肽過氧化物酶(glutathion peroxidase,GSH-Px)試劑盒、游離脂肪酸(free fatty acid,F(xiàn)FA)試劑盒、蘇木素-伊紅(hematoxylin and eosin,HE)染色液、油紅O染色液 南京建成生物工程研究所;甘油三酯(triglyceride,TG)、總膽固醇(total cholesterol,TC)、高密度脂蛋白膽固醇(high density lipoprotein cholesterol,HDL-C)、低密度脂蛋白膽固醇(low density lipoprotein cholesterol,LDL-C) 上海豐匯醫(yī)學(xué)科技股份有限公司;BCA蛋白質(zhì)量濃度測定試劑盒(增強(qiáng)型)、脫氧核糖核苷三磷酸(deoxy-ribonucleoside triphosphate,dNTP)碧云天生物技術(shù)研究所;Trizol 美國Biomiga公司;M-MLV逆轉(zhuǎn)錄酶、5×逆轉(zhuǎn)錄緩沖液 美國Promega公司;RNase抑制劑 南京生興生物技術(shù)有限公司;Oligo(dT)、基因引物 上海捷瑞生物工程公司;SYBR Green Master Mix 南京諾唯贊生物科技有限公司;其余試劑均為分析純。
1.2 儀器與設(shè)備
Epoch微孔板分光光度計(jì) 美國BioTek公司;5804R臺式高速冷凍離心機(jī) 德國Eppendorf公司;7900HT Fast實(shí)時(shí)熒光定量聚合酶鏈反應(yīng)(quantitative real time polymerase chain reaction,qPCR)儀 美國ABI公司;超微量分光光度計(jì) 上海采邑生物科技有限公司;超低溫冷凍冰箱 美國Thermo Scientific公司;ETC811 PCR儀 東勝興業(yè)科學(xué)儀器有限公司。
1.3 方法
1.3.1 動物飼喂及分組
將36 只SPF級雄性C57BL/6小鼠用正常飼料預(yù)飼喂1 周后,按體質(zhì)量隨機(jī)分為4 組,每組9 只:1)低脂正常蛋氨酸飲食組(ND組):飼料中含4%(質(zhì)量分?jǐn)?shù),下同)脂肪、0.86%蛋氨酸;2)高脂正常蛋氨酸飲食組(HF組):飼料中含20%脂肪、0.86%蛋氨酸;3)高脂蛋氨酸限制飲食組(MR組):飼料中含20%脂肪、0.17%蛋氨酸;4)高脂蛋氨酸限制與1%膠原蛋白肽聯(lián)合作用飲食組(PMR組):飼料中含20%脂肪、0.17%蛋氨酸、1%膠原蛋白肽。飼料配方見表1。實(shí)驗(yàn)小鼠飼養(yǎng)于SPF級動物房,同室分籠,每組3 籠,每籠3 只,環(huán)境溫度控制在(23±2)℃,相對濕度60%,12 h/12 h晝夜循環(huán)光照,保持飼養(yǎng)環(huán)境衛(wèi)生。所有實(shí)驗(yàn)小鼠均自由攝食和飲水,每周稱量并記錄體質(zhì)量。

表1 飼料中各成分的質(zhì)量分?jǐn)?shù)Table 1 Compositions of experimental diets%
1.3.2 血液、組織樣品采集及肝臟指標(biāo)的測定
每周稱體質(zhì)量一次,22 周后,小鼠宰殺前禁食12 h,稱體質(zhì)量后摘眼球取血入抗凝管中,4 ℃、3 000 r/min離心10 min,取上層血漿,-80 ℃保存?zhèn)溆谩囝i處死,在冰浴上迅速取肝臟,精確稱質(zhì)量并記錄,并按照下式計(jì)算肝臟指數(shù)。
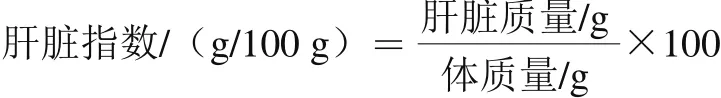
取部分肝臟組織加入預(yù)冷的生理鹽水,勻漿制得質(zhì)量濃度為0.1 g/mL的組織勻漿,測定ROS后3 000 r/min離心10 min后取上清液,-20 ℃保存用于測定抗氧化水平;取100 mg左右肝臟組織置于Trizol試劑中,剪碎,-80 ℃保存,用于總RNA的提取;取部分肝組織浸入質(zhì)量濃度為40 g/L多聚甲醛溶液中固定,4 ℃保存?zhèn)溆茫涣砣∠嗤课唬嗤笮「谓M織用OCT包埋劑(聚乙二醇和聚乙烯醇水溶性混合液)包埋,液氮速凍后轉(zhuǎn)至-80 ℃凍存,以備冷凍切片的制作。
T-AOC、MDA和GSH-Px水平的測定均嚴(yán)格按照試劑盒說明書進(jìn)行操作。
將50 mg小鼠凍存肝臟組織置于具有1 mL異丙醇中勻漿并進(jìn)行超聲處理,勻漿經(jīng)2 000×g離心,取上清液,嚴(yán)格按照TC和TG試劑盒測定肝臟TC和TG濃度。
1.3.3 肝臟HE和油紅O染色
HE染色:甲醛固定后的肝臟組織進(jìn)行乙醇梯度脫水,二甲苯透明,浸入石蠟包埋,預(yù)冷后切片(厚度5 μm)。嚴(yán)格按照試劑盒說明書將切片進(jìn)行HE染色,滴少許中性樹膠封片,自然通風(fēng)晾干,收集并鏡檢(200×)。
油紅O染色:將-80 ℃下OCT包埋備用的肝組織樣品固定在速凍臺上,調(diào)整合適的距離,切片厚度設(shè)為9 μm。嚴(yán)格按照試劑盒說明書進(jìn)行進(jìn)行油紅O染色,染色后滴適量水性固定液封片,自然通風(fēng)晾干,收集并鏡檢(200×)。用Image-Pro圖像軟件進(jìn)行分析,計(jì)算肝臟脂肪浸潤面積占整個視野面積的比例。
1.3.4 血漿指標(biāo)測定
T-AOC、ROS、MDA、GSH-Px、TG、TC、HDL、LDL和FFA水平均按照試劑盒說明書進(jìn)行操作。
1.3.5 肝臟總RNA的提取及反轉(zhuǎn)錄
用Trizol法提取肝臟中的總RNA,然后加入適量DEPC水稀釋,通過測定溶液吸光度A260nm/A280nm比值確定所得RNA的純度,測得A260nm/A280nm在1.8~2.0時(shí)可用于下一步實(shí)驗(yàn)。
取2.0 μg模板RNA,加入Oligo(dT) 2.0 μL、dNTP 2.0 μL、DEPC水4 μL,于70 ℃中水浴5 min,然后置于冰上冷卻;加入5×逆轉(zhuǎn)錄緩沖液5.0 μL、M-MLV逆轉(zhuǎn)錄酶0.5 μL、RNase抑制劑0.25 μL、DEPC水9.25 μL。擴(kuò)增條件為:37 ℃,1.5 h;95 ℃,5 min;4 ℃冷卻。反轉(zhuǎn)錄所得cDNA于-20 ℃存放備用。
1.3.6 qPCR擴(kuò)增
根據(jù)試劑盒說明書,以β-肌動蛋白為內(nèi)標(biāo),測定脂肪酸合成酶(fatty acid synthase,F(xiàn)AS)、乙酰輔酶A羧化酶(acetyl CoA-carboxylase 1,ACC-1)、固醇調(diào)節(jié)元件結(jié)合蛋白1c(sterol regulatory element-binding protein 1c,SREBP1c)、膽固醇7α-羥化酶(cholesterol 7α-hydroxylase,CYP7A1)、對肉堿酰基轉(zhuǎn)移酶1(carnitine palmityl transferase 1,CPT1)和過氧化物酶體增殖物激活受體α(peroxisome proliferator activated receptor α,PPARα)mRNA的表達(dá)量,引物如表2所示。

表2 qPCR引物序列Table 2 Sequences of primers used for qPCR
使用ABI 7900 HT FAST qPCR儀檢測各模板的Ct值,通過2-△△Ct法計(jì)算,進(jìn)行相對定量,反應(yīng)體系如下:取0.5 μL cDNA模板,加入0.4 μL上游引物(10 μmol/L)、0.4 μL下游引物(10 μmol/L)、5.0 μL SYBR Green Master Mix和3.7 μL無菌水,形成10 μL體系。擴(kuò)增條件如下:95 ℃預(yù)變性5 min,95 ℃變性20 s,62 ℃退火30 s,72 ℃延伸20 s,以上步驟循環(huán)40 次;72 ℃終末延伸2 min;4 ℃冷卻恒定。
1.4 數(shù)據(jù)統(tǒng)計(jì)分析
采用SPSS 17.0軟件對數(shù)據(jù)進(jìn)行方差分析和獨(dú)立樣本t檢驗(yàn),實(shí)驗(yàn)均設(shè)9 組平行,結(jié)果以 ±s表示,P<0.05或P<0.01時(shí),判斷組間差異具有統(tǒng)計(jì)學(xué)意義。
2 結(jié)果與分析
2.1 飲食MR和膠原蛋白肽對高脂飲食小鼠體質(zhì)量的影響
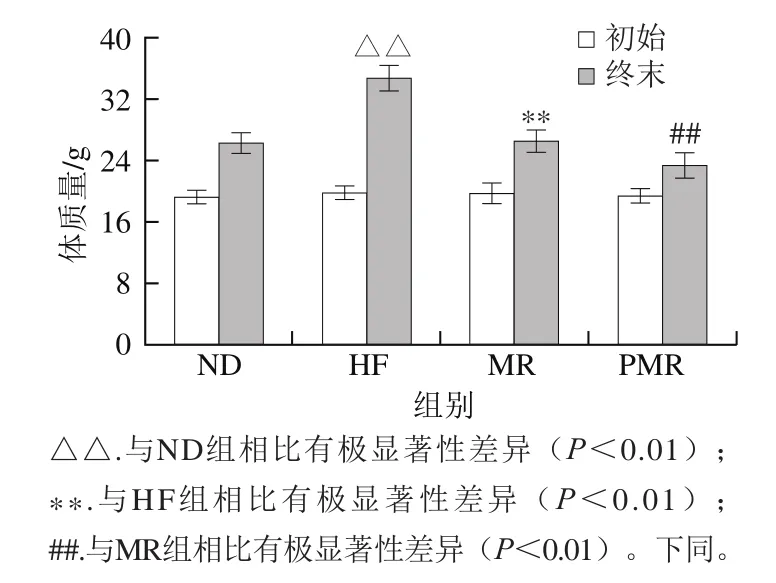
圖1 蛋氨酸限制及膠原蛋白肽的干預(yù)對高脂飲食小鼠體質(zhì)量的影響Fig. 1 Effects of MR and collagen peptides on body weight in HFD-fed mice
由圖1可知,各組小鼠初始體質(zhì)量沒有顯著性差異(P>0.05)。至第22周實(shí)驗(yàn)結(jié)束時(shí),與ND組相比,HF組小鼠體質(zhì)量極顯著增加(P<0.01);與HF組相比,MR組小鼠體質(zhì)量極顯著降低(P<0.01);與MR組相比,PMR組小鼠體質(zhì)量極顯著降低(P<0.01)。
2.2 飲食MR和膠原蛋白肽對高脂飲食小鼠采食量的影響
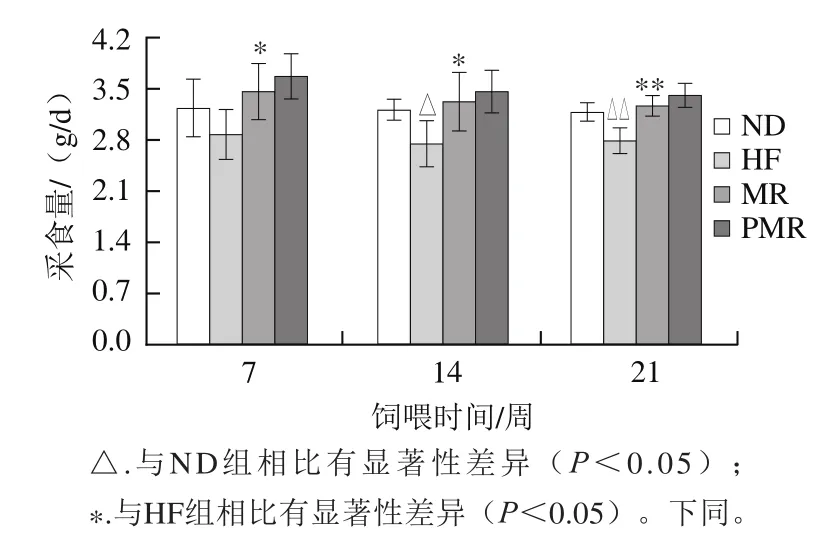
圖2 蛋氨酸限制及膠原蛋白肽的干預(yù)對高脂飲食小鼠采食量的影響Fig. 2 Effects of MR and collagen peptides on food intake of HFD-fed mice
由圖2可知,與ND組相比,HF組小鼠在第14周采食量顯著降低(P<0.05),第21周采食量極顯著降低(P<0.01);與HF組相比,MR組小鼠在第7周和第14周采食量顯著增加(P<0.05),第21周極顯著增加(P<0.01);與MR組相比,PMR組小鼠采食量在各周期無顯著性差異(P>0.05)。
2.3 飲食MR和膠原蛋白肽對高脂飲食小鼠肝臟質(zhì)量和肝臟指數(shù)的影響

圖3 蛋氨酸限制及膠原蛋白肽的干預(yù)對高脂飲食小鼠肝臟質(zhì)量(A)及肝臟指數(shù)(B)的影響Fig. 3 Effects of MR and collagen peptides on liver weight (A) and index (B) in HFD-fed mice
由圖3可知,與ND組相比,HF組小鼠肝臟質(zhì)量極顯著增加(P<0.01),肝臟指數(shù)無顯著性差異(P>0.05);與HF組相比,MR組極顯著降低了高脂飲食小鼠的肝臟質(zhì)量(P<0.01),肝臟指數(shù)有下降趨勢,但無顯著性差異(P>0.05);與MR組相比,PMR組小鼠肝臟質(zhì)量極顯著降低(P<0.01),肝臟指數(shù)有下降趨勢,但沒有顯著性差異(P>0.05)。
2.4 飲食MR和膠原蛋白肽對高脂飲食小鼠肝臟組織形態(tài)的影響
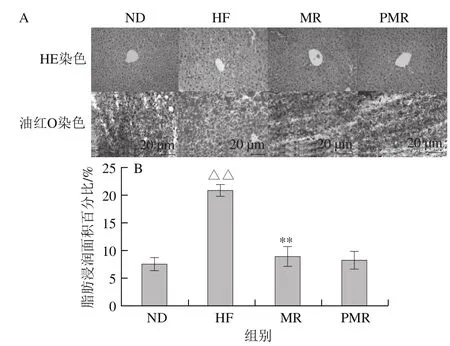
圖4 HE和油紅O染色(A)及油紅O染色中脂肪浸潤面積百分比(B)Fig. 4 HE and oil red O staining (A) and lipid accumulation of liver tissue (B) in HFD-fed mice
由圖4A可知,HF組小鼠肝臟脂肪大量囤積,肝細(xì)胞體積膨大,細(xì)胞內(nèi)明顯發(fā)生脂肪變性;ND組、MR組和PMR組小鼠肝細(xì)胞形態(tài)結(jié)構(gòu)清晰完整、排列緊密,細(xì)胞內(nèi)有極少量脂肪空泡。肝臟冷凍切片經(jīng)油紅O染色,通過Image-Pro圖像分析軟件測量冷凍切片相同視野中脂肪細(xì)胞浸潤所占比例,量化肝臟脂肪積累的情況。由圖4B可知,與ND組相比,HF組小鼠肝臟脂肪浸潤面積百分比極顯著增加(P<0.01);與HF組相比,MR組小鼠肝臟脂肪浸潤面積百分比極顯著降低(P<0.01);與MR組相比,PMR組小鼠肝臟脂肪浸潤面積百分比無顯著性差異(P>0.05)。
2.5 飲食MR和膠原蛋白肽對高脂飲食小鼠肝臟TG和TC濃度的影響

圖5 蛋氨酸限制及膠原蛋白肽的干預(yù)對高脂飲食小鼠肝臟TG(A)及TC(B)濃度的影響Fig. 5 Effects of MR and collagen peptides on TG (A) and TC (B)levels in liver of HFD-fed mice
由圖5可知,與ND組相比,HF組小鼠肝臟TG和TC
濃度極顯著增加(P<0.01);與HF組相比,MR組小鼠肝臟TG和TC濃度極顯著降低(P<0.01);與MR組相比,PMR組小鼠肝臟TG濃度極顯著下降(P<0.01),
TC濃度無顯著性差異(P>0.05)。
2.6 飲食MR和膠原蛋白肽對高脂飲食小鼠血脂的影響

表3 蛋氨酸限制及膠原蛋白肽對高脂飲食小鼠血脂的影響Table 3 Effects of MR and collagen peptides on plasma lipid profile of HFD-fed mice mmol/L
由表3可知,與ND組相比,HF組小鼠血漿TG、TC和FFA濃度極顯著增加(P<0.01),LDL濃度顯著增加(P<0.05),HDL濃度顯著降低(P<0.05);與HF組相比,MR組小鼠血漿TC和LDL濃度極顯著下降(P<0.01),TG和FFA濃度顯著下降(P<0.05),HDL濃度極顯著增加(P<0.01);與MR組相比,PMR組小鼠血漿TG和TC濃度顯著下降(P<0.05),HDL、LDL和FFA濃度沒有顯著性差異(P>0.05)。
2.7 飲食MR和膠原蛋白肽對高脂飲食小鼠脂代謝相關(guān)基因表達(dá)的影響
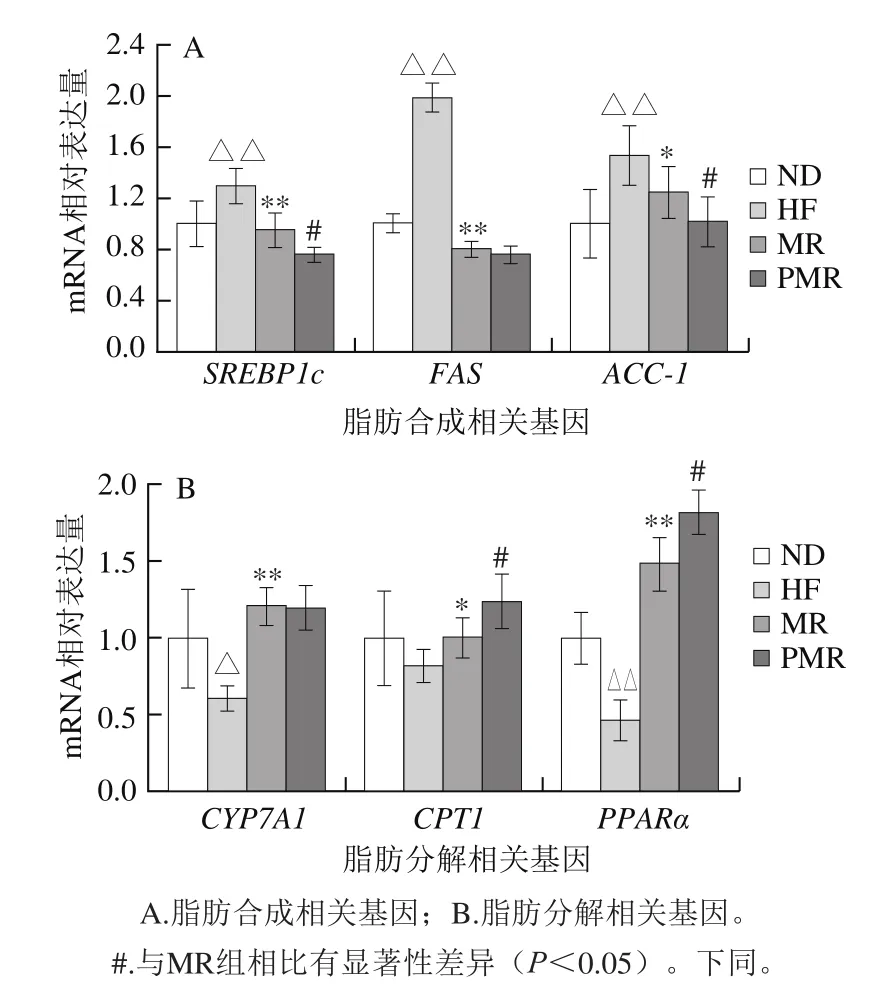
圖6 蛋氨酸限制及膠原蛋白肽對高脂飲食小鼠脂代謝相關(guān)基因的影響Fig. 6 Effects of MR and collagen peptides on the expression of key lipid metabolism genes in liver
由圖6可知,與ND組相比,HF組小鼠肝臟脂肪合成相關(guān)基因SREBP1c、FAS和ACC-1 mRNA表達(dá)極顯著上調(diào)(P<0.01),脂肪分解相關(guān)基因CYP7A1 mRNA表達(dá)顯著下調(diào)(P<0.05),PPARα mRNA表達(dá)極顯著下調(diào)(P<0.01);與HF組相比,MR組小鼠肝臟脂肪合成相關(guān)基因FAS和SREBP1c mRNA表達(dá)極顯著下調(diào)(P<0.01),ACC-1 mRNA表達(dá)顯著下調(diào)(P<0.05),脂肪分解相關(guān)基因CYP7A1和PPARα mRNA表達(dá)極顯著上調(diào)(P<0.01),CPT1 mRNA表達(dá)顯著上調(diào)(P<0.05);與MR組相比,PMR組小鼠肝臟脂肪合成相關(guān)基因SREBP1c和ACC-1 mRNA表達(dá)顯著下調(diào)(P<0.05),F(xiàn)AS mRNA表達(dá)無顯著性差異(P>0.05),脂肪分解相關(guān)基因CPT1和PPARα mRNA表達(dá)顯著上調(diào)(P<0.05),CYP7A1 mRNA表達(dá)無顯著性差異(P>0.05)。
2.8 飲食MR和膠原蛋白肽對高脂飲食小鼠肝臟氧化還原指標(biāo)的影響

表4 蛋氨酸限制和膠原蛋白干預(yù)對小鼠肝臟氧化還原狀態(tài)的影響Table 4 Effects of MR and collagen peptides on hepatic redox indicators in HFD-fed mice
由表4可知,與ND組相比,HF組小鼠肝臟T-AOC和GSH-Px活力極顯著降低(P<0.01),ROS和MDA含量極顯著增加(P<0.01);與HF組相比,MR組小鼠肝臟T-AOC和GSH-Px活力顯著增加(P<0.05),ROS和MDA含量極顯著降低(P<0.01);與MR組相比,PMR組小鼠肝臟GSH-Px活力顯著增加(P<0.05),T-AOC、MDA和ROS含量無顯著性差異(P>0.05)。
2.9 飲食MR和膠原蛋白肽對高脂飲食小鼠血漿和血液氧化還原指標(biāo)的影響
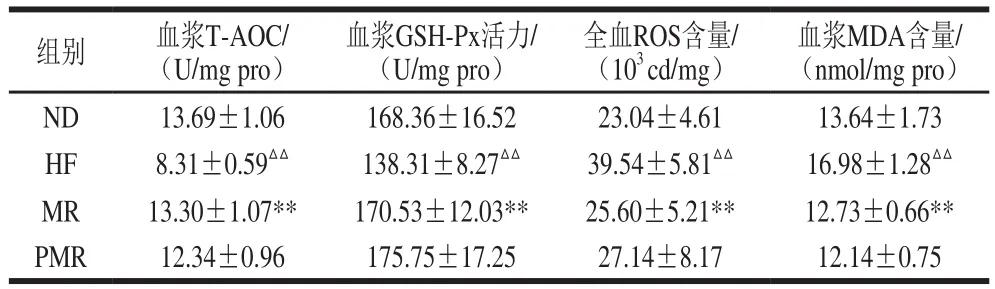
表5 蛋氨酸限制和膠原蛋白干預(yù)對小鼠血漿和血液氧化還原狀態(tài)的影響Table 5 Effects of MR and collagen peptides on redox indicators of plasma and blood in HFD-fed mice
由表5可知,與ND組相比,HF組小鼠血漿T-AOC和GSH-Px活力極顯著降低(P<0.01),全血ROS和血漿MDA含量極顯著增加(P<0.01);與HF相比,MR組小鼠血漿T-AOC和GSH-Px活力極顯著增加(P<0.01),全血ROS和血漿MDA含量極顯著降低(P<0.01);與MR相比,PMR組小鼠血漿T-AOC、GSH-Px活力、MDA含量和全血ROS含量無顯著性差異(P>0.05)。
3 討 論
本研究顯示,飲食MR顯著抑制了高脂飲食小鼠體質(zhì)量的增加,此結(jié)果與Malloy[4]、Ables[7]等研究結(jié)果一致。相比飲食MR,飲食MR和膠原蛋白肽的聯(lián)合作用顯著降低了小鼠體質(zhì)量的增長,對高脂飲食小鼠體質(zhì)量的降低有更顯著的效果。
肥胖患者一般都存在脂代謝紊亂,脂代謝紊亂最直觀的表現(xiàn)就是血脂(包括TC、TG、HDL-C和LDL-C等)異常。脂類的消化、吸收、運(yùn)輸、分解代謝和合成代謝,都與肝臟有著密切的關(guān)系[19],血漿中脂質(zhì)的變化通常預(yù)示肝臟脂肪的生成或分解的變化。研究表明飲食MR除了可以顯著降低血漿TG和TC的水平[4],還可以顯著減少小鼠[20]和大鼠[21]肝臟脂肪的積累。本實(shí)驗(yàn)結(jié)果證實(shí)了飲食MR可以顯著降低血漿和肝臟TG和TC的含量、血漿LDL-C和FFA水平,顯著增加血漿HDL-C含量。膠原蛋白肽對于脂類代謝調(diào)控的積極作用也已經(jīng)有實(shí)驗(yàn)證實(shí)[16]。相比飲食MR組,飲食PMR組血漿TG和TC含量顯著下降,肝臟TG含量顯著下降,說明飲食MR和膠原蛋白聯(lián)合作用能夠更顯著改善高脂飲食小鼠血脂的異常和脂代謝的紊亂。
動物脂肪代謝與脂肪的合成、分解過程息息相關(guān)。有研究表明,飲食MR調(diào)控脂代謝合成和分解基因,改善肝臟脂代謝[22]。本實(shí)驗(yàn)研究也證實(shí)飲食MR可以顯著下調(diào)小鼠肝臟脂肪合成相關(guān)基因(FAS、ACC-1和SREBP1c)的表達(dá),顯著上調(diào)脂肪分解相關(guān)基因(CYP7A1、CPT1和PPARα)的表達(dá)。相比飲食MR組,飲食PMR組血漿TG和TC含量顯著降低,肝臟TG水平顯著下降,其原因一方面與脂肪合成相關(guān)基因(SREBP1c和ACC-1)表達(dá)顯著下調(diào)有關(guān),SREBP1c是重要的核轉(zhuǎn)錄因子之一,能與脂質(zhì)合酶基因的啟動子/增強(qiáng)子的固醇調(diào)節(jié)元件結(jié)合,激活靶基因轉(zhuǎn)錄,特異性調(diào)控膽固醇和脂肪酸代謝[23-24];ACC-1是脂肪酸合成限速酶,催化脂肪酸合成的第一步反應(yīng)[25]。通過下調(diào)ACC-1和SREBP1c的mRNA表達(dá),說明飲食MR和膠原蛋白肽聯(lián)合作用可以下調(diào)脂肪合成相關(guān)基因,在轉(zhuǎn)錄水平進(jìn)一步抑制了肝臟脂肪的合成,進(jìn)而抑制血脂的升高;另一方面與PMR組脂肪分解相關(guān)基因(PPARα和CPT1)的顯著上調(diào)有關(guān)。PPARα作為過氧化物酶體增殖物激活受體(peroxisome proliferator activated receptors,PPARs)中的一個亞型,激活后可調(diào)節(jié)包括脂肪酸攝取、結(jié)合、氧化及脂質(zhì)運(yùn)輸在內(nèi)的許多基因的表達(dá),可有效改善血脂狀況,調(diào)節(jié)脂質(zhì)代謝平衡[26]。CPT-1是脂肪酸氧化的限速酶,可以使長鏈的乙酰輔酶A進(jìn)入線粒體,促進(jìn)脂肪酸β氧化[27],通過PPARα和CPT1表達(dá)的顯著上調(diào),在轉(zhuǎn)錄水平刺激β氧化,降低脂肪酸的水平,抑制TG合成,可能進(jìn)一步降低體質(zhì)量的增長,抑制高脂飲食條件下肥胖的發(fā)生。而CPT1和PPARα作為腺苷酸激活蛋白激酶(AMP-activated protein kinase,AMPK)的下游基因,可能通過激活A(yù)MPK途徑,AMPK還可以通過抑制ACC-1的活性,減少丙二酰輔酶A的生成,從而解除丙二酰輔酶A對CPT1的抑制作用,抑制合成途徑的同時(shí)激活分解途徑,與機(jī)體肝臟脂肪變性有密切的關(guān)系,MR與膠原蛋白肽的聯(lián)合作用對于AMPK途徑的影響還需要進(jìn)一步驗(yàn)證。
越來越多研究表明,高脂飲食的攝取和脂肪組織的積聚可以顯著增加機(jī)體的氧化應(yīng)激水平[28]。ROS和MDA水平的顯著增加,阻礙了線粒體對脂肪酸的氧化產(chǎn)能,導(dǎo)致血脂代謝異常,脂肪酸調(diào)節(jié)失衡。已經(jīng)有研究證實(shí)飲食MR可以顯著改善高脂飲食條件下機(jī)體氧化還原狀態(tài)的失衡[29],本實(shí)驗(yàn)研究表明飲食MR可以顯著提高高脂飲食小鼠肝臟組織和血漿中T-AOC和GSH-Px的活力,降低血漿過氧化脂質(zhì)產(chǎn)物MDA含量和全血ROS含量,也說明MR可以顯著降低高脂飲食小鼠的氧化應(yīng)激反應(yīng),提高機(jī)體的抗氧化能力;相比飲食MR,飲食MR和膠原蛋白的聯(lián)合作用可以顯著提高肝臟組織GSH-Px的活力,說明飲食MR和膠原蛋白的聯(lián)合作用可能可以更有效改善高脂飲食誘導(dǎo)的氧化應(yīng)激,促進(jìn)機(jī)體抗氧化能力的提高,但其確切機(jī)制還需要進(jìn)一步研究。
綜上所述,本研究表明,飲食MR具有降低高脂飲食小鼠體質(zhì)量、血脂和肝臟脂肪積累,調(diào)節(jié)氧化應(yīng)激的作用;而飲食MR和膠原蛋白的聯(lián)合作用對于高脂飲食小鼠體質(zhì)量、血脂水平和肝臟脂肪積累的降低作用優(yōu)于飲食MR的單獨(dú)作用。因此飲食MR和膠原蛋白肽的聯(lián)合作用,對于肥胖的預(yù)防和控制具有非常重要的研究價(jià)值和廣闊的應(yīng)用前景。
參考文獻(xiàn):
[1] REDINGER R N. Fat storage and the biology of energy expenditure[J].Translational Research, 2009, 154(2): 52-60. DOI:10.1016/j.trsl.2009.05.003.
[2] NG M, FLEMING T, ROBINSON M, et al. Global, regional, and national prevalence of overweight and obesity in children and adults during 1980—2013: a systematic analysis for the Global Burden of Disease Study 2013[J]. The Lancet, 2014, 384: 766-781. DOI:10.1016/S0140-6736(14)60460-8.
[3] 李興太, 紀(jì)瑩. 線粒體氧化應(yīng)激與天然抗氧化劑研究進(jìn)展[J]. 食品科學(xué), 2015, 36(7): 268-277. DOI:10.7506/spkx1002-6630-201507049.
[4] MALLOY V L, KRAJCIK R A, BAILEY S J, et al. Methionine restriction decreases visceral fat mass and preserves insulin action in aging male Fischer 344 rats independent of energy restriction[J]. Aging Cell, 2006, 5(4): 305-314. DOI:10.1111/j.1474-9726.2006.00220.x.
[5] PERRONE C E, MATTOCKS D A L, JARVIS-MORAR M, et al.Methionine restriction effects on mitochondrial biogenesis and aerobic capacity in white adipose tissue, liver, and skeletal muscle of F344 rats[J].Metabolism, 2010, 59(7): 1000-1011. DOI:10.1016/j.metabol.2009.10.023.
[6] HASEK B E, STEWART L K, HENAGAN T M, et al. Dietary methionine restriction enhances metabolic flexibility and increases uncoupled respiration in both fed and fasted states[J]. American Journal of Physiology Regulatory, Integrative and Comparative Physiology, 2010, 299(3): 728-739. DOI:10.1152/ajpregu.00837.2009.[7] ABLES G P, PERRONE C E, ORENTREICH D, et al. Methioninerestricted C57BL/6J mice are resistant to diet-induced obesity and insulin resistance but have low bone density[J]. PLoS ONE, 2012,7(12): 1-12. DOI:10.1371/journal.pone.0051357.
[8] WANDERS D, GHOSH S, STONE K P, et al. Transcriptional impact of dietary methionine restriction on systemic inflammation: relevance to biomarkers of metabolic disease during aging[J]. Biofactors, 2014,40(1): 13-26. DOI:10.1002/biof.1111.
[9] ORGERON M L, STONE K P, WANDERS D, et al. The impact of dietary methionine restriction on biomarkers of metabolic health[J].Progress in Molecular Biology and Translational Science, 2014, 121:351-376. DOI:10.1016/B978-0-12-800101-1.00011-9.
[10] ORENTREICH N, MATIAS J R, DEFELICE A, et al. Low methionine ingestion by rats extends life span[J]. Journal of Nutrition, 1993,123(2): 269-274.
[11] JOHNSON J E, JOHNSON F B. Methionine restriction activates the retrograde response and confers both stress tolerance and lifespan extension to yeast, mouse and human cells[J]. PLoS ONE, 2014, 9(5):e97729. DOI:10.1371/journal.pone.0097729.
[12] 朱科學(xué), 聶少平, 宋丹, 等. 黑靈芝多糖對Ⅱ型糖尿病大鼠血糖、血脂及腸系膜上動脈病變改善作用[J]. 食品科學(xué), 2013, 34(23): 300-304. DOI:10.7506/spkx1002-6630-201323060.
[13] 劉冠星, 韓寧寧, 馬海田. 藤黃果提取物對雄性大鼠脂代謝的影響及降脂機(jī)理[J]. 食品科學(xué), 2015, 36(9): 202-208. DOI:10.7506/spkx1002-6630-201509038.
[14] 趙利, 蘇偉, 胡火根, 等. 膠原蛋白生物活性肽的研究進(jìn)展[J]. 食品科學(xué), 2005, 26(9): 560-564.
[15] 周先艷, 樊建, 唐遠(yuǎn)龍, 等. 羅非魚皮膠原蛋白水解產(chǎn)物的體外抗氧化活性和體內(nèi)抗衰老作用[J]. 食品科學(xué), 2016, 37(15): 221-226.DOI:10.7506/spkx1002-6630-201615037.
[16] 李亞欣, 施用暉, 王潔昀, 等. 膠原蛋白肽對高脂日糧小鼠抗氧化能力和血脂代謝的影響[J]. 天然產(chǎn)物研究與開發(fā), 2011, 23(1): 54-58; 68.
[17] 張鶴, 趙雨, 徐云鳳, 等. 鹿骨膠原蛋白對去卵巢所致骨質(zhì)疏松大鼠的治療作用[J]. 中藥藥理與臨床, 2011(5): 76-79. DOI:10.13412/j.cnki.zyyl.2011.05.027.
[18] GUILLERMINET F, BEAUPIED H, FABIEN-SOULE V, et al.Hydrolyzed collagen improves bone metabolism and biomechanical parameters in ovariectomized mice: an in vitro and in vivo study[J].Bone, 2010, 46(3): 827-834. DOI:10.1016/j.bone.2009.10.035.
[19] PONZIANI F R, PECERE S, GASBARRINI A, et al. Physiology and pathophysiology of liver lipid metabolism[J]. Expert Review of Gastroenterology & Hepatology, 2015, 9(8): 1055-1067. DOI:10.1586/17474124.2015.1056156.
[20] ANTHONY T G, MORRISON C D, DGETTYS T W. Remodeling of lipid metabolism by dietary restriction of essential amino acids[J].Diabetes, 2013, 62(8): 2635-2644. DOI:10.2337/db12-1613.
[21] HASEK B E, BOUDREAU A, SHIN J, et al. Remodeling the integration of lipid metabolism between liver and adipose tissue by dietary methionine restriction in rats[J]. Diabetes, 2013, 62(10): 3362-3372. DOI:10.2337/db13-0501.
[22] ZHOU X H, HE L Q, WAN D, et al. Methionine restriction on lipid metabolism and its possible mechanisms[J]. Amino Acids, 2016, 48(7):1533-1540. DOI:10.1007/s00726-016-2247-7.
[23] HORTON J D, GOLDSTEIN J, LBROWN M S. SREBPs: activators of the complete program of cholesterol and fatty acid synthesis in the liver[J]. Journal of Clinical Investigation, 2002, 109(9): 1125-1131.DOI:10.1172/JCI15593.
[24] WANG Y, VISCARRA J, KIM S J, et al. Transcriptional regulation of hepatic lipogenesis[J]. Nature Reviews Molecular Cell Biology, 2015,16(11): 678-689. DOI:10.1038/nrm4074.
[25] WAKIL S J, ABU-ELHEIGA L A. Fatty acid metabolism: target for metabolic syndrome[J]. Journal of Lipid Research, 2009, 50(Suppl 1):138-143. DOI:10.1038/nrm4074.
[26] PERRONE C E, MALLOY V L, ORENTREICH D S, et al. Metabolic adaptations to methionine restriction that benefit health and lifespan in rodents[J]. Experimental Gerontology, 2013, 48(7): 654-660.DOI:10.1016/j.exger.2012.07.005.
[27] SCHLAEPFER I R, RIDER L, RODRIGUES L U, et al. Lipid catabolism via CPT1 as a therapeutic target for prostate cancer[J].Molecular Cancer Therapeutics, 2014, 13(10): 2361-2371.DOI:10.1158/1535-7163.MCT-14-0183.
[28] MILAGRO F I, CAMPIóN J, MARTíNEZ J A. Weight gain induced by high-fat feeding involves increased liver oxidative stress[J].Obesity, 2006, 14(7): 1118-1123. DOI:10.1038/oby.2006.128.
[29] SANCHEZ-ROMAN I, BARJA G. Regulation of longevity and oxidative stress by nutritional interventions: role of methionine restriction[J]. Expimental Gerontology, 2013, 48(10): 1030-1042.DOI:10.1016/j.exger.2013.02.021.

