醇胺類離子液體分離異丙醇-水的等壓氣液相平衡
張志剛, 李 月, 張親親, 許紅紅, 張愛笛, 李文秀, 張 弢
(沈陽化工大學 化學工程學院, 遼寧 沈陽 110142)
異丙醇是一種重要的有機化工原料,其用途廣泛,可用作溶劑、化學中間體、抗凍劑及分散劑等[1-2].異丙醇一般是由丙烯和水的水合反應制得,在一個大氣壓下產物異丙醇和水會在質量分數比為w異∶w水=87.4∶12.6的情況下形成共沸,使用普通的精餾方法很難得到高純度的異丙醇.目前分離異丙醇-水體系的方法包括加鹽萃取精餾[3-4]、加復合溶劑萃取精餾[5]、加有機溶劑萃取精餾[6-7]等.相較于傳統有機溶劑和無機鹽,離子液體作為一種新型的綠色溶劑,具有低腐蝕性、低揮發性、熱穩定性好以及良好的溶解能力等優點[8-9].目前已經有一些關于異丙醇-水體系含有離子液體的氣液相平衡數據的報道,如:[EMIM][BF4][10-12],[BMIM][BF4][13-14],[OMIM][BF4][15],[BMIM][Cl][16],[EMIM][OAc]、[BMIM][OAc]、[EMIM][Br][17],[BMIM][OAc][18]等.
醇胺類離子液體具有合成條件溫和,原料價格低廉,腐蝕性小,毒性小,且相較于其他類離子液體在結構上引入更多的羥基,更易于與水形成氫鍵,從而有利于提高異丙醇對水的相對揮發度等優點.本文選擇醇胺類離子液體作為萃取劑,選擇二乙醇胺乳酸鹽[DEA][Lc]及異丙醇-水-三乙醇胺乳酸鹽[TEA][Lc]兩種離子液體,在常壓(101.3 kPa)下,測定異丙醇-水-離子液體三元物系的等壓氣液平衡數據,并討論比較[DEA][Lc]和[TEA][Lc]對異丙醇-水物系的分離效果.
1 實驗部分
1.1 實驗原料
無水乙醇、異丙醇、二乙醇胺、三乙醇胺、乳酸:分析純,國藥集團化學試劑公司;二乙醇胺乳酸鹽、三乙醇胺乳酸鹽:實驗室自制,質量分數>99.5 %.
1.2 實驗裝置及分析方法
實驗中所用的氣液平衡釜為Othmer釜.采用稱重法配制試樣,電子天平為上海精科FA2004,精度為0.1 mg.實驗中用于分析氣液兩相樣品的裝置為安捷倫GC7890A氣相色譜儀,配置19091J-413色譜柱(長度為30 m,直徑0.32 mm)TCD檢測器檢測,載氣為氫氣.GC7890A的操作條件為:箱溫373 K,檢測器溫度為473 K.
配制一定比例的異丙醇、水和離子液體的混合溶液,將配置好的溶液加入到平衡釜中進行加熱,保持回流滴數在2~3 s 1滴,待溫度計示數保持30 min不變,即視為體系達到氣液相平衡,之后分別在平衡釜的氣相取樣口及液相取樣口抽取適量的氣相冷凝液及液相液體,并將取出的樣品分別放入頂空進樣瓶中,使用頂空進樣器進樣,用氣相色譜分析氣液相組分含量.
2 結果與討論
2.1 實驗裝置可靠性的檢驗
為驗證實驗裝置的可靠性,測定了異丙醇-水二元體系的等壓氣液平衡數據,將實驗值與文獻值進行比較,結果如圖1所示,其中:x1為液相中異丙醇的摩爾分數,y1為氣相中異丙醇的摩爾分數.由圖1可知:異丙醇-水二組分物系的等壓氣液平衡數據與文獻值[12]基本一致,說明該實驗裝置可靠.

圖1 在大氣壓(101.3 kPa)下異丙醇(1)-水(2) 體系的等壓氣液平衡相圖Fig.1 Isobaric vapor-liquid equilibria diagram for isopropanol(1)-water(2) system at atmospheric pressure(101.3 kPa)
2.2 氣液相平衡數據的測定
在101.3 kPa下,測定了異丙醇-水-[DEA][Lc](摩爾分數為0.1、0.2、0.3)和異丙醇-水-[TEA][Lc](摩爾分數為0.1、0.2、0.3)三元體系的等壓氣液平衡數據,其結果見表1和表2.

表1 在大氣壓(101.3 kPa)下異丙醇(1)-水(2)-[DEA] [Lc](3) 三組分體系的等壓氣液相平衡數據Table 1 Isobaric VLE data for isopropanol(1)-water(2)- [DEA][Lc](3) system at atmospheric pressure(101.3 kPa)
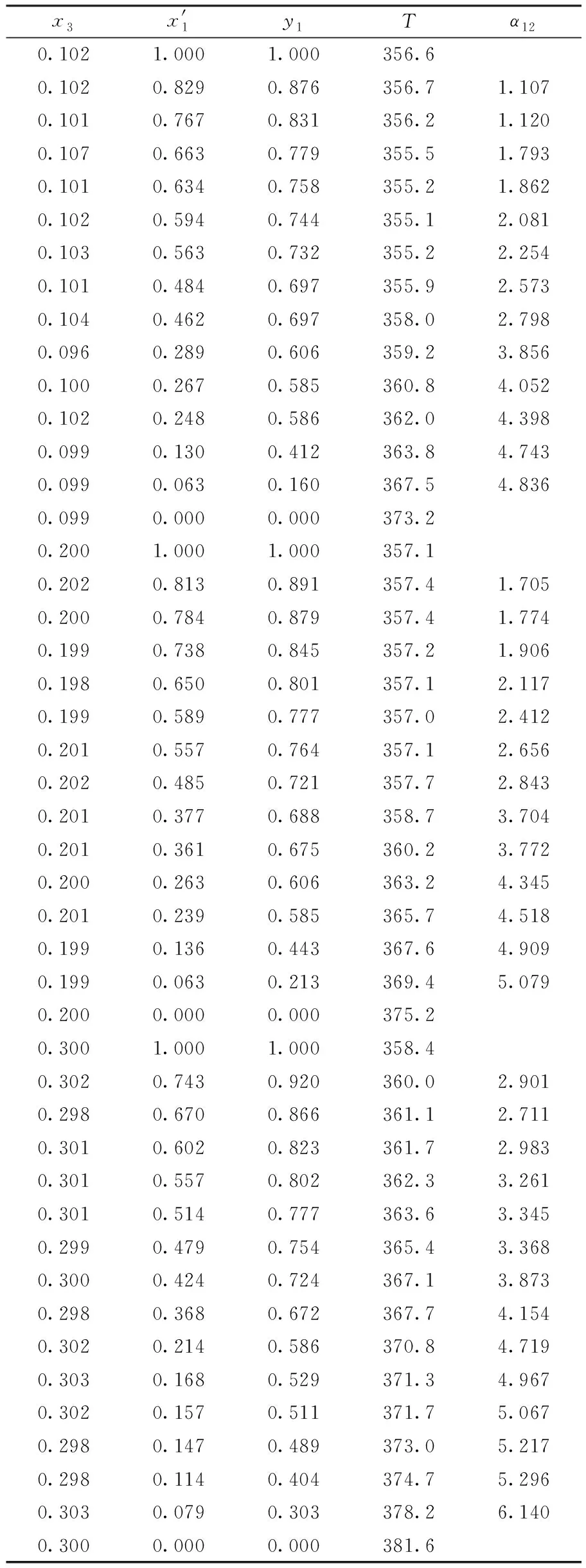
表2 在大氣壓(101.3 kPa)下異丙醇(1)-水(2)-[TEA] [Lc](3) 三組分體系的等壓氣液相平衡數據Table 2 Isobaric VLE data for isopropanol(1)-water(2)- [TEA][Lc](3) system at atmospheric pressure(101.3 kPa)

2.3 數據關聯
將實驗所得的氣液相平衡數據用NTRL[19]模型擬合,擬合結果見圖2、圖3,其中點為實驗值,實線為擬合值,從圖中可見擬合值與實際值非常接近,表明NRTL方程適合本實驗體系.NRTL方程有關的二元交互參數見表3.

圖2 異丙醇(1)-水(2)-[DEA][Lc](3) 三組分物系的氣液相平衡數據Fig.2 Isobaric VLE data for isopropanol(1)-water(2)- [DEA][Lc](3) system at atmospheric pressure(101.3 kPa)

圖3 異丙醇(1)-水(2)-[TEA][Lc](3)三組 分物系的氣液相平衡數據Fig.3 Isobaric VLE data for isopropanol(1)-water(2)- [TEA][Lc](3) system at atmospheric pressure(101.3 kPa)表3 NRTL方程的二元交互作用參數Table 3 Binary interaction parameters of NRTL model

組分i組分jαi,jΔgij/(J·mol-1)Δgji/(J·mol-1)異丙醇水0.3006 400.817.49異丙醇[DEA][Lc]0.018-8 458.27123.23水[DEA][Lc]0.755-16 990.6520 380.41異丙醇[TEA][Lc]0.300-6 255.6-1 185.4水[TEA][Lc]0.200-5 442.5-6 344.8
2.4 離子液體對異丙醇-水氣液相平衡的影響
由圖2、圖3可以看出:隨著[DEA][Lc]、[TEA][Lc]的加入,含離子液體的氣液相平衡曲線均較異丙醇-水二組分物系的氣液相平衡曲線遠離對角線.且隨著所含離子液體的摩爾分數的增加,氣液相平衡曲線偏離程度越大.[DEA][Lc]在摩爾分數為0.2時打破共沸,[TEA][Lc]在0.1時打破共沸.由此證明,[TEA][Lc]分離異丙醇-水二組分物系的效果強于[DEA][Lc].
對于兩種醇胺類離子液體[DEA][Lc]和[TEA][Lc],陰離子均為乳酸,陽離子分別為二乙醇胺與三乙醇胺,二乙醇胺與三乙醇胺均含有親水性基團—OH,在一定程度上由于氫鍵作用均能對水有一定的“捆綁”作用.這就說明了為什么醇胺類離子液體能夠提高異丙醇對水的相對揮發度.可能是因為三乙醇胺在結構式上比二乙醇胺多了一個羥基,所以,三乙醇胺與水形成的氫鍵要比二乙醇胺強,對水的“捆綁”作用比二乙醇胺強,因此,三乙醇胺的分離效果比二乙醇胺好.
3 結 論
在101.3 kPa下,測定了離子液體摩爾分數分別為 0.1、0.2、0.3 時異丙醇-水-[DEA][Lc]和異丙醇-水-[TEA][Lc]兩個三組分物系的等壓氣液平衡數據;采用NRTL模型對實驗數據進行關聯;[DEA][Lc]和[TEA][Lc]都能夠提高異丙醇對水的相對揮發度,且相對揮發度隨著離子液體含量的增大而增加,最終都能完全打破異丙醇-水的共沸;[TEA][Lc]分離異丙醇-水體系的效果強于[DEA][Lc].
:
[1] 胡紅嫣.異丙醇的應用及國內外市場[J].當代石油石化,2003,11(5):17-20.
[2] 崔小明,李明.異丙醇的生產技術及國內市場分析[J].石油化工,2008,37(Z):190-192.
[3] 雷志剛,周榮琪,葉堅強,等.加鹽反應萃取精餾分離醇水溶液[J].化學工業與工程,2001,18(5):290-294.
[4] 許文友,袁希鋼.正丙醇-水-鉀鹽和異丙醇-水-鉀鹽體系液液相平衡數據的測定和理論計算[J].化學工程,2004,32(1):65-68.
[5] 鮑靜,張雅明,金鑫.異丙醇-水-含鹽復合溶劑體系汽液平衡[J].高校化學工程學報,2005,19(2):258-262.
[6] ZHANG L Z,ZHANG W D,YANG B.Experimental Measurement and Modeling of Ternary Vapor-Liquid Equilibrium for Water + 2-Propanol + Glycerol[J].Journal of Chemical & Engineering Data,2014,59(11):3825-3830.
[7] ZHANG L Z,WANG X C,ZHU X M,et al.Experimental Measurement and Modeling of Vapor-Liquid Equilibrium for the Ternary Systems Water + Ethanol + Ethylene Glycol,Water + 2-Propanol + Ethylene Glycol,and Water +1-Propanol + Ethylene Glycol[J].Journal of Chemical & Engineering Data,2016,61(7):2596-2604.
[8] PLECHKOVA N V,SEDDON K R.Applications of Ionic Liquids in the Chemical Industry[J].Chemical Society Reviews,2008,37(1):123-150.
[9] HAN X,ARMSTRONG D W.Ionic Liquids in Separations[J].Accounts of Chemical Research,2007,40(11):1079-1086.
[10] 李群生,邢風英,雷志剛.異丙醇-水-1-乙基-3-甲基四氟硼酸咪唑鹽物系等壓汽液平衡數據的測定[J].石油化工,2008,37(1):67-71.
[11] ZHANG L,HAN J,WANG R,et al.Isobaric Vapor-Liquid Equilibria for Three Ternary Systems:Water + 2-Propanol + 1-Ethyl-3-Methylimidazolium Tetrafluoroborate,Water + 1-Propanol + 1-Ethyl-3-Methylimidazolium Tetrafluoroborate,and Water + 1-Propanol + 1-Butyl-3-Methylimidazolium Tetrafluoroborate[J].Journal of Chemical & Engineering Data,2007,52(4):1401-1407.
[12] LI Q S,XING F Y,LEI Z G,et al.Isobaric Vapor-Liquid Equilibrium for Isopropanol+Water+1-Ethyl-3-Methylimidazolium Tetrafluoroborate[J].Journal of Chemical & Engineering Data,2008,53(1):275-279.
[13] NAVARRO P,LARRIBA M,GARCA S,et al.Physical Properties of Binary and Ternary Mixtures of 2-Propanol,Water,and 1-Butyl-3-Methylimidazolium Tetrafluoroborate Ionic Liquid[J].Journal of Chemical & Engineering Data,2012,57(4):1165-1173.
[14] LI Q S,ZHANG J G,LEI Z G,et al.Isobaric Vapor-Liquid Equilibrium for(Propan-2-ol+Water+1-Butyl-3-Methylimidazolium Tetrafluoroborate)[J].Journal of Chemical & Engineering Data,2009,54(9):2785-2788.
[15] 李群生,黃小僑,張繼國,等.異丙醇-水-1-辛基-3-甲基四氟硼酸咪唑鹽物系等壓汽液平衡數據的測定[J].北京化工大學學報(自然科學版),2010,37(3):1-5.
[16] DENG D S,QIAO Y Z,JI D X,et al.Measurement and Modeling of Vapor-Liquid Equilibrium for Ternary System Water + 2-Propanol + 1-Butyl-3-Methylimidazolium Chloride[J].Chinese Journal of Chemical & Engineering Data,2014,22(2):164-169.
[17] ZHANG Z,ZHANG L,ZHANG Q,et al.Separation of 2-Propanol and Water Azeotropic System Using Ionic Liquids as Entrainers[J].Fluid Phase Equilibria,2016,412:94-100.
[18] DENG D S,WANG R F,ZHANG L Z,et al.Vapour-Liquid Equilibrium Measurements and Modelling for the Ternary System(Water+2-Propanol+1-Butyl-3-Methylimidazolium Acetate)[J].Physics and Chemistry of Liquids,2012,50(4):504-512.
[19] 焦真,馬少玲,王兵,等.用NRTL方程關聯和預測離子液體-醇-水體系的液液相平衡[J].化工學報,2006,57(12):2801-2805.

