UtA-PI、MAP和PLGF對不同孕期子癇前期診斷意義
季建生,汪鋒平
(衢州市人民醫院產科,浙江 衢州 324000)
妊娠期高血壓疾病是婦女妊娠期尤其是高齡產婦較為常見的特發性的多臟器損傷性疾病,是導致孕產婦和圍產兒病死率的主要原因。目前認為,子宮螺旋動脈重鑄障礙以及有害因子進入母體血液循環是導致妊娠高血壓疾病發生發展的病理基礎[1]。國內外學者將尋找診斷妊娠高血壓疾病的指標作為研究重點,其中胎盤生長因子(placenta growth factor,PLGF )成為部分歐洲國家篩查子癇前期 (pre-eclampsia,PE)的輔助診斷指標[2]。國外學者也針對子宮動脈搏動指數(uterine arterial pulsatility index,UtA-PI)、平均動脈壓( mean arterial blood pressure,MAP)在孕12、22、32及36周對PE的診斷價值,發現孕32、36周UtA-PI、MAP聯合母體因素對PE的診斷價值較高[3-4],但國內對于采用妊娠不同階段PLGF、MAP及UtA-PI對PE的診斷研究報道較少。本研究旨在探討上述三種指標對妊娠高血壓疾病的診斷價值,尤其是在整個孕期哪一階段檢測最有價值做了探討,以期為臨床有效篩查妊娠高血壓疾病提供依據。
1資料與方法
1.1臨床資料
選擇2014年5月至2016年6月在衢州市人民醫院產科建卡的孕婦828例,建卡時孕周為9~11周,平均(9.67±0.49)周,年齡在23~36歲,平均(28.24±1.97)歲,其中742例為初產婦,86例為經產婦,所有均為單胎妊娠。既往未出現高血壓、糖尿病、心臟病、系統性紅斑狼瘡、HELLP(注釋:HELLP綜合征主要是以溶血(hemoysis)、肝轉氨酶升高(elvated liver enzymes)、血小板減少(low platelets)為特點,是妊娠高血壓最為常見的并發癥,綜合征、高血脂以及肝腎不全疾病等癥狀,所有孕婦均在本院定期行產科檢查并且在我院分娩。828例孕婦中發展為妊娠高血壓疾病的73例,發生率為8.81%,73例患者中32例為妊娠期高血壓(gestational hypertension,GH),41例為PE,確診時孕周在31~42+6周,平均孕周(35.21±5.98)周。所有患者根據是否出現子癇前期分為三組,即正常妊娠組(NC組)755例,GH組32例,PE組41例。所有研究對象均在建卡簽訂知情同意書,并定期來我院接受產科檢查,同時在我院分娩或者終止妊娠。所有入選對象孕周按照我院醫師要求分為早期(11~13+6周)、中期(19~24+6周)、晚期(30~34+6周)。
1.2 GH與PE的診斷標準和納入標準
GH的診斷標準為:妊娠20周以后新出現的高血壓(收縮壓在140mmHg或者舒張壓在90mmHg及以上),并于產后12周內恢復正常,尿蛋白呈陰性,少數患者可伴有上腹部不適或者血小板減少;PE的診斷標準為:妊娠20周后出現收縮壓在140mmHg或者舒張壓在90mmHg及以上,伴有尿蛋白300mg/24h或者隨機尿蛋白呈陽性,伴有上腹部不適、頭痛、視力模糊等癥狀。
納入標準:①單胎、年齡在23~36歲;②于12周之前在我院建卡,并定期來院檢查;③分娩或終止妊娠時間在32周以后;④依從性良好。另需要排除慢性高血壓合并PE或者妊娠免疫系統疾病患者。
1.3方法
1.3.1一般臨床資料收集
收集入選對象的基本臨床信息,包括孕婦的年齡、孕周、孕產次、孕前體質指數(body mass index,BMI)、成功妊娠與不良妊娠結局(成功妊娠主要是指順產與剖宮產,不良妊娠主要指新生兒窒息、胎膜早破、新生兒膽紅素增高癥、產后出血等)。
1.3.2血清PLGF的檢測
采用時間分辨熒光分析法檢測所有研究對象妊娠11~13+6周、19~24+6周以及30~34+6周血清中PLGF濃度。所有研究對象于清晨空腹抽取肘靜脈血5mL,并置于不含有抗凝的試管中靜置(冰上),0.5h在低溫離心機上以3 500 r/min離心10min,收集上清液并置于-80℃冰箱中保存備用,采用AutoDELFIA 1235全自動時間分辨熒光免疫分析儀檢測PLGF的濃度。
1.3.3子宮動脈血流阻力檢測
采用 GE Voluson E8彩色多普勒超聲儀,經腹部超聲檢查,探頭頻率在2.5~5.0MHz。接受檢查的所有對象需要適度膀胱充盈。檢查時取平臥位,探頭從子宮下段兩側肌層與盆壁之間找到兩側髂內動脈,而后從髂內動脈遠端分支處找到兩側子宮動脈主干,獲取至少連續3個心動周期以上的頻譜圖形后,儀器自動計算出UtA-PI。所有對象均于妊娠11~13+6周、19~24+6周以及30~34+6周至我院超聲科接受超聲檢查。
1.3.4平均動脈壓檢測
采用3BTOA2型全自動化分析設備(Microlife公司,中國臺北)檢測所有研究對象的平均動脈壓(MAP)。接受檢測之前需要靜坐休息5min,雙臂同時進行血壓記錄,間隔6h內再次測量血壓,取平均值,MAP=(收縮壓+2×舒張壓)/3 。所有對象均于妊娠11~13+6周、19~24+6周以及30~34+6周至我院門診接受血壓檢測。
1.4統計學方法
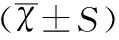
2結果
2.1兩組患者一般臨床資料比較
三組患者年齡、經產婦比例方面比較無顯著性差異(均P>0.05)。NC組、GH組與PE組在分娩孕周、新生兒出生體重、妊娠結局方面比較有顯著性差異差(P<0.05),GH組與PE組在新生兒出生體重、妊娠結局方面差異有顯著性差異差(均P<0.05),見表1。
2.2 PE組與NC組MAP、UtA-PI及PLGF結果比較
研究結果顯示,各孕周內,PE組PLGF(MoM值)與NC組比較,差異有統計學意義(t值在3.674、5.445、9.273,均P<0.05);GH組、PE組孕30~34+6周MAP、UtA-PI及PLGF與孕19~24+6周、孕11~13+6周差異有統計學意義(t值分別為3.403、4.21、5.092、6.220、7.022、8.117、3.762、5.901、5.882、6.766、7.669、8.115,均P<0.05),見表2。
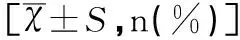
表1 兩組患者一般臨床資料比較
注:與NC組比較,*P<0.05;與GH組比較,#P<0.05。
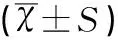
表2 PE組與NC組MAP、UtA-PI及PLGF結果比較
注:孕周內,與NC組比較,*P<0.05,與GH組比較,#P<0.05;相同組別,與孕11~13+6周比較,▲P<0.05;與孕19~24+6周比較,△P<0.05。
2.3不同孕周PE發生的相關因素分析
以是否為PE為因變量,以MAP、UtA-PI及PLGF為自變量行Logistic回歸分析,結果顯示,在孕11~13+6周時PLGF與PE的發生有關(P<0.05);孕19~24+6周時,PLGF、UtA-PI為PE發生影響因素(P<0.05);孕30~34+6周時,MAP、UtA-PI及PLGF與PE的發展顯著相關(P<0.05),見表3。
2.4 ROC曲線分析
采用ROC曲線分析顯示,孕11~13+6周時,PLGF診斷PE的曲線下面積( area under curve,AUC)為0.706,95%CI為0.584~0.809,敏感度為70.26%,特異度為74.13%(圖1A)。孕19~24+6周時,PLGF診斷PE的AUC為0.749,95%CI為0.634~0.849,敏感度為73.41%,特異度為78.66%;UtA-PI診斷PE的AUC為0.705,95%CI為0.591~0.819,敏感度為69.59%,特異度為73.66%(圖1B)。孕30~34+6周時,PLGF診斷PE的AUC為0.776,95%CI為0.679~0.861,敏感度為76.28%,特異度為83.54%;UtA-PI診斷PE的AUC為0.735,95%CI為0.621~0.833,敏感度為71.27%,特異度為75.47%;MAP診斷PE的AUC為0.711,95%CI為0.582~0.802,敏感度為69.35%,特異度為73.72%;MAP、PLGF及UtA-PI三者聯合診斷PE的AUC為0.922,95%CI為0.753~0.948,敏感度為90.11%,特異度為92.69%(圖1C)。

表3 Logistic回歸分析結果

注:圖A為孕11~13+6周;圖B為孕19~24+6周;圖C為孕30~34+6周。
圖1 ROC曲線分析
Fig. 1 ROC curve analysis (Fig. A:gestational 11-13+6weeks;Fig. B:gestational 19-24+6weeks;Fig. C:gestational 30-34+6weeks)
3討論
3.1妊娠高血壓與妊娠結局的關系
妊娠期高血壓疾病是婦女妊娠期尤其是高齡孕婦特有的病癥,占所有孕婦的5%~10%,嚴重者可能造成孕產婦以及圍產兒的生命危險,目前臨床上多數學者認為其發病機制為高血壓引起孕產婦周圍血管阻力增大,引起子宮和胎盤的血流速度降低、血流量相對減少,引起胎盤功能障礙。有報道指出,胎盤功能下降能引起胎兒心臟的代償功能,主要包含心輸出量的重新分配以及心肌代償性肥大,進一步導致胎兒心臟的舒張功能和收縮功能出現異常改變[5]。PE主要為妊娠20周以后,臨床表現蛋白尿、水腫、血壓升高等癥狀,病情惡化會出現昏迷、抽搐、胸悶等癥狀,是誘發HELLP綜合征、心臟病的危險因素。妊娠期高血壓疾病為不良妊娠結局的危險因素,其可以誘發早產、剖宮產、新生兒呼吸窘迫癥等,本研究發現GH患者分娩孕周以及新生兒出生體重與正常妊娠組比較無顯著性差異(P>0.05),而PE組患者上述兩指標顯著低于正常妊娠組(P<0.05),PE患者不良妊娠結局發生率顯著高于正常妊娠組,PE對不良妊娠結局的影響更大,這也證實了以往的研究報道。
3.2妊娠高血壓患者妊娠結局與PLGF水平的關系
近年來,國內外學者將預測妊娠高血壓疾病的指標作為產科研究的較為熱門的課題。機體器官出現的小血管痙攣、血管內皮損傷以及局部組織缺血是導致妊娠高血壓疾病發生發展的病理基礎,有研究發現,子宮螺旋動脈重鑄障礙以及胎盤有害因子進入到母體血液循環中是導致GH、PE發展的關鍵原因[6]。有學者將妊娠期高血壓疾病稱之為“胎盤病”,因此多數學者尋找與胎盤來源有關的指標,其中PLGF是近年來研究熱點指標之一。PLGF是血管生長因子家族中的成員之一,可以特異性結合血管內皮生長因子-1及其可溶性受體-1,從而激活對滋養層細胞及內皮細胞的調節作用。有學者研究發現,孕期各階段低濃度PLGF與妊娠高血壓疾病的發生發展密切相關[7]。歐洲部分國家甚至將PLGF作為臨床篩查子癇前期的輔助指標[8]。本研究發現,PE組孕11~13+6周、19~24+6周以及孕30~34+6周內血清中PLGF含量(MoM值)均顯著低于同期正常妊娠組(P<0.05),提示孕期檢測PLGF可能有助于篩查PE。值得提出的是,Logistic回歸分析中發現PLGF隨著孕周的增加,其與PE的相關性更為顯著(P<0.05)。采用ROC曲線繪制預測價值也發現孕30~34+6周檢測PLGF對PE的預測價值更高,筆者認為,這一結果可能提示隨著孕周的增加,血管內皮功能受損進一步加重,血清中PLGF降低量更為明顯,發展為PE的風險可能明顯增加。因此認為孕早期檢測PLGF對于篩查PE有一定的作用。
3.3妊娠高血壓患者妊娠結局與UtA-PI的關系
子宮動脈血流主要是反映子宮胎盤循環阻抗。研究顯示,正常妊娠孕婦子宮動脈的血流阻力會下降,而子癇前期的孕婦則會出現子宮動脈血流阻力增加。研究發現,在妊娠8~12周,滋養層細胞對子宮螺旋動脈逐漸侵襲從而使螺旋動脈重鑄,而被重鑄后的血管內皮細胞被滋養細胞所取代,血管腔擴張,血管阻力下降,隨著妊娠月份的增加,子宮動脈阻力指數下降,UtA-PI也在下降[9]。滋養層細胞侵襲子宮螺旋動脈這一過程基本在14~16周開始,而在24周之前基本完成,但是子癇前期孕婦因滋養層細胞侵襲較弱,導致子宮螺旋動脈重鑄障礙, 對子宮螺旋小動脈侵蝕不夠,管壁肌層不消失,仍具有彈性,導致血管阻力不下降或下降較少,胎盤循環仍然處于高阻狀態。由此可見,在孕早期(孕11~13+6周)子癇前期孕婦子宮動脈血流與正常妊娠孕婦應該沒有顯著差異,本研究也證實了這一點。通過我們的研究發現,在孕19~24+6周內PE組UtA-PI與NC組之間差存在統計學差異(P<0.05),提示這一階段滋養層細胞侵襲螺旋動脈基本完成,子癇前期患者可能已經出現子宮螺旋動脈重鑄障礙、子宮血流阻力指數增加、UtA-PI升高。通過Logistic回歸分析顯示,孕19~24+6周、30~34+6周UtA-PI與PE的發生密切相關(P<0.05),這一結果提示,在孕早期檢測UtA-PI對于預測PE的可能性較小,而從孕中期(即孕19~24+6周)檢測UtA-PI對于預測PE有一定的作用。
3.4妊娠高血壓患者妊娠結局與MAP的關系
MAP值的變化主要與機體細小動脈的痙攣性收縮程度有一定的關系,若細小動脈長期處于痙攣狀態則可導致動脈玻璃樣病變、血管外阻力增高、從而使舒張壓升高、MAP增加。目前有研究發現,孕16~26+6周的孕婦中當MAP高于85mmHg時,其發展為妊娠高血壓疾病的風險明顯增加[1]。另有研究發現[10],隨著妊娠月份的增加,MAP明顯增高,尤其是妊娠32周孕婦MAP對于PE的診斷具有一定的價值,且明顯優于孕12周、22周孕婦。本研究發現,孕11~13+6周、孕19~24+6周孕婦中MAP在PE組、NC組之間無顯著性差異(P>0.05),分析原因可能為:①PE的病理基礎是子宮螺旋動脈重鑄障礙,引起血管內皮損傷,而血管內皮損傷引起動脈玻璃樣變、導致血管阻力進一步增加,而這些是重鑄障礙發生以后;②MAP的檢測受到多種因素的影響,與母體體重、血壓變化等有關,因此對PE的診斷也易出現誤差。
3.5 MAP、PLGF及UtA-PI聯合檢測的意義
本研究對828例孕婦進行了3個階段的MAP、PLGF及UtA-PI的檢測,發現孕30~34+6周對上述各種指標的檢測能夠更好的檢測PE的發生,其靈敏度、特異度均明顯增高,對PE具有較高的診斷價值。但是需要指出的是,孕早期若出現PLGF顯著降低,尤其是孕19~24+6周出現PLGF、UtA-PI異常,孕婦自身需要在飲食、日常生活、工作中注意預防。
綜上,孕30~34周+6MAP、PLGF及UtA-PI診斷PE明顯優于孕19~24+6周、孕11~13+6周,但早期PLGF降低對于早期篩查PE有一定價值,值得參考。
[參考文獻]
[1]Guy G P,Ling H Z,Garcia P,etal.Maternal cardiac function at 35-37 weeks' gestation: prediction of pre-eclampsia and gestational hypertension[J].Ultrasound Obstet Gynecol,2017,49(1):61-66.
[2]Sung K U,Roh J A,Eoh K J,etal.Maternal serum placental growth factor and pregnancy-associated plasma protein A measured in the first trimester as parameters of subsequent pre-eclampsia and small-for-gestational-age infants: a prospective observational study[J].Obstet Gynecol Sci,2017,60(2):154-162.
[3]Tayyar A, Krithinakis K, Wright A,etal. Mean arterial pressure at 12, 22, 32 and 36 weeks’ gestation in screening for pre-eclampsia[J]. Ultrasound Obstet Gynecol, 2016, 47(5):573-579.
[4]O'Gorman N,Tampakoudis G,Wright A,etal.Uterine artery pulsatility index at 12, 22, 32 and 36 weeks' gestation in screening for pre-eclampsia[J].Ultrasound Obstet Gynecol,2016,47(5):565-572.
[5]Lakhno I. Autonomic imbalance captures maternal and fetal circulatory response to pre-eclampsia[J]. Clin Hypertens,2017,23:5.
[6]沈永紅,袁文慧,李俊英.子癇前期患者血清APN和sFlt-1水平與子宮螺旋動脈血流變化關系[J].中國婦幼健康研究,2016,27(1):35-37.
[7]高勁松,沈晶,蔣宇林,等.妊娠中期孕婦血清sFlt-1、PlGF水平及比值變化預測子癇前期發生的價值[J].中華婦產科雜志,2014,49(1):22-25.
[8]韓瑾,張蒙,許遵鵬,等.孕早期血清胎盤生長因子在妊娠期高血壓疾病篩查中的應用[J].中國婦幼健康研究,2016,27(6):698-701.
[9]張秀群,關海蘭. 孕早、中期血清β-HCG、sFlt-1、sEng聯合子宮動脈多普勒搏動指數預測子癇前期的診斷價值[J].廣西醫科大學學報,2015, 32(3):448-450.
[10]Macdonald-Wallis C,Silverwood R J,de Stavola B L,etal.Antenatal blood pressure for prediction of pre-eclampsia, preterm birth, and small for gestational age babies: development and validation in two general population cohorts[J].BMJ,2015,351:h5948.

