歐盟新法規(guī)醫(yī)療器械分類管理思路變化的研究分析
【作 者】張春青,周良彬,王越,易力,楊婉娟,戎善奎,李靜莉
1 中國食品藥品檢定研究院,北京市,100050
2 廣東省醫(yī)療器械質(zhì)量監(jiān)督檢驗所,廣州市,510663
20世紀90年代,歐盟已形成較為完善的醫(yī)療器械監(jiān)管框架,主體部分由有源植入醫(yī)療器械指令(AIMD,EC-Directive 90/385/EEC)[1]、醫(yī)療器械指令(EC-Directive 93/42/EEC)[2]和體外診斷醫(yī)療器械指令(IVDMD,EC-Directive 98/79/EC)[3]組成。醫(yī)療器械指令確定了分類管理的基本原則:根據(jù)產(chǎn)品預(yù)期用途,按照風險水平從低到高將醫(yī)療器械分為Ⅰ、Ⅱa、Ⅱb、Ⅲ 4類[2]。歐盟形成的醫(yī)療器械分類管理制度對用械安全和人類健康起到了積極的作用。隨著科學(xué)和技術(shù)的持續(xù)進步,融入高新技術(shù)的產(chǎn)品不斷涌現(xiàn),歐盟各成員國對醫(yī)療器械指令的解讀及應(yīng)用發(fā)生了越來越多的分歧。以法國PIP(Poly Implant Prosthesis)公司生產(chǎn)硅膠乳房植入物時材料造假為代表的違法違規(guī)事件,顯示出其醫(yī)療器械監(jiān)管法規(guī)體系存在漏洞。為保障歐盟供應(yīng)醫(yī)療器械的安全性,保持其在醫(yī)療器械領(lǐng)域的領(lǐng)先地位,2012年歐盟啟動對醫(yī)療器械監(jiān)管法規(guī)體系的修訂更新。歷時5年,2017年4月5日,歐洲議會和歐盟理事會宣布采用關(guān)于醫(yī)療器械和體外診斷醫(yī)療器械的新法規(guī)(Regulation (EU) 2017/745,Regulation (EU)2017/746)[4-5],取代之前的三個指令。新法規(guī)已于2017年5月26日生效,同時,為醫(yī)療器械新法規(guī)設(shè)置了3年過渡期,體外診斷醫(yī)療器械新法規(guī)有5年過渡期。本文就歐盟新舊法規(guī),特別是對分類相關(guān)內(nèi)容進行對比分析,探討其法規(guī)修訂思路,為我國醫(yī)療器械分類管理工作提供參考。
1 整體情況對比
新法規(guī)納入了最新的技術(shù)發(fā)展(如納米材料等),擴大了監(jiān)管產(chǎn)品的范圍,高風險產(chǎn)品獲得CE認證有了更加嚴格的程序,加強了不同成員國在執(zhí)行層面的協(xié)調(diào)性,完善了對患者的保障機制。總體來說,新法規(guī)與舊指令相比,監(jiān)管趨于嚴格規(guī)范,產(chǎn)品的標識信息更加規(guī)范透明以保證產(chǎn)品的可追溯性。法規(guī)的整體變化情況見表1。
2 醫(yī)療器械分類相關(guān)定義與概念變化的對比分析
在新法規(guī)中,根據(jù)技術(shù)最新發(fā)展成果更新了相關(guān)定義和概念的表述方式,表述更加細化明確,界定范圍更加清晰,主要變化如下:
2.1 醫(yī)療器械的定義和管理范圍變化
修改醫(yī)療器械定義后,明確了妊娠控制或支持類產(chǎn)品、消毒滅菌等器械的地位。新法規(guī)以增設(shè)“非醫(yī)療用途產(chǎn)品的產(chǎn)品清單”的方式將一些不符合醫(yī)療器械定義的產(chǎn)品納入管理范圍。新法規(guī)與舊指令相比較,管理的產(chǎn)品范圍有所拓展。
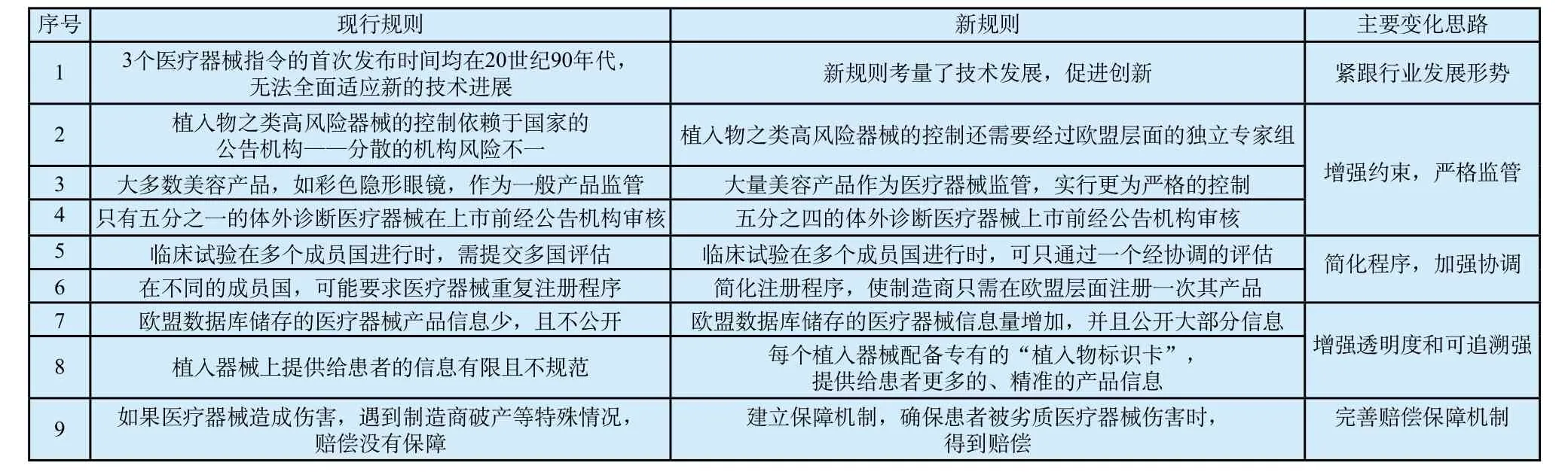
表1 歐盟新舊法規(guī)整體情況對比Tab.1 Overall situation of EU new and old regulations
2.1.1 醫(yī)療器械的定義
新定義:醫(yī)療器械是指制造商預(yù)定的、為了以下一項或多項特定醫(yī)療目的而用于人體的儀器、設(shè)備、器具、軟件、植入物、試劑、材料或其它物品,無論是單獨使用還是組合使用:
— 疾病的診斷、預(yù)防、監(jiān)測、預(yù)測、預(yù)后、治療或緩解;
— 損傷或缺陷的診斷、監(jiān)測、治療、緩解或補償;
— 解剖結(jié)構(gòu)或生理過程或狀態(tài)的調(diào)查、置換或修正;
— 以體外檢查人體樣本(包括器官、血液和組織供體)的方式提供信息。
這些器械不是通過藥理學(xué)、免疫學(xué)或代謝作用等方式,在人體內(nèi)或人體表面實現(xiàn)其主要預(yù)期作用,但可用這些方式輔助達到其功能。
以下產(chǎn)品應(yīng)認為是醫(yī)療器械:
— 妊娠控制或支持用器械;
— 專用于對第1(4)條(注:① 條目號為原文中條目號。② 該條內(nèi)容所指器械是醫(yī)療器械、醫(yī)療器械附件,及附錄ⅩⅥ所列產(chǎn)品)所述器械及本點第一段上述產(chǎn)品進行清潔、消毒或滅菌的器械。
變化內(nèi)容:明確增加三項內(nèi)容:①“以體外檢查人體樣本(包括器官、血液和組織供體)的方式提供信息”的產(chǎn)品,指的是體外診斷醫(yī)療器械,特別進行明確此類產(chǎn)品按照醫(yī)療器械管理;② 明確“妊娠控制和支持用途”的產(chǎn)品按照醫(yī)療器械管理;③ 增加“專用于對第1 ④ 條所述器械及本點第一段上述產(chǎn)品進行清潔、消毒或滅菌”的表述,明確了消毒器械的地位。
2.1.2 增設(shè)作為醫(yī)療器械管理的“非醫(yī)療用途產(chǎn)品的產(chǎn)品清單”
新法規(guī)增設(shè) “非醫(yī)療用途產(chǎn)品的產(chǎn)品清單”,該清單上的六類產(chǎn)品不符合醫(yī)療器械定義,但具有和醫(yī)療器械類似風險和技術(shù)特征的產(chǎn)品,新法規(guī)將其納入管理范圍,具體是:
(1)用于眼部的隱形眼鏡或其他物品;
(2)以手術(shù)侵入方式部分或全部引入人體,用于修正骨骼或固定身體部分的產(chǎn)品,紋身和穿孔類產(chǎn)品除外;
(4)用于減少、移除或摧毀脂肪組織的設(shè)備,例如抽脂、脂肪溶解或塑形設(shè)備;
(5)用于人體的高密度電磁輻射(例如紅外、可見光和紫外)發(fā)射設(shè)備,包括相干和非相干光源,單色和廣譜,例如激光和強脈沖光設(shè)備,用于除皺、紋身、脫毛或其他皮膚處理;
(6)使用電流、磁場或電磁場穿透顱骨以修正大腦神經(jīng)活動的腦刺激設(shè)備。
2.2 重要概念的變化
2.2.1 醫(yī)療器械的附件
新定義:醫(yī)療器械的附件是指本身不是器械,但由制造商特別設(shè)計專門與一個或多個特定醫(yī)療器械一起使用,以實現(xiàn)器械的預(yù)期用途,或按醫(yī)療器械預(yù)期用途專門直接輔助完成其醫(yī)療功能的物品。
變化內(nèi)容:增加 “或按醫(yī)療器械預(yù)期用途專門或直接輔助完成其醫(yī)療功能”的表述。
2.2.2 植入器械
掛斷電話,林露白想打給魏舟又沒打,領(lǐng)證的事不了了之,他們之間的聯(lián)系一天比一天少,最后,是林露白說的分手,魏舟沒有說什么。
新定義:植入器械是指以臨床干預(yù)手段預(yù)期用于下列情況、并在術(shù)后置留在手術(shù)部位的器械,包括部分或全部被吸收的情況:完全進入人體內(nèi),或用于置換上皮組織或眼表。
通過手術(shù)干預(yù)僅部分留置于人體內(nèi),留置時間至少為30 d的器械也被視為植入器械。
變化內(nèi)容:新增了“部分或全部被吸收”的情況。
2.2.3 預(yù)期用途
新描述:預(yù)期用途是指根據(jù)制造商在標簽、使用說明、宣傳或銷售材料、聲明以及臨床評價中提供資料得出的器械預(yù)期用途。
變化內(nèi)容:增加了“臨床評價”這一信息來源。
2.2.4 手術(shù)侵入器械
新定義:手術(shù)侵入器械是指 ① 借助于外科手術(shù)或在外科手術(shù)中,通過人體表面(包括人體腔道黏膜)侵入體內(nèi)的侵入器械;② 不通過人體腔道而侵入人體的器械。
變化內(nèi)容:人體表面的概念中增加了“包括人體腔道黏膜”內(nèi)容。
2.2.5 納米材料、受傷皮膚或黏膜
“納米材料”和“受傷皮膚或黏膜”是新增概念,具體內(nèi)容是:納米材料是一種天然的、偶發(fā)的或制造的材料,含有游離狀態(tài)、聚合狀態(tài)或團塊狀態(tài)的微粒,且對于50%(粒徑分布數(shù)目)以上的微粒,至少有一個外部維度在1 nm~100 nm尺寸范圍。一個或多個外部維度低于1 nm的富勒烯、石墨烯片和單層碳納米管應(yīng)視為納米材料。
受傷皮膚或黏膜是指呈現(xiàn)出病理改變及疾病或創(chuàng)傷改變的皮膚或黏膜區(qū)域。
3 醫(yī)療器械分類相關(guān)程序與措施變化的分析
新法規(guī)在保持舊指令基本分類系統(tǒng)的基礎(chǔ)上,新增了各方面解讀分類規(guī)則發(fā)生分歧時的仲裁機制和協(xié)調(diào)解決原則,明確了分類和重分類的工作原則,引入了醫(yī)療器械協(xié)調(diào)小組(Medical Device Coordination Group,簡稱“MDCG”)對分類工作給予技術(shù)咨詢和支持。具體變化主要體現(xiàn)在以下幾個方面。
3.1 明確了制造商與公告機構(gòu)就分類問題發(fā)生分歧時的裁定機構(gòu)
在制造商與有關(guān)的公告機構(gòu)因分類問題發(fā)生爭議時,應(yīng)將爭議事項提交至該制造商注冊地所屬成員國的主管當局裁定。如果制造商在歐盟進行商業(yè)注冊且未指定授權(quán)代表,該事項應(yīng)交由制造商的擬授權(quán)代表進行商業(yè)注冊的成員國主管當局裁定。當有關(guān)的公告機構(gòu)和制造商所在成員國不一致時,制造商所在地的主管當局應(yīng)與指定該公告機構(gòu)的成員國主管當局商議之后,實施其決定。
3.2 明確了對規(guī)則解讀發(fā)生分歧時的解決方式
為確保分類規(guī)則實施的一致性,歐盟理事會綜合考慮相關(guān)技術(shù)委員會的技術(shù)意見后,可以采用必要程度的執(zhí)行法案,解決解讀分歧和實際實施的問題。
3.3 明確了分類和重新分類的工作原則
歐盟理事會可以主動發(fā)起或者應(yīng)成員國請求,咨詢MDCG之后,以執(zhí)行法案的方式,決定:
(1)對某一器械、某一種器械或某一組器械應(yīng)用附錄Ⅷ,確定其分類;
(2)基于新的技術(shù)證據(jù),或警戒和市場監(jiān)管活動獲得的信息,出于公共健康的原因,以更替附錄Ⅷ的方式,對某一個器械、某一種器械或某一組器械進行重新分類。
4 醫(yī)療器械分類規(guī)則變化的對比分析
新法規(guī)的分類規(guī)則,在普通醫(yī)療器械分類規(guī)則的基礎(chǔ)上,納入有源植入醫(yī)療器械相關(guān)內(nèi)容。對相關(guān)條款的表述更為詳細、清晰和明確,對某些產(chǎn)品的原料特性、作用方式等方面風險進行了進一步明確,對個別用途的產(chǎn)品管理類別進行升類嚴格管理,并對該領(lǐng)域產(chǎn)品新技術(shù)成果進行了補充納入,具體見表2(下頁)。
5 分析與結(jié)論
通過對歐盟醫(yī)療器械新法規(guī)(2017/745)與現(xiàn)行指令中醫(yī)療器械分類相關(guān)的定義與概念、程序與措施、分類規(guī)則等幾個方面內(nèi)容的對比分析,發(fā)現(xiàn)新法規(guī)表述更為明確清晰,進一步明確了分類執(zhí)行時分歧的解決方式,納入行業(yè)最新的技術(shù)進展。新法規(guī)的管理更為嚴格,拓寬了醫(yī)療器械監(jiān)管范圍,在分類規(guī)則層面對個別產(chǎn)品(規(guī)則8)進行了升類。新法規(guī)中的變化,體現(xiàn)了歐盟醫(yī)療器械法規(guī)制度的基本思路——避免和減少理解和執(zhí)行層面的分歧,保持監(jiān)管思路與國際先進理念同步,技術(shù)方面與時俱進,以更為嚴格的監(jiān)管體系保證歐盟供應(yīng)醫(yī)療器械產(chǎn)品的安全性,強化歐盟在醫(yī)療器械的領(lǐng)先地位。
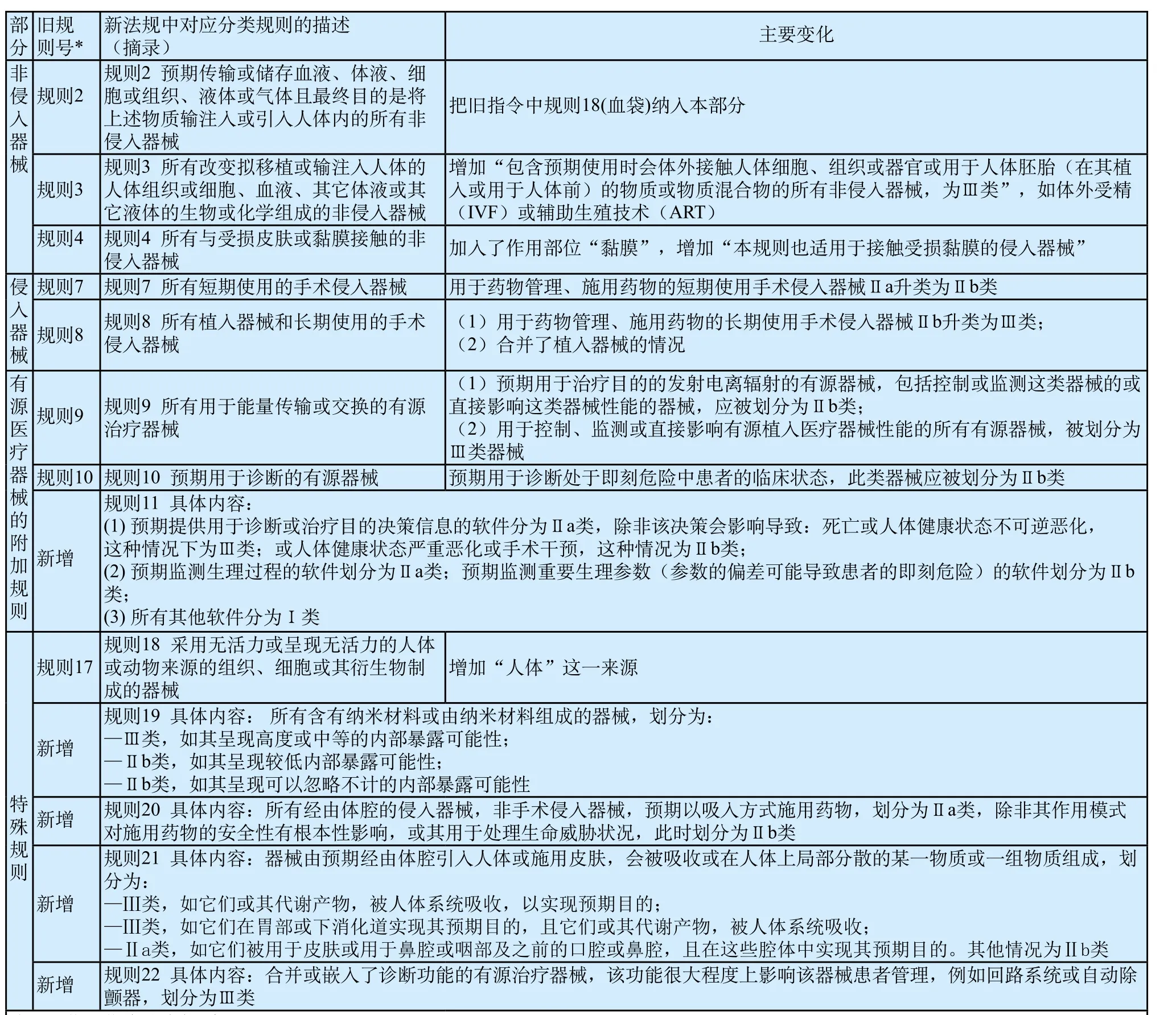
表2 分類規(guī)則的主要變化Tab.2 Main changes in classif i cation rules
[1] The council of the European communities. Council Directive of 20 June 1990 on the approximation of the laws of the Member States relating to active implantable medical devices[S]. 2007-09-05.
[2] The council of the European communities. Council Directive 93/42/EEC of 14 June 1993 concerning medical devices[S]. 2007-09-05.
[3] The European parliament and the council of the European Union.Directive 98/79/EC of the European Parliament and of the council of 27 October 1998 on in vitro diagnostic medical devices[S].2011-12-20.
[4] Council of the European Union. Regulation (EU) 2017/745 of the European parliament and of the council of 5 April 2017 on medical devices, amending Directive 2001/83/EC, Regulation (EC)No 178/2002 and Regulation (EC) No 1223/2009 and repealing Council Directives 90/385/EEC and 93/42/EEC[S]. 2017-05-25.
[5] Council of the European Union. Regulation (eu) 2017/746 of the European parliament and of the council of 5 April 2017 on in vitro diagnostic medical devices and repealing Directive 98/79/EC and Commission Decision 2010/227/EU[S]. 2017-05-25.

