重金屬Cd對大鼠睪丸間質瘤細胞R2C孕酮合成的影響
盧軍利, 孫建霞, 文羅娜, 白衛濱*, 焦 睿, 歐仕益, 楊 勇
(1.四川農業大學 食品學院,四川 雅安 625014;2.暨南大學 食品科學與工程系,廣東 廣州 510632;3.廣東工業大學 輕工化工學院,廣東 廣州 510006)
重金屬鎘可以通過食物鏈進入體內,分布到全身各個器官,重金屬鎘會對腎、肝、肺、心血管、睪丸等系統產生一系列損傷。且鎘的半衰期長達15~30年。由于鎘容易在體內蓄積,所以一些動物性食品中鎘含量較高,濃度可達幾十至數百倍[1-3]。
重金屬鎘對雄性和雌性的生殖系統都有損害作用,但雄性生殖系統對鎘的敏感性要高于雌性生殖系統,動物雄性生殖器官睪丸是重金屬染毒受損嚴重的靶器官之一,除了對雄性性腺發育有不良影響外,鎘還對睪丸和附睪也有毒副作用[4]。目前,重金屬Cd的雄性毒性研究主要集中在動物實驗上,而對體外睪丸間質細胞研究較少,損傷機理不是很明確。且對重金屬暴露的睪丸間質細胞毒性損傷的研究主要是集中于對睪酮生成途徑中相關酶的影響[5],孕酮是合成睪酮的前體物質,作者通過CdSO4對R2C細胞孕酮合成通路的影響,探討重金屬鎘引起的雄性生殖毒性機制,為重金屬Cd的食品安全評估提供一定的理論依據。
1 材料與方法
1.1 材料
R2C細胞:購自 CCTCC;CdSO4(純度為 98%):百靈威公司產品;F-12 basic(1X)培養液、胎牛血清(FBS)、胰酶、馬血清:美國 Gibco 公司產品;MTT、DMSO:美國Amresco公司產品;I125孕酮放射免疫分析藥盒:北京北方生物技術研究所產品;活性氧檢測試劑盒:碧云天生物技術研究所產品;StAR兔抗大鼠抗體 Cell Signaling Technology;CYP11A1兔抗大鼠抗體 Cell Signaling Technology;GAPDH兔抗大鼠抗體proteintech。
CO2培養箱:美國 Thermo公司產品;流式分析儀:美國BD公司產品;酶標儀美國:Thermo公司產品;GC-1200 γ放射免疫計數儀:安徽中科中佳公司產品。
1.2 方法
1.2.1 MTT法檢測Cd對R2C細胞增殖的影響將對數期的R2C細胞用胰酶消化、離心、重懸、計數,接種于96孔板中,每孔8 000個細胞,每個濃度組設置3個復孔。在細胞培養箱中培養24 h,吸棄孔內培養基,加入用完全培養基稀釋的CdSO4溶液,使每組 CdSO4作用濃度分別為 0、10、20、40、80、160 μmol/L,并設有空白組(不含細胞)。 CdSO4作用24 h后,避光加入加噻唑藍(MTT)溶液,每孔 20μL,細胞培養箱中孵育4 h,吸棄孔內液體,避光加入DMSO溶解藍紫色甲瓚結晶,每孔150 μL,脫色搖床上搖勻10 min,使沉淀充分溶解,490 nm波長下測定OD值。
用SPSS軟件分析得出Cd作用于R2C細胞的IC25、IC50、IC75濃度值。
1.2.2 放射免疫 (radioimmunoassav,RIA)檢測Cd對R2C細胞合成孕酮的影響 將對數期的R2C細胞用胰酶消化、離心、重懸、計數,接種到6孔板中,每孔4×105個細胞,培養基2 mL,在細胞培養箱中培養24 h,吸棄孔內培養基,加入濃度分別為IC25、IC50和IC75的CdSO4溶液,繼續培養24 h,吸取上清,按照碘[125I]孕酮放射免疫分析藥盒進行測定孕酮合成量。
1.2.3 流式細胞分析儀(FCM)檢測Cd對 R2C細胞線粒體膜電位(MMP)的影響 將對數期的R2C細胞用胰酶消化、離心、重懸、計數,接種到6孔板中,每孔4×105個細胞,培養基2 mL,細胞培養箱中培養24 h,棄去孔內培養基,加入濃度分別為IC25、IC50和IC75的CdSO4溶液,繼續培養24 h,吸棄孔內培養基,胰酶消化,400 g離心5 min,按照線粒體膜電位檢測試劑盒進行JC-1染色,用流式細胞分析儀進行檢測,每個樣品采集104個細胞。
1.2.4 熒光酶標儀檢測 CP對R2C細胞的ROS水平影響 將對數期的R2C細胞用胰酶消化、離心、重懸、計數,接種到96孔板中,每孔10 000個細胞。細胞培養箱中培養24 h,吸棄孔內培養基,每孔加入30 μL DCFH-DA溶液 (無血清培養基稀釋),細胞培養箱中孵育20 min,無血清F12培養基洗3遍,將孔內殘留探針清洗干凈,加入分別含IC25、IC50和IC75濃度CdSO4的培養基,熒光酶標儀檢測。激發波長488 nm,發射波長525 nm,逐時間點檢測Cd作用前后熒光的強弱變化。
1.2.5 Western Blot檢測Cd對R2C細胞孕酮合成相關蛋白Star和CYP11A1表達的影響 漩渦震蕩15 s,冰浴 45 s,重復操作 1 h,4 ℃離心 30 min,取上清。測定試劑盒檢測樣品蛋白濃度,制樣,然后進行SDS電泳、轉膜、免疫雜交、顯影。ImageJ軟件分析結果。
1.2.6 數據處理 通過SPSS軟件對數據進行統計分析,采用單因素方差分析結果,檢驗水平為p<0.05時為差異顯著,具有統計學意義。
2 結果
2.1 Cd對R2C細胞的生長抑制作用
CdSO4作用24 h后,R2C細胞生長受到抑制,由表1可以看出,重金屬Cd能夠抑制R2C細胞的生長,且Cd濃度越高,細胞的生長抑制率越大,呈現劑量依賴性,當CdSO4濃度達到160 μmol/L時,細胞抑制率高達95%,通過SPSS軟件分析得出Cd對 R2C 細胞的 IC25、IC50、IC75濃度值分別為 (24.93±0.023 5)、(44.80±0.047 9)、(80.51±0.035 7) μmol/L。
2.2 Cd對R2C細胞孕酮合成的影響
在維持正常的雄性生理功能過程中,睪酮起到至關重要的作用[6],R2C細胞由于缺少表達合成睪酮的相關酶,最終生成孕酮,而孕酮是睪酮合成的前體物質,所以通過檢測孕酮水平可以反映雄性激素的變化[7]。由孕酮檢測結果可以看出,IC25、IC50、IC753濃度組CdSO4均對孕酮合成有影響。CdSO4溶液濃度越高,孕酮合成量越少,當濃度值達到IC75Z值時,孕酮合成量下降為對照組的40%。
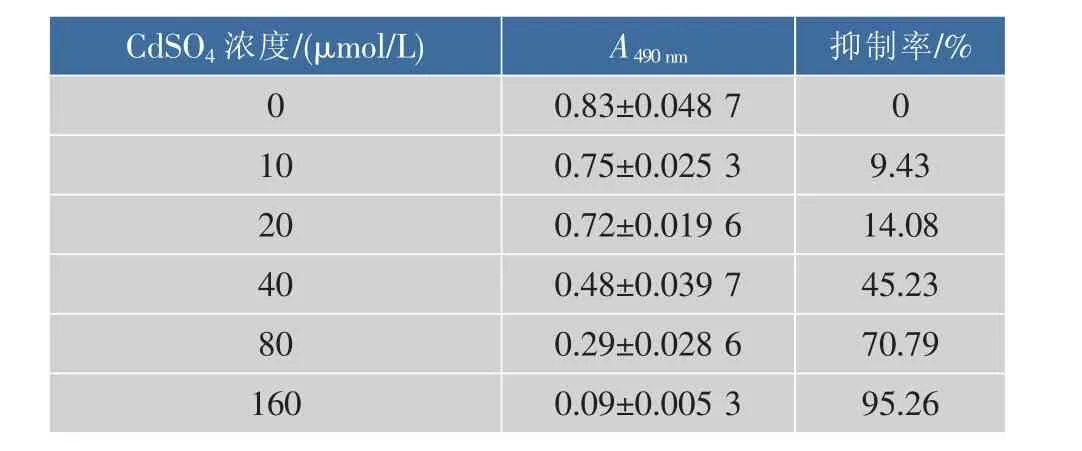
表1 不同濃度CdSO4對R2C細胞生長抑制率的影響Table 1 Inhibitory effect of CdSO4on the growth of R2C cells
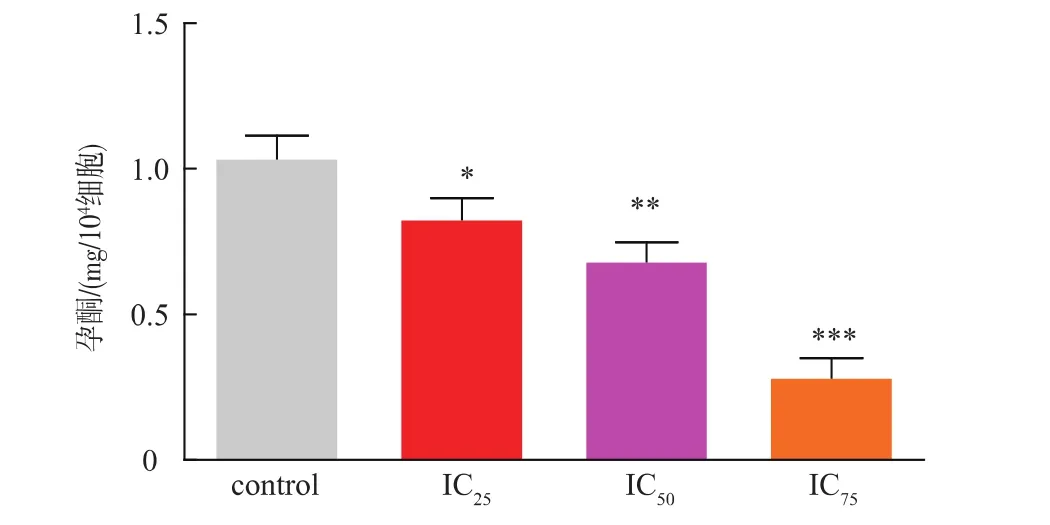
圖1 不同濃度CdSO4對R2C孕酮合成的影響Fig.1 Effect of CdSO4on progesterone production of R2C cells
2.3 Cd對R2C線粒體膜電位的影響
流式細胞分析儀檢測CdSO4濃度為IC25、IC50、IC75暴露24 h后對R2C細胞MMP的影響。通過JC-1染料對R2C細胞進行染色,紅色熒光部分為細胞內正常MMP區域,綠色熒光為細胞內MMP降低的部分。結果顯示,與對照組相比,IC25、IC50、IC75作用濃度均對R2C細胞MMP有所影響,且隨著濃度的增大,線粒體膜電位損傷的比例越大 (圖2(a))。數據分析表明:與正常組相比,濃度為IC25時,線粒體膜電位顯著下降,損傷嚴重,IC75值時,線粒體膜電位損傷比率達33%(圖2(b))。
2.4 Cd對R2C產生ROS的影響
氧化損傷是重金屬雄性毒性的重要損傷學說之一[8],而各種自由基中,氧自由基(ROS),最為主要,圖 3顯示,CdSO4刺激 R2C細胞 2、4、8 h時,R0S產生量均有顯著提高,4 h時最為明顯,且隨著Cd濃度的升高,ROS產生的量也相應增多。由于ROS的產生速度非常快,所以Cd作用8 h時R0S產生量有所下降。

圖2 不同濃度Cd對R2C細胞MMP的影響Fig.2 Effects of CdSO4on MMP changes of R2C cells
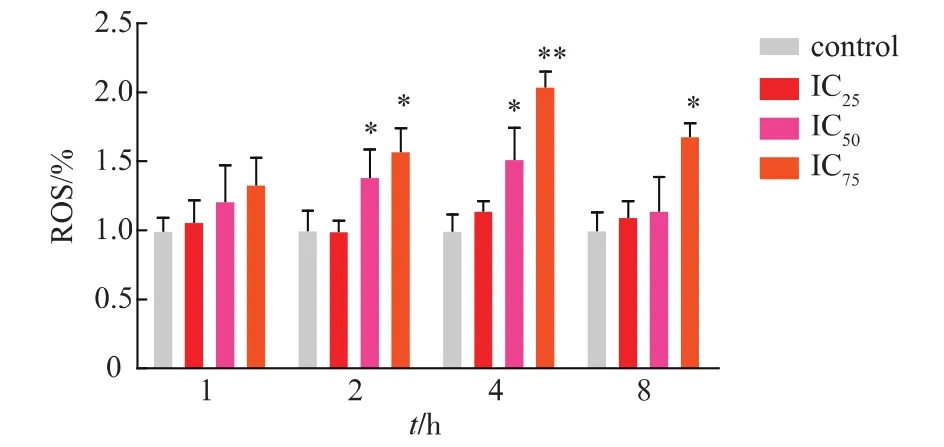
圖3 不同濃度Cd對R2C產生ROS的影響Fig.3 Effects of Cd on ROS in R2C cells
2.5 Cd R2C細胞孕酮合成相關基因StAR、CYP11A1蛋白表達的影響
Western Blot實驗結果顯示:重金屬Cd可以抑制StAR、CYP11A1蛋白的表達量,且StAR蛋白的表達量隨Cd濃度的升高而下降,與對照組相比,IC25、IC50、IC75濃度作用組的 StAR蛋白的表達量均有顯著性差異。而與對照組相比,只有IC75作用濃度可以明顯抑制CYP11A1蛋白的表達,說明Cd對StAR蛋白的影響更為顯著,結果見圖4-6。
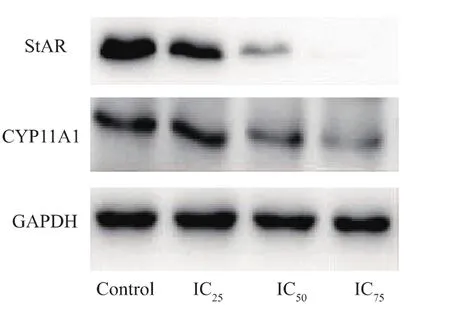
圖4 Western blot檢測不同濃度Cd對R2C細胞StAR和CYP11A1蛋白的影響Fig.4 Effects of Cd on StAR and CYP11A1 expressions by Western blot
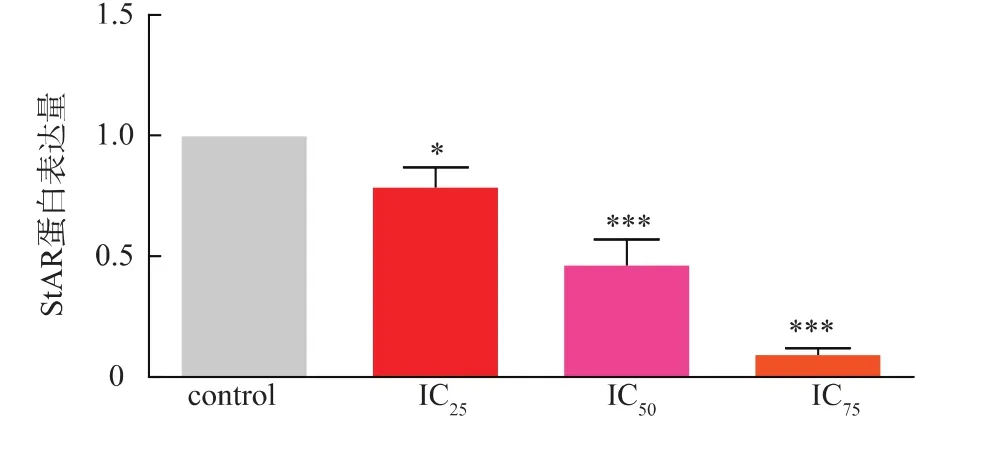
圖5 Western blot檢測不同濃度Cd對R2C細胞StAR蛋白的影響Fig.5 Effects of Cd on StAR and CYP11A1 expressions by Western blot
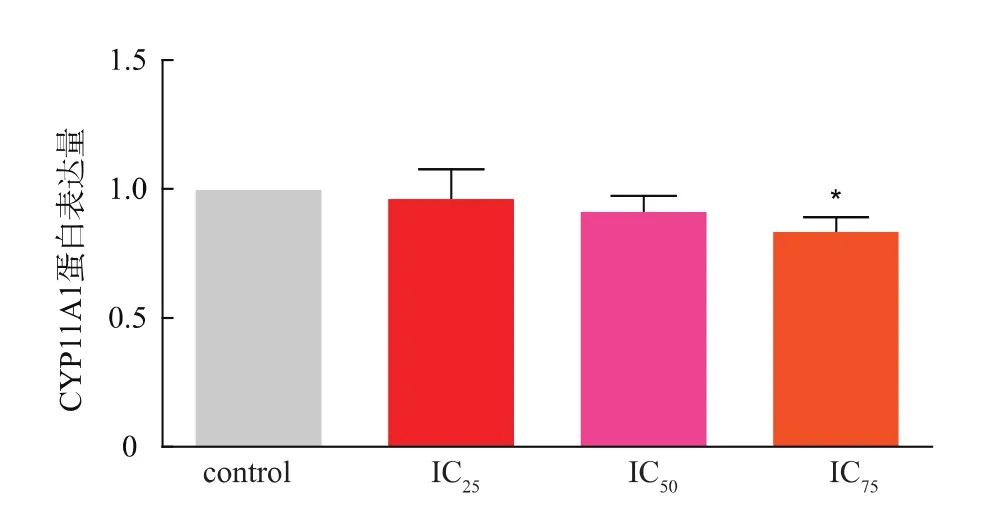
圖6 Western blot檢測不同濃度Cd對R2C細胞StAR和CYP11A1蛋白的影響Fig.6 Effects of Cd on StAR and CYP11A1 expressions by Western blot
3 討 論
動物實驗證明,鎘可以損傷曲精小管中的生殖細胞,并且鎘刺激濃度微量的提高即可引起睪丸損傷的大幅加重[9],體外實驗研究重金屬暴露的睪丸間質細胞毒性損傷主要是集中于對睪酮生成途徑中相關酶的影響,鎘通過氧化損傷途徑對睪丸間質細胞孕酮合成能力的影響沒有相關報道,作者通過體外實驗,研究了Cd雄性毒性作用。結果顯示,金屬Cd可以顯著降低R2C細胞的活性,且濃度越大,作用越強。ROS是體內重要的一種自由基,ROS在機體內保持平衡狀態下,有抗菌、消炎等重要作用,但當平衡被打破,會造成生物膜的脂質氧化損傷,從而引起酶、蛋白等氧化損傷,最終導致對身體機能的損害[10-12]。通過測定在Cd的作用下R2C細胞中ROS的產生量,發現Cd能夠使細胞中ROS顯著提高,隨著Cd濃度的升高,產生的ROS的量也顯著升高,線粒體損傷比率也顯著升高,這是由于ROS的主要產生部位是線粒體的呼吸鏈,Cd刺激R2C細胞產生過多的ROS,使線粒體DNA、基質中的酶受到ROS攻擊而損傷[13],從而影響線粒體膜電位的正常作用。StAR蛋白和CYP11A1蛋白是整個孕酮合成通路中的關鍵點,實驗結果證明,重金屬Cd明顯降低StAR和CYP11A1蛋白表達量,StAR蛋白表達量的下降減弱了膽固醇轉運至線粒體基質內,CYP11A1蛋白表達量的下降減少了線粒體中孕烯醇酮的合成,從而降低了孕酮的合成。孕酮檢測結果對此進行了驗證,濃度為IC25、IC50、IC75的Cd刺激R2C細胞24 h后,與對照組相比,各CdSO4作用組的R2C細胞孕酮量都顯著降低,且有統計學意義。總之,Cd刺激對體外培養的R2C細胞產生大量的ROS,進而影響線粒體正常功能和StAR、CYP11A1的表達,從而阻礙膽固醇的正常轉運和孕酮生成中間物質孕烯醇酮的生成,最終降低R2C細胞孕酮合成量。
[1]KONG Qinghu,CHEN Yunying,WU Jianmin,et al.The combination of cadmium and cadmium and zinc in rats[J].Journal of Zhejiang Academy of Medical Sciences,2001(45):8-10.(in Chinese)
[2]ZHANG Wenchang,LI Huangyuan,WANG Zhangjing,et al.Study on the comparation about toxicity of cadmium to the female gonad and kidney in rats[J].Chinese Journal of Public Health,2002,18(6):693-694.(in Chinese)
[3]BUCKKO G W,HESS N J,KENNE M A.Cadmium mutagenicity and human muclotide excision repair protein XAP:CD,EXAFS and (l)H/ (15)N-N MR spectroscopic studies on the zinc (Ⅱ)-and cadmium (Ⅱ)-associated minimal DNA-bindi-g domain(M98-FZ19)[J].Carcinogenesis,2000,21(5):1051-1057.
[4]TAM P P,LIU W K.Gonadal development and fertility of mice treated prenatally with cadmium during the early organogenesis stages[J].Teratology,1985,32(3):453-462.
[5]CHENG J,FU JL,ZHOU Z C.The inhibitory effects of manganese on steroidogenesis in rat primary Leydig cells by disrupting steroidogenic acute regulatory(StAR) protein expression[J].Toxicology,2003,187(2-3):139-148.
[6]MIDZAK A S,CHEN H,PAPADOPOULOS V,et al.Leydig cell aging and the mechanisms of reduced testosterone synthesis[J].Molecular and Cellular Endocrinology,2009,299(1):23-31.
[7]ZOU Feiyan,BAI Shun,BAI Weibing,et al.Effects of 3-monochloropropane-1,2-diol on the cell growth in rat leydig tumor cells R2C[J].Journal of Food science and Biotechnology,2013,32(6):569-573.(in Chinese)
[8]CHENG J,FU J L,ZHOU Z C.The inhibitory effects of manganese on steroidogenesis in rat primary Leydig cells by disrupting steroidogenic acute regulatory(StAR) protein expression[J].Toxicology,2003,187(2-3):139-148.
[9]DE SOUZA P S F,DIAMANTE M A,DOLDER H.Testis response to low doses of Cadmium in Wistarrats[J].IntJ Exp Pathol,2010,91(2):125-131.
[10]FORTES G B,ALVES L S,DE OLIVEIRA R,et al.Heme induces programmed necrosis on Macrophages through autocrine TNF and ROS production[J].Blood,2012,119:2368-2375.
[11]TABET F,LAMBERT G,CUESTA T L F,et al.Lipid-free apolipoprotein A-I and Discoidal reconstituted high-density lipoproteins differentially inhibit glucose-induced oxidative stress in human macrophages[J].Arterioscler Thromb Vasc Biol,2011,31:1192-1200.
[12]ERDEMIR F,ATILGAN D,MARKOC F,et al.The effect of diet induced obesity on testicular tissue and serum oxidative stress parameters[J].Actas Urol Esp,2012,36(3):153-159.
[13]AMARAL A,LOURENCO B,MARQUES M,et al.Mitochondria functionality and sperm quality[J].Reproduction,2013,146(5):163-174.

