封口方式對紅曲產洛伐他汀的影響
齊文武,陳曉云,鄭世茂,龐 欣
(北京東方紅航天生物技術股份有限公司空間誘變研究中心,北京 101400)
紅曲為藥食兩用的傳統中藥材,以大米為原料經固體發酵制得,被廣泛應用于食品著色、釀酒以及中藥等[1-4]。近年來,紅曲霉的活性代謝產物洛伐他汀受到大家的廣泛關注。1979年,日本學者Endo等[5]從紅曲菌中分離出抑制羥甲戊二酰輔酶A還原酶活性更高的物質,后被稱作洛伐他汀。隨后,含有洛伐他汀的紅曲被開發成降血脂和治療心血管等疾病的新藥[6-7]。目前,紅曲霉發酵產洛伐他汀的生產工藝仍然以固態發酵更為有效[8-9]。微生物固態發酵遠遠不及液體發酵的工藝控制精準,雖然廣大科研工作者對紅曲固態發酵產洛伐他汀的影響因素已經有了一定的研究[10-11],但仍然有限。影響紅曲霉發酵的因素有養分組成、不同階段的發酵溫度、培養時間、通氣量等。到目前為止,關于紅曲發酵過程中的通氣方式、通氣量對發酵影響的研究不夠深入,種子液培養基和固體培養基的封口方式如何影響紅曲的次生代謝尚未見報道。本試驗采用紅曲霉固體發酵的方式,在發酵溫度、前體物質、初始pH、接種量和培養基含水率相同的前提下[12],研究在種子液及固體培養過程中,不同封口方式對發酵過程中及最終產物中洛伐他汀含量的影響,通過洛伐他汀含量的高低確定最適封口組合方式,進而優化紅曲發酵的工藝條件。
1 材料與方法
1.1 材料
1.1.1 菌種 所用菌種為本公司制備保存的菌種。
1.1.2 試劑及培養基材料 色譜級甲醇、無水乙醇、牛肉浸膏、大豆蛋白胨、葡萄糖、酵母浸膏和大米粉等。
1.1.3 儀器設備 Waters高效液相色譜儀、雙光束紫外分光光度計、分析天平、醫用離心機、高速粉碎機、超聲波清洗機、水浴鍋、各種型號標準篩等。
1.2 發酵方法
1.2.1 接種 將保藏菌種進行擴大培養,接種于種子液培養基,搖床培養72h后接種于固體培養基。
1.2.2 培養基配制 種子液培養基按照物料比例準確稱量,混勻,分裝,分別使用紗布、棉塞和試管膜進行封口,做好標記,121℃滅菌20min,冷卻至常溫后,備用。固體培養基按照物料比例準確稱量,混勻,分裝,分別使用紗布、棉塞和試管膜進行封口,做好標記,121℃滅菌30min,趁熱打開培養基中的凝塊,冷卻至常溫后,備用。
1.2.3 實驗處理 采用紗布、棉塞和試管膜3種封口方式,進行正交試驗(表1)。試驗編號說明:XX表示固體培養基封口方式+種子液培養基封口方式。
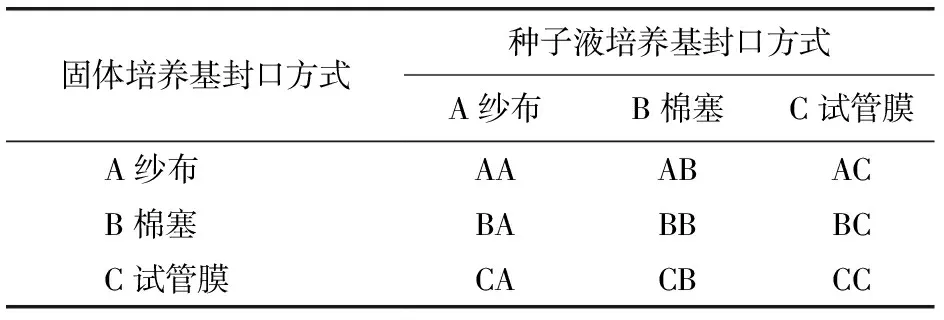
表1 封口組合方式
1.2.4 發酵、烘干、粉碎 接種后的固體培養基經過高溫發酵、低溫發酵得到紅曲。紅曲經烘干、粉碎、過篩、混勻、取樣檢測。
1.3 紅曲中洛伐他汀含量的測定
1.3.1 色譜參考條件 色譜柱:C18柱 150 mm×4.6 mm×5 μm;流動相:甲醇∶水∶磷酸=85∶15∶0.4(體積比);波長237 nm;柱溫25℃;
1.3.2 處理方法 樣品全部過100目標準篩,稱取0.1~0.2 g,置于8mL的離心管,精密加入4 mL 75%的乙醇溶液超聲處理1 h,取出,離心處理10 min,吸取上清液1 mL,加入0.5 mL的氫氧化鈉—乙醇溶液,搖勻,靜置10 min,加入0.5mL的磷酸—乙醇溶液,搖勻,靜置10 min后離心,取上清液5μL,檢測。
稱取內酯型洛伐他汀標準品,配制200g/mL的標準液。吸取標準液1 mL,加入0.5 mL的氫氧化鈉—乙醇溶液,搖勻,靜置10 min,加入0.5mL的磷酸—乙醇溶液,搖勻,靜置10 min后離心,取上清液5μL,檢測。
1.4 紅曲中洛伐他汀含量、桔青霉素含量的測定
依據《GB/T 5009.222-2008》[14]測定。
1.5 統計學方法
采用SPSS軟件對數據進行方差分析,P<0.05認為有統計學意義。
2 結果與分析
2.1 不同封口組合方式下發酵紅曲中洛伐他汀含量的變化
當紅曲進入低溫發酵階段后,從第4天開始取樣,每隔2d取樣1次,直至發酵結束,檢測不同處理方式隨發酵時間紅曲中洛伐他汀含量的變化,取樣檢測的結果見表2。高溫發酵階段(30~35℃),菌絲快速生長,生物量逐漸積累到一定階段后轉入低溫發酵。低溫發酵階段(20~25℃),利于洛伐他汀的積累[12],故從低溫階段開始取樣。從洛伐他汀合成量來看,當固體培養基采用紗布封口,同時種子液培養基采用紗布或棉塞封口時,紅曲中洛伐他汀含量的增長較快,洛伐他汀的產量最高;當固體培養基和種子液培養基均采用試管膜封口時,紅曲中洛伐他汀增長較慢,洛伐他汀的含量最低。從不同處理方式對紅曲產洛伐他汀的顯著性分析(表3)可以看出,在0.05的顯著性水平下,AA與AB這2種封口組合方式對紅曲產洛伐他汀無顯著性影響,但是與其余幾種封口組合方式相比,這2種方式可顯著提高發酵產物中的洛伐他汀含量,而且隨著時間的推移效果更為顯著。

表2 洛伐他汀合成量 單位:mg/g
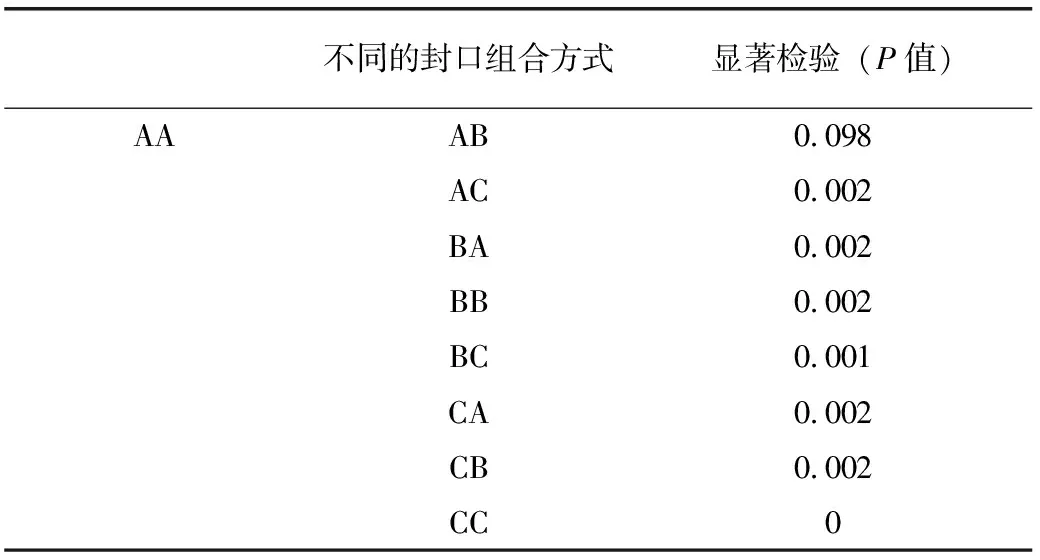
表3 不同封口方式組合對紅曲產洛伐他汀的影響
注:*顯著性水平為0.05
2.2 桔青霉素的檢測
9種不同封口組合方式下紅曲的發酵過程中均未檢測到桔青霉素[14]。桔青霉素是紅曲發酵產物中重要的有害成分,說明這幾種發酵方式均是安全可靠的。
3 結論
本試驗旨在研究紗布、棉塞和試管膜這3種不同的封口組合方式對紅曲產洛伐他汀含量的影響,結果發現,當固體培養基采用紗布封口,液體培養基采用紗布或棉塞封口時,紅曲產洛伐他汀的含量最高且桔青霉素未檢出。同時可以看出,在固體培養基封口固定的情況下,種子液培養基使用棉塞或紗布封口較試管膜封口得到的發酵產物中洛伐他汀的含量高;而種子液培養基使用棉塞和紗布封口得到的發酵產物中洛伐他汀的含量十分接近。整體看來,在種子液培養基封口方式相同情況下,固體采用紗布封口得到的洛伐他汀含量較其他2種方式均高,在固體培養基封口方式相同情況下,種子液培養基采用試管膜封口得到的洛伐他汀含量較其他2種方式均低,這與不同的封口方式、透氣性不同有關系,透氣性差不利于紅曲霉的次級代謝,這與文獻報道的增加發酵瓶中的透氣量對高產MonacolinK有利是一致的[10]。
綜合分析洛伐他汀合成量,低溫前10d,洛伐他汀增長迅速,之后洛伐他汀增長趨勢放緩,這與研究報道相吻合[9,11]。當固體培養基采用紗布封口,同時種子液培養基采用紗布或棉塞封口時,紅曲中洛伐他汀的長速較快,洛伐他汀的產量最高。
4 討論
傳統紅曲發酵工藝由于不能有效控制通風、溫度、濕度等重要發酵條件,所得紅曲的活性成分較低,且桔青霉素污染嚴重。紅曲發酵產洛伐他汀不僅受培養基組成的影響,培養條件對代謝產物洛伐他汀的產生也有顯著的影響,特別是通氣性,其在紅曲發酵過程中占據重要的作用[15-17]。因此,控制適當的通氣量對紅曲發酵非常關鍵。影響固態發酵過程中通氣性的因素包括發酵裝置、裝樣、初始含水量、翻曲頻率等均有所報道,本試驗則吸取前人的優秀成果結合企業目前的生產工藝,從固體與種子液培養基的封口方式研究通氣條件對紅曲產洛伐他汀的影響。試管膜使用方便,但在長期的生產中,筆者發現該封口方式洛伐他汀的產量一直很難有所提高,本次研究有效證明了由于試管膜的通氣性較差影響了最終的洛伐他汀含量;棉塞是傳統的封口方式,但由于存在易污染、難清洗等問題,在生產中已逐漸不再采用;紗布封口不僅通氣量是3種方式中最適宜的,而且易清洗,可重復利用,也比較符合工業化生產的成本控制原則,為進一步優化工業化生產的發酵條件、改善紅曲發酵工藝提供了新思路。◇
[1]王政軍.中國古代酒曲制造發展簡述[J]. 釀酒科技,2016(1):107-109.
[2]陳春艷.功能紅曲與紅曲色素的研究進展[J]. 湖南科技學院學報,2007,28 (9):40-42.
[3]卓林霞.紅曲的研究概況及其產品的前景展望[J]. 輕工科技,2012(2):8-9.
[4]紀遠中.紅曲與紅曲霉的研究現狀及進展[J].天津藥學,2005,17(2):65-67.
[5]Endo Akira.Momacolin K a new hypocholesterolemic agent prodiced by a Monascusspecies[J]. The Journal of Antibiotics,1979(32):852-854.
[6]王玲,吳軍林,吳清平.紅曲降血脂功能的研究劑應用概況[J]. 食品工業科技,2014,8(35):387-389.
[7]逯慎杰,劉秀河.功能性紅曲中功能成分的研究進展[J]. 江蘇調味副食品,2011,28(1):18-21.
[8]董永勝,劉同軍,賈士儒.紅曲霉固態發酵生產藝條件的研究[J].食品研究與開發,2007,28(6):27-30.
[9]王偉平,夏福寶.紅曲霉發酵法生產Momacolin K研究進展[J]. 藥物生物技術,2002,9(5):301-304.
[10]王啟軍,孫小燕,張水華,等.發酵瓶及相關工藝條件對紅曲固態發酵產Monacolin K的影響[J].食品科技,2008,33(4):9-11.
[11]郭曉旭,袁朝琪,李國瑩,等.高產Monacolin K 純種紅曲培養條件的研究[J]. 工業微生物,2016,46(1):27-30.
[12]陸磊,劉秀河.功能性紅曲米發酵工藝及控制[J]. 山東食品發酵,2013(4):9-12.
[13]齊文武,陳曉云,鄭世茂,等.高產洛伐他汀的功能性紅曲固態發酵營養液最佳pH值的研究[J]. 中國食物與營養,2017,23(4):34-37.
[14]GB/T 5009.222-2008.紅曲類產品中桔青霉素的測定[S].
[15]陳勉華,吉達維,馬人杰,等.不同發酵基質對紅曲重要代謝產物的影響[J].中國釀造,2013,32(3):22-24.
[16]秦紅霞,周立平,嘉曉勤.N十離子注入篩選高產色素的紅曲菌株及其發酵條件的研究[J].中國釀造,2011,4(229):68-71.
[17]陸磊.產Monacolin K的功能性紅曲固態發酵工藝優化研究[D].山東:齊魯工業大學,2014.

