復合保鮮劑對腐生葡萄球菌的抑菌活性及其作用機理
朱亞珠 林森森
(浙江國際海運職業技術學院,浙江 舟山 316021 )
中國毛蝦蝦皮是一種營養豐富的傳統水產制品,因其味道鮮美,蛋白質含量高,且富含人體所需多種維生素與礦物質而深受消費者喜愛。然而在生產流通過程中蝦皮易受微生物、氧化等的影響,容易出現變色、異味甚至腐敗變質的情況[1]。采用合適的保鮮處理方式,以抑制蝦皮在貯藏期間微生物的生長,延緩其品質的劣變,已成為當前急需解決的問題。保鮮劑是添加到食品中實現抑制微生物生長、抗氧化等目的的食品添加劑。
前期研究[2]表明,腐生葡萄球菌是蝦皮貯藏過程中的主要優勢腐敗菌之一,為葡萄球菌屬非致病性革蘭氏陽性菌。腐生葡萄球菌能分泌蛋白酶和脂酶,在肉制品貯藏過程中可導致脂質分解和蛋白質降解,從而產生小分子醛、酮、醇、胺和有機酸等腐敗代謝產物影響產品品質[3]。王芳等[4]研究了肉桂精油對腐生葡萄球菌的抑菌作用,得到了較好的效果。汪玲玲等[5-7]比較了幾種食用防腐劑對金黃色葡萄球菌的抑菌作用,結果表明抑菌(殺菌)效果較好的均為一些生物防腐劑如乳酸鏈球菌素、茶多酚、殼聚糖和溶菌酶等。山梨酸鉀能有效防止葡萄球菌的生長和繁殖[8],選擇山梨酸鉀、苯甲酸鈉、蔗糖酯等復合食品添加劑,檢測其對金黃色葡萄球菌生物被膜的影響,發現在一定質量濃度范圍內,對金黃色葡萄球菌生物被膜的形成均具有一定的抑制作用[9]。施建兵等[10]34-43采用復合保鮮劑(茶多酚、溶菌酶和殼聚糖)對鯧魚塊中腐生葡萄球菌的抑菌效果進行研究,結果表明該復合保鮮劑能夠顯著抑制腐生葡萄球菌的生長,并顯著延緩魚塊品質的變化。生物防腐劑由于價格高、用量大等因素限制了實際應用。而山梨酸鉀、雙乙酸鈉和異抗壞血酸鈉是安全性較高且價格相對低的防腐劑,在食品保鮮中已廣泛應用。目前,復合保鮮劑主要應用在果蔬和水產品中,水產品中的應用主要集中在對新鮮的魚類和對蝦的保鮮[11],但在蝦皮中的應用鮮有報道,而采用山梨酸鉀、雙乙酸鈉和異抗壞血酸鈉組成的復合保鮮劑對腐生葡萄球菌的抑制作用未見報道。因此,研究復合保鮮劑對蝦皮中腐生葡萄球菌的抑菌機制具有重要意義。本課題組前期有關蝦皮保鮮劑篩選及保鮮效果研究表明[12],山梨酸鉀和雙乙酸鈉具有較好的抑菌效果,而異抗壞血酸鈉具有較好的護色和抗氧化作用,通過不同特性的抗菌保鮮劑復合使用,對蝦皮的貯藏與流通過程可起到較好的保鮮效果。
本試驗在前期研究基礎上,以腐生葡萄球菌為對象,將山梨酸鉀、雙乙酸鈉與異抗壞血酸鈉復配成復合保鮮劑,由酶標法確定復合保鮮劑對腐生葡萄球菌的最低抑菌濃度(MIC)和最低殺菌濃度(MBC),并結合抑菌活力、細菌生長曲線、細胞膜完整性、堿性磷酸酶(AKP)含量與細菌超微結構觀察,進一步探討復合保鮮劑的抑菌機制,綜合評價復合保鮮劑在不同處理時間對腐生葡萄球菌的影響,闡明復合保鮮劑對腐生葡萄球菌的抑菌機理。
1 材料與方法
1.1 材料與儀器
1.1.1 試驗材料
試驗菌株分離自中國毛蝦蝦皮,經16S rDNA鑒定為腐生葡萄球菌(ATCC 15305)。
1.1.2 試劑與培養基
山梨酸鉀、雙乙酸鈉:食品級,寧波王龍集團有限公司;
異抗壞血酸鈉:食品級,江西省德興市百勤異VC鈉有限公司;
堿性磷酸酶(AKP)測試盒:南京建成生物工程研究所;
平板計數培養基(PCA培養基):國藥集團化學試劑有限公司;
營養肉湯培養基:杭州微生物試劑有限公司;
戊二醛、乙醇、叔丁醇、磷酸鹽:分析純,國藥集團化學試劑有限公司。
1.1.3 儀器與設備
立式壓力蒸汽滅菌器:LDZX-75KBS型,上海申安醫療器械廠;
超凈工作臺:ZHJH-C1118B型,上海智成分析儀器制造有限公司;
掃描電子顯微鏡:S-3400N型,日立有限公司;
掃描型紫外可見分光光度計:UV-3200型,上海美譜達儀器有限公司;
落地高速冷凍離心機:D-37520型,美國Thermo Fisher Scientific公司;
電導率儀:DDS-11C型,上海儀電科學儀器股份有限公司;
酶標儀:Plate Reader M200 型,瑞士Tecan集團有限公司。
1.2 試驗方法
1.2.1 復合保鮮液制備 復合保鮮劑由山梨酸鉀、雙乙酸鈉和異抗壞血酸鈉按一定比例和方法配制,配制比例參考前期使用的方法[12],配比濃度為山梨酸鉀1.0 g/L、雙乙酸鈉0.5 g/L 與異抗壞血酸鈉2.0 g/L。
1.2.2 菌株活化 將試驗菌腐生葡萄球菌菌株在營養肉湯中活化后,接種于100 mL營養肉湯培養基中,于搖床(37 ℃、160 r/min)培養24 h后離心(4 000 r/min,15 min),用無菌去離子水洗滌3次,并將其稀釋成106CFU/mL的菌懸液備用。
1.2.3 最低抑菌濃度(MIC)與最低殺菌濃度(MBC)的測定
根據韋何雯[13]的96孔板酶標比濁法,修改如下:用無菌蒸餾水配制好復合保鮮劑(3 500 μg/mL),備用。在96孔酶標板上,用無菌營養肉湯將復合保鮮劑依次稀釋成濃度為3 500,1 750,875,438,219,109,55,0 μg/mL的抗菌液100 μL。在8個孔中分別加入事先稀釋好的腐生葡萄球菌菌懸液(104CFU/mL)100 μL,此時,各孔中的有效保鮮劑濃度依次為1 750,875,438,219,109,55,27,0 μg/mL。平行操作3次。用酶標儀測定各孔的初始OD600值,再將酶標板置于37 ℃恒溫培養24 h,取出后再次測定各孔的OD600值,并計算前后△OD600的絕對值,取3次操作的平均值。
(1) 最低抑制濃度(MIC)的確定:△OD600≤0.05的保鮮劑最低濃度,并結合肉眼觀察澄清者。
(2) 最低殺菌濃度(MBC)的確定:從細胞板中,將含有大于MIC復合保鮮劑的菌懸液各吸取0.1 mL涂布于營養瓊脂培養基平板上,置于37 ℃恒溫箱中繼續培養24 h,活菌數與初始值相比減少99.9%的最低抑菌劑濃度即為保鮮劑的最低殺菌濃度,每個濃度梯度做2個平行,試驗重復3次。
1.2.4 抑菌活力的測定 根據藍蔚青等[6]的方法,修改如下:按1.2.3中的方法配制復合保鮮劑濃度為MIC和MBC的菌懸液,并用無菌去離子水代替保鮮劑作對照組,于37 ℃、160 r/min搖床培養,分別于培養0,1,2,3,4,5,6,7 h時用酶標儀測定630 nm處的吸光度值,并繪制曲線。抑菌活力按式(1)計算[14]:
(1)
式中:
U——抑菌活力;
A0——對照組的吸光度;
A——處理組的吸光度。
1.2.5 復合保鮮劑對腐生葡萄球菌生長的影響 參考翁佩芳等[15]的方法,按1.2.3中的方法配制復合保鮮劑濃度為MIC和MBC的菌懸液,并用無菌去離子水代替保鮮劑作對照組。用酶標儀測定各孔的初始OD600值;然后將酶標板置于37 ℃恒溫培養箱中培養24 h,每隔2 h測定并記錄菌懸液的OD600值。相同過程重復3次,求平均值。以培養時間為橫坐標,OD600值為縱坐標,繪制腐生葡萄球菌的生長曲線。
1.2.6 復合保鮮劑對菌體細胞壁、細胞膜通透性的影響
(1) 對細胞壁通透性影響:配制復合保鮮劑濃度分別為MIC和MBC的菌懸液,并用無菌去離子水代替保鮮劑作對照組。于37 ℃、160 r/min搖床培養,分別于培養0,1,2,3,4,5,6,7 h時取樣,離心(4 000 r/min,10 min)后取上清液,用堿性磷酸酶(AKP)測試盒測定其含量。
(2) 對細胞膜通透性影響:取1.2.6(1)離心后的上清液,測定其在260 nm處的吸光度值。
(3) 對細胞質滲漏影響:取1.2.6(1)離心后的上清液,用電導儀測定其電導率。每個樣品重復3次,取平均值。
1.2.7 菌體細胞超微結構觀察 根據藍蔚青等[6]的方法,修改如下:取適量菌懸液(對數期)離心(4 000 r/min,15 min),用無菌去離子水洗滌菌體沉淀3次,并稀釋成菌落總數為105CFU/mL的菌懸液。試驗組加入復合保鮮劑使其終濃度為MBC,對照組加入等量的無菌生理鹽水,2組菌液于37 ℃、160 r/min 搖床培養10 h。分別取10 mL菌液,離心(4 000 r/min,15 min),菌體沉淀用PBS緩沖液洗滌3次后,用2.5%的戊二醛固定12 h,再分別用30%,50%,70%,90%的乙醇梯度脫水,隨后叔丁醇干燥,冷凍干燥后固定、噴金,最后在掃描電鏡下觀察菌體的形態結構。
2 結果與分析
2.1 復合保鮮劑最低抑菌濃度(MIC)與最低殺菌濃度(MBC)的確定
MIC與MBC的測定結果見表1。由表1可知,復合保鮮劑濃度≥109 μg/mL時,其△OD600值均<0.05,且在109,55 μg/mL濃度下的△OD600值差距明顯,且隨著濃度的增加,△OD600值下降較為顯著。這表明復合保鮮劑濃度≥109 μg/mL 時,對腐生葡萄球菌有較好的抑制效果,且其抑菌作用隨著保鮮劑濃度的下降而逐漸減弱。故復合保鮮劑對菌體的最低抑菌濃度為109 μg/mL。選擇復合保鮮劑濃度>109 μg/mL的幾個梯度處理菌體進行瓊脂平板培養,結果顯示最低殺菌濃度(MBC)為219 μg/mL。資料顯示,較多保鮮劑和復合保鮮劑對葡萄球菌的最低抑菌濃度和最低殺菌濃度為千分比濃度,如藍莓提取物對金黃色葡萄球菌的MIB和MBC分別為300,450 mg/mL[16];殼聚糖、溶菌酶與茶多酚配制而成的復合保鮮劑對金黃色葡萄球菌的MIB和MBC分別為0.8,1.6 mg/mL[6]。本研究中采用的復合保鮮劑對腐生葡萄球菌的MIB和MBC則為百萬分比濃度,抑菌效果較為突出。

表1 復合保鮮劑濃度對腐生葡萄球菌的抑菌效果
2.2 復合保鮮劑的抑菌活力
為進一步表征在MIC和MBC濃度下復合保鮮劑的抑菌活力,研究了復合保鮮劑的抑菌活性與時間的關系,結果見圖1。分別用MIC與MBC濃度的復合保鮮劑處理腐生葡萄球菌后,都分別在1,3 h時出現活性最高峰,隨后抑菌活力逐漸減弱。此外,MBC處理后的抑菌活性明顯高于MIC處理組,故復合保鮮劑質量濃度與抑菌效果呈正相關。
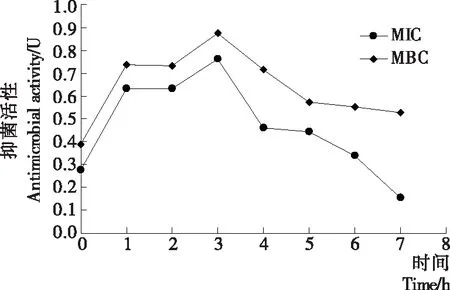
圖1 復合保鮮劑對腐生葡萄球菌的抑菌動力學
Figure 1 Antibacterial kinetics of complex preservatives againstStaphylococcussaprophyticus
2.3 復合保鮮劑對腐生葡萄球菌生長的影響
細菌培養液一般在600 nm左右具有最大的吸光值,故可以根據菌懸液的OD600值來判斷細菌的菌體數量。由圖2可知,對照組的腐生葡萄球菌生長正常,2~12 h階段為細菌的生長對數期,該階段菌體數量增長迅速,12 h后增長較緩慢,進入穩定期。與對照組相比,2~12 h時,MIC組與MBC組的生長速度顯著降低,進入穩定期(12 h)后,MIC組與MBC組的菌體量也顯著小于對照組。結果表明,經MIC和MBC濃度的復合保鮮劑處理后,腐生葡萄球菌的生長受到明顯抑制,且MBC濃度的抑制作用明顯高于MIC濃度的。

圖2 復合保鮮劑對腐生葡萄球菌生長的影響
Figure 2 Effects of complexpreservatives on the growth ofStaphylococcussaprophyticus
2.4 復合保鮮劑對細菌細胞壁的影響
堿性磷酸酶(AKP)是一種廣泛存在于動植物及微生物體內的磷酸單酯水解酶,在生物體內的物質代謝中具有重要作用,它參與了磷酸基團的轉移和代謝,能調節Ca2+的代謝,并且與多種大分子位置的代謝有關[17]。AKP一般存在于細胞壁和細胞膜間,一般情況下無法在活體細胞外檢測到其活性,當細胞壁或細胞膜(尤其是細胞壁)遭到破壞后,細胞的通透性增加,AKP則會泄漏至胞外。因此,可通過檢測菌體胞外的AKP含量來了解細胞壁通透性的變化[18]。
從圖3可知,在0~6 h時,3個試驗組的AKP量都緩慢增長,6 h后增長迅速。1 h后MIC組和MBC組的AKP量明顯高于對照組,其中,MBC組的AKP量增加更為明顯。表明復合保鮮劑處理使腐生葡萄球菌細胞壁通透性增加,影響其生長與代謝。此外,細胞壁通透性增加還可能造成菌體電解質外泄增多,破壞細胞內環境和細胞膜的穩定性,從而進一步抑制菌體的生長[10]49-50。
Figure 3 Effects of complex preservatives on cell wall ofStaphylococcussaprophyticus
2.5 復合保鮮劑對細菌細胞膜穩定性的影響
細胞膜是細菌的第2道屏障,當細胞膜遭到破壞后,膜內小分子物質及核酸等大分子物質隨之泄漏出來。故通過檢測菌液260 nm處的吸光值來測定菌液中胞外核酸的含量,從而了解細胞膜的破壞程度。由圖4可知,隨著作用時間的延長,MIC組與MBC組的吸光值明顯高于對照組,且在2~8 h時其吸光值快速上升,分別從0.205,0.313增加到0.935,1.285;處理8 h后,試驗組的吸光值顯著高于對照組(0.35)(P<0.05);對照組的吸光值隨時間的延長其增速較為緩慢。由此可見,復合保鮮劑對細菌細胞膜有一定的破壞作用,且破壞強度與保鮮劑濃度呈正相關。
當復合保鮮劑破壞細胞膜后,菌體的保護屏障被打破,菌體內部電解質外泄至培養液中,從而使培養液的電導率值上升[19]。因此,可通過菌液電導率值的變化來了解細菌細胞膜的通透性變化[20]。由圖5可知,在0~8 h時,MIC組和MBC組菌懸液的電導率明顯高于對照組,且隨著時間的延長,MIC組和MBC組的電導率值顯著增大,而對照組增速較為緩慢。

圖4 復合保鮮劑對腐生葡萄球菌膜完整性的影響
Figure 4 Effects of complex preservatives on adventitia permeability ofStaphylococcussaprophyticus

圖5 復合保鮮劑對腐生葡萄球菌細胞質滲漏的影響
Figure 5 Effects of complex preservatives on cytoplasmic leakage ofStaphylococcussaprophyticus
MBC組菌懸液的電導率明顯高于對照組,且隨著時間的延長,MIC組和MBC組的電導率值顯著增大,而對照組增速較為緩慢。
0 h時,MBC組、MIC組和對照組的電導率分別為16.465,16.342,16.462 μs/cm,說明試驗組培養液中含有的復合保鮮劑和對照組中含有的去離子水的電導率基本一致,故排除了由于培養液成分不同造成的影響。在0~1 h時,對照組的電導率增加較明顯,在其后時間中電導率增加較緩慢,維持在相對穩定的狀態,與藍蔚青等[19]研究結果一致,對照組菌懸液的相對電導率在0~2 h時增加較快,可能與對照試驗采用的無菌去離子水有關,菌體在該環境生長,本身就會發生部分裂解而導致電導率上升;也有可能是細菌在正常的生長代謝期間,選擇性透過H+、K+、Na+、Ca2+等離子[20],培養液積累了這些小分子物質使得電導率明顯增加。試驗組在0~1 h時,電導率顯著增加,MBC組和MIC組的電導率增速分別為1.885,1.305 μS/(cm·h);在1~8 h時,電導率雖增加顯著,但增速放緩,分別為0.15,0.17 μS/(cm·h),可能是復合保鮮劑對細胞膜的破壞作用在培養前期已發揮較大作用,導致大量菌體細胞膜破裂。260 nm吸光值與電導率測定結果較一致,根據以上結果推測,復合保鮮劑使菌體細胞膜受到破壞或滲透性增加,導致胞內電解質大量泄露至培養液中,影響其正常代謝,最終導致死亡。
2.6 復合保鮮劑對細菌細胞形態的影響
對照組和MBC組中腐生葡萄球的電鏡掃描結果見圖6。從圖6中可看出,對照組的菌體細胞較完整、胞體呈立體球狀且飽滿,細胞表面完整、光滑;經MBC濃度處理12 h后,菌體表面出現不平整,部分細胞表面出現凹陷、干癟,一部分菌體出現成團的破裂,使內容物逐漸滲出至胞外。由此可見,復合保鮮劑對菌體有損傷作用,使菌體細胞表面破損。

圖6 處理12 h的腐生葡萄球菌的掃描電鏡圖
Figure 6 Scanning electron microscopy ofStaphylococcussaprophyticustreated for 12 h
3 結論
以配比濃度為山梨酸鉀1.0 g/L、雙乙酸鈉0.5 g/L與異抗壞血酸鈉2.0 g/L的混合液為復合保鮮劑,作用于腐生葡萄球菌具有較好的抑菌效果。研究表明,復合保鮮劑的MIC為109 μg/mL,MBC為219 μg/mL。復合保鮮劑對腐生葡萄球菌有較好的抑菌活力,并且能明顯抑制菌體繁殖。胞外堿性磷酸酶含量、核酸含量和電導率的測定結果較一致,表明復合保鮮劑對腐生葡萄球菌的細胞壁和細胞膜均有影響,破壞了細胞的完整性。經復合保鮮劑處理的腐生葡萄球菌菌體細胞發生了表面凹陷、干癟和破裂現象。腐生葡萄球菌是蝦皮貯藏過程中的主要優勢腐敗菌,本研究為蝦皮貯藏和流通中的保鮮應用提供了一定參考。
[1] 沈月新. 水產食品學[M]. 北京: 中國農業出版社, 2001: 23-24.
[2] 朱亞珠, 翁佩芳, 劉娜, 等. 中國毛蝦貯藏過程細菌群落多樣性分析[J]. 核農學報, 2017, 31(9): 1 759-1 766.
[3] ZAREI M, MAKTABI S, GHORBANPOUR M. Prevalence of Listeria monocytogenes, Vibrio parahaemolyticus, Staphylococ-cus aureus, and Salmonella spp. in seafood products using multiplex polymerase chain reaction[J]. Foodborne Pathogens & Disease, 2011, 9(2): 108-112.
[4] 王芳, 曹錦軒, 潘道東, 等. 肉桂精油對成團泛菌和腐生葡萄球菌的抑菌活性及其機理[J]. 食品工業科技, 2016, 37(19): 75-80.
[5] 汪玲玲, 郝淑賢, 呂彥均. 食用防腐劑對金黃色葡萄球菌生長參數的影響[J]. 食品科學, 2013, 34(15): 62-65.
[6] 藍蔚青, 謝晶, 毛峰, 等. 復合生物保鮮劑對金黃色葡萄球菌的抑菌作用研究[J]. 食品與生物技術學報, 2014, 33(8): 814-820.
[7] 王瓊, 唐俊妮, 湯承, 等. 6種食品防腐劑對金黃色葡萄球菌抑菌效果及腸毒素基因表達的影響[J]. 食品科學, 2016, 37(21): 151-156.
[8] 任劍豪, 吳衛國. 山梨酸及其鉀鹽防腐效果的研究進展[J]. 南方農業, 2017, 11(17): 77-78.
[9] 謝麗斯, 張文艷, 許佳晶, 等. 食品添加劑對食源性金黃色葡萄球菌生物被膜的影響[J]. 食品科學, 2012, 33(17): 154-157.
[10] 施建兵, 謝晶. 復合保鮮方法對鯧魚保鮮效果及抑菌機理的研究[D]. 上海: 上海海洋大學, 2014.
[11] 劉淑敏, 邵興鋒. 復合生物保鮮劑在水產品保鮮中的應用[J]. 生物技術進展, 2013, 3(6): 408-411, 438.
[12] 李馥君, 翁佩芳, 朱亞珠, 等. 中國毛蝦(Acetes chinensis)蝦皮復合保鮮劑篩選及保鮮效果的研究[J]. 食品工業科技, 2017, 38(6): 333-338.
[13] 韋何雯. 月桂酸單甘油酯在低溫肉制品中的應用研究[D]. 杭州: 浙江大學, 2008: 42-54.
[14] HARA S, YAMAKAWA M. Moricin, a novel type of antibacterial peptide isolated from the silkworm, bombyx mori[J]. Journal of Biological Chemistry, 1995, 270(50): 29 923-29 927.
[15] 翁佩芳, 江華珍, 馮鳳琴, 等. 酶標比濁法評價月桂酸單甘油酯對肉葡萄球菌的抑菌活性[J]. 中國食品學報, 2012, 12(5): 188-194.
[16] 沈瀟, 孫曉紅, 趙勇謝, 等. 藍莓提取物對及黃色葡萄球菌的抑制作用研究[J]. 天然產物研究與開發, 2012, 24(11): 1 622-1 625.
[17] 劉曉雯, 劉克武, 楊守忠, 等. 大涼疣螈堿性磷酸酶的分離純化及部分性質[J]. 中國生物化學與分子生物學報, 2001, 17(1): 135-138.
[18] CHEN C Z, COOPER S L. Interactions between dendrimer biocides and bacterial membranes[J]. Biomaterials, 2002, 23(16): 3 359-3 368.
[19] 藍蔚青, 謝晶, 侯偉峰, 等. 復合生物保鮮劑對腐敗希瓦氏菌的抑菌機理[J]. 江蘇農業學報, 2012, 28(1): 186-192.
[20] DIAO Wen-rui, HU Qing-ping, ZHANG Hong, et al. Chemical composition, antibacterial activity and mechanism of action of essential oil from seeds of fennel (Foeniculum vulgare Mill)[J]. Food Control, 2014, 35(1): 109-116.

