膀胱癌根治術前單次動脈灌注化療的長期療效評估
瓦斯里江·瓦哈甫 劉 賽 王夢童 賀慶豹 宋黎明 平 浩 王明帥 楊飛亞 田溪泉
(首都醫科大學附屬北京朝陽醫院泌尿外科,北京 100020)
肌層浸潤性膀胱癌(muscle-invasive bladder cancer, MIBC)的5年生存率約為60%~70%,這一預后在過去30年內沒有顯著地提高[1-2]。根治性膀胱切除術加擴大淋巴結清掃是治療浸潤性膀胱癌的標準術式,但Zehnder等[3]回顧30年的手術病例發現其并沒有顯著改善生存率。近十幾年里,順鉑為基礎的新輔助化學藥物治療(以下簡稱化療)的循證醫學證據明顯高于術后輔助化療,而且預后也有所提高[4-6]。然而2010年美國國家癌癥數據庫顯示僅有大約21%的患者接受新輔助和術后輔助化療,大多數手術患者沒有接受過化療[7]。除了對于化療不敏感的患者,新輔助化療將可能導致過度治療以外,延誤手術時機也是醫生考慮的主要原因[8]。腹腔鏡膀胱癌根治(laparoscopic radical cystectomy, LRC)術前短期進行單次動脈灌注化療是否可以在不延誤手術時機的同時影響預后是本研究的目的。
1 資料與方法
1.1 一般資料
2006年2月至2015年12月首都醫科大學附屬北京朝陽醫院泌尿科共有26例行LRC的患者在術前2~4周內行單次動脈灌注化療(吉西他濱+順鉑)。其中,男性22(84.6%)例,女性4(15.4%)例,年齡55~71歲,平均年齡60歲。體質量指數為(25.2±3.12)kg/m2,平均麻醉評分為2分(1~3分),年齡相關的Charlson合并癥指數[9]評分為4分(3~7分),東部腫瘤協作組(Eastern Cooperative Oncology Group, ECOG)評分為1分。26例患者中既往高血壓者12例(46.2%),糖尿病者4例(15.4%),吸煙者15例(57.7%)。
1.2 術前病理
術前腫瘤活檢病理或影像學資料診斷為肌層浸潤性或高危的非肌層浸潤性膀胱尿路上皮癌分期: cT1N0M0為1例,cT2aN0M0為6例,cT2bN0M0為4例,cT3aN0M0為4例,cT3aN1M0為1例,cT3bN0M0為6例,cT3bN1M0為1例,cT4aN0M0為2例,cT4aN1M0為1例。
1.3 治療方法及化療后血液學檢查
26例患者均在局部麻醉下采用Seldinger技術穿刺右股動脈,在導絲引導下將Cobra導管置入髂內動脈灌注順鉑(70 mg/m2)和吉西他濱(1 000 mg/m2),根據計算的患者肌酐清除率情況將化療藥物灌注劑量調整為70%~100%。患者化療后術前復查血液學檢查均值:血紅蛋白134 g/L(88~158 g/L),紅細胞壓積38.7%(27.1%~47.1%),白細胞6.5×109/L(3.38~11.3×109/L),血小板220×109/L(141~362×109/L),肌酐79.9 μmol/L(53~127.3 μmol/L),尿素氮5.9 mmol/L(3.81~9.58 mmol/L),白蛋白35 g/L(24.6~42.7 g/L)。
1.4 統計學方法
應用 SPSS 19.0 (SPSS Inc, Chicago, IL, USA)軟件對數據進行分析。采用Wilcoxon配對秩和檢驗比較26例患者手術前后的病理分期情況。根據癌癥級別將26例患者分為低級別組和高級別組,采用Kaplan-Meier生存分析中的Log-rank檢驗比較兩組患者生存率并繪制兩組患者的總體生存曲線和疾病特異性生存曲線。采用Fisher精確檢驗和Mann-WhitneyU檢驗比較兩組患者的術后合并癥情況。以P<0.05為差異具有統計學意義。
2 結果
2.1 圍術期一般資料
26例患者動脈灌注化療后2~4周內行LRC,回腸膀胱9例(34.6%),原位回腸新膀胱15例(57.7%),輸尿管皮膚造口2例(7.7%),無中轉開放。平均手術時間373 min(210~600 min),平均術中出血量為407 mL(100~1 400 mL)。7例(26.9%)圍術期有輸懸浮紅細胞或新鮮血漿,2例(7.7%)術后入重癥監護室。術后腸道功能恢復平均時間4.8 d(1~18 d),引流管拔除平均時間12.4 d(5~28 d)。
2.2 術后病理比較
術后病理提示均為尿路上皮癌,其中3例伴鱗樣分化,2例伴腺樣分化,4例伴原位癌,6例低級別,20例高級別,切緣均未見腫瘤。有7例患者的腫瘤臨床分期與病理分期相符[采用2002年世界衛生組織(World Health Organization, WHO) TNM分期標準],包括1例T1, 2例T2a,1例T2b,2例T3a和1例T3b;降期17例,包括4例T2a降為T1,1例T2b降為T1,1例T2b降為T2a,1例T3a降為T1,1例T3a降為T2a,2例T3b降為T1,1例T3b降為T2a,1例T3b降為T2b,2例T3b降為T3a,1例T4a降為T3a,2例T4a降為T3b;升期2例,包括1例T3a升為T4a和1例T2b升為T3a。對手術前后的病理分期結果進行配對秩和檢驗(Wilcoxon Signed Ranks Test),發現其差異具有統計學意義(Z=-3.157,P=0.002),詳見表1,可見動脈灌注化療局部降期效果顯著。平均淋巴結清掃數目17個(8~28個),8例患者淋巴結陽性,陽性數目為12個。
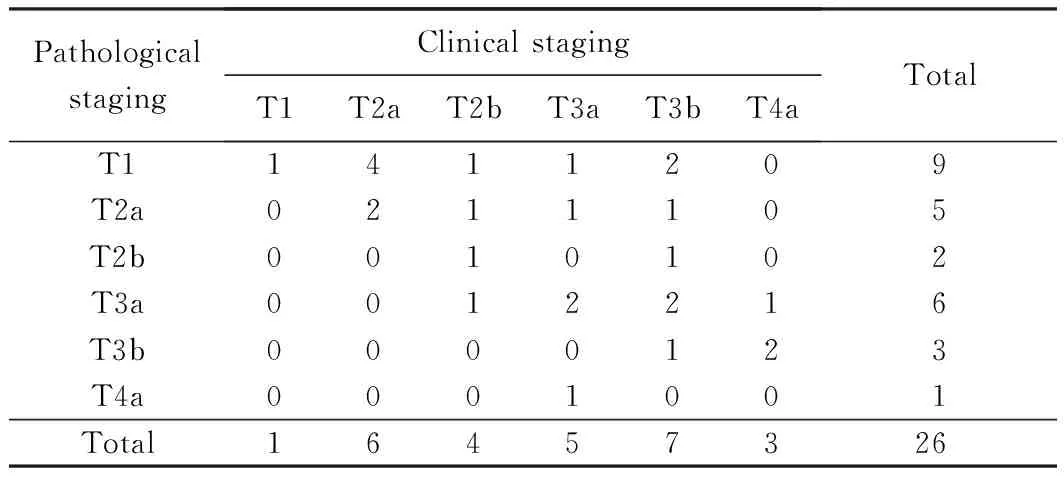
表1 手術前后病理分期Tab.1 Pathological staging before and after surgery
Wilcoxon Signed Ranks Test,Z=-3.157,P=0.002。
2.3 術后合并癥
根據Clavien-Dindo分級系統對術后合并癥進行評估[10]:術后30 d內合并癥,2級21例(80.8%),3級3例(11.5%),病理級別可見低級別6例,高級別18例,對此進行分析顯示低級別和高級別腫瘤之間術后合并癥差異無統計學意義(P=0.081,圖1);術后30至90 d內的短期合并癥,2級1例(3.8%),3級1例(3.8%),該2例病理為高級別;術后超過90 d的長期合并癥3級1例(3.8%),4級1例(3.8%),該2例病例為高級別。
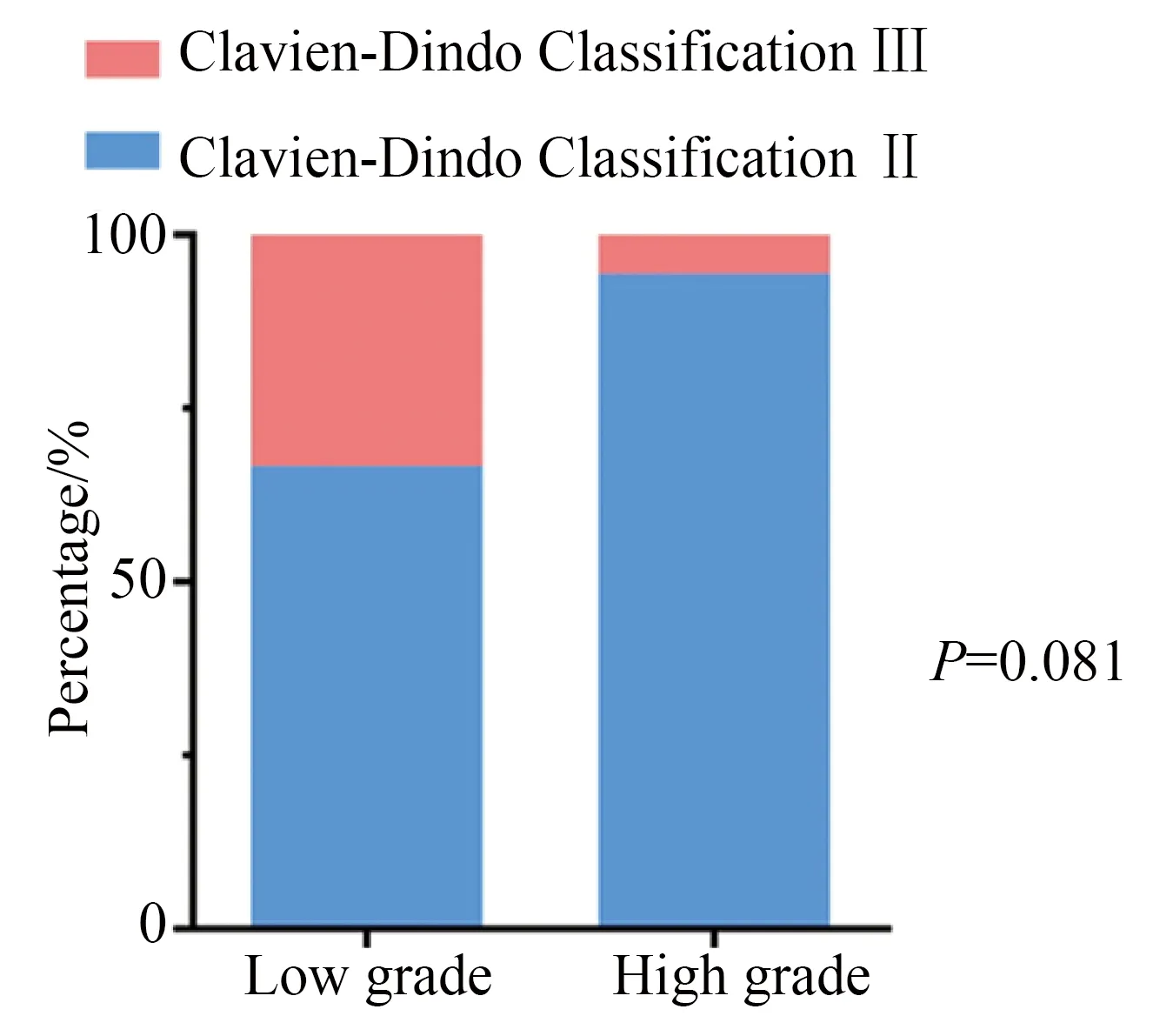
圖1 術后30 d內合并癥情況構成比分析Fig.1 Analysis of the 30 days postoperative complicationsratio between high-grade and low-grade tumor
2.4 術后隨訪
26例患者平均隨訪時間88個月(2~121個月),有3例患者死亡,其中2例分別于術后11和31個月因腫瘤擴散死亡,1例于術后2個月因腸梗阻拒絕手術治療死亡。總生存率和腫瘤特異性生存率見圖2。將患者分為病理高級別組和低級別組進行生存率比較,總生存率(P=0.746)和腫瘤特異性生存率(P=0.446)差異均無統計學意義(圖3)。
3 討論
全球范圍內膀胱癌每年的新發病例數約為430 000,主要病理類型為尿路上皮癌[11]。大約70%的新發病例為非肌層浸潤性膀胱癌,5年的總生存率為90%,而剩余的20%~40%的患者為MIBC或者進展性(T4b、或者N1-3、或者M1)腫瘤,一旦發生遠處轉移,5年總生存率僅為6%[1-2]。因此,積極的治療MIBC患者是避免遠處轉移和提高生存率的關鍵時機。
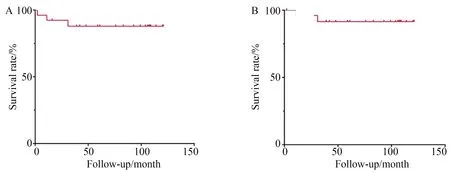
圖2 動脈灌注化療總生存率和腫瘤特異性生存率Fig.2 Overall survival and cancer-specific survival in intra-arterial chemotherapy group
A:overall survival in intra-arterial chemotherapy group;B:cancer-specific survival in intra-arterial chemotherapy group.
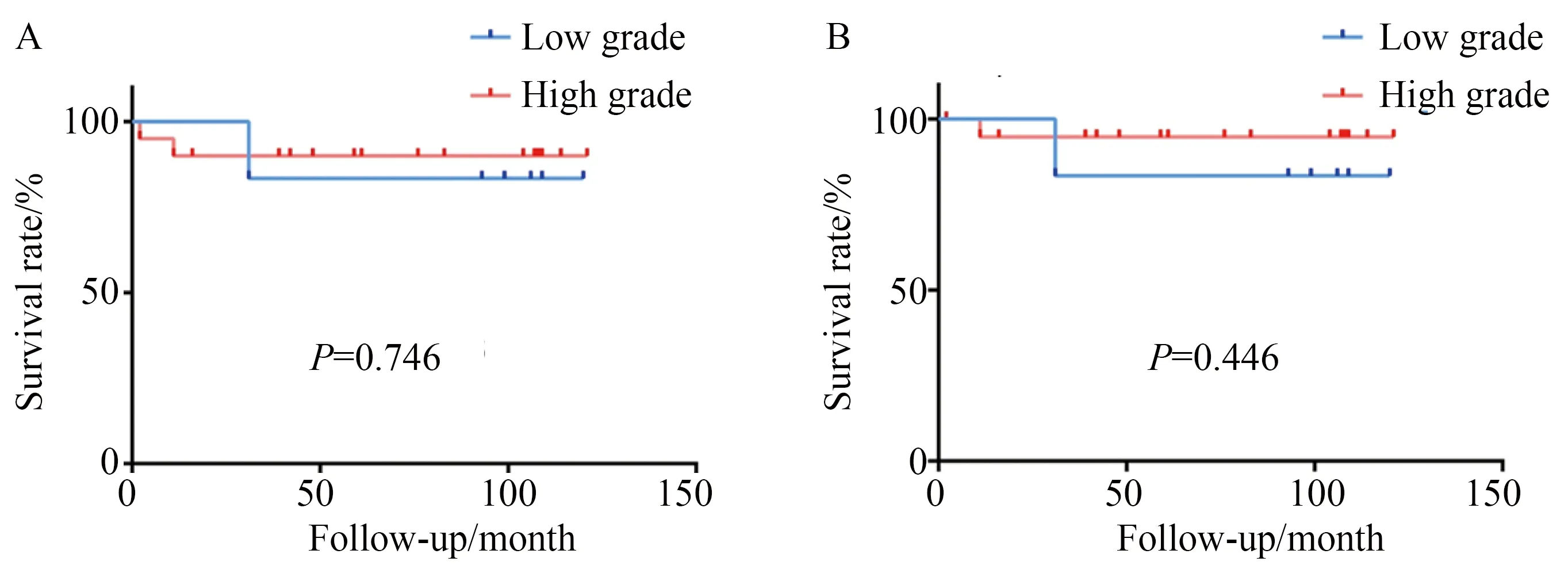
圖3 動脈灌注化療中高級別和低級別腫瘤之間的總生存率和腫瘤特異性生存率比較Fig.3 Comparison of overall survival and cancer-specific survival between high-grade and low-grade tumor
A:overall survival in intra-arterial chemotherapy group;B:cancer-specific survival in intra-arterial chemotherapy group.
盡管先后有MVAC方案(甲氨蝶呤+長春堿+阿霉素+順鉑),GC方案(吉西他濱+順鉑)和劑量密集的MVAC方案(dose-dense MVAC)確定為術后的一線輔助化療,但是中位的總生存時間也僅為12~15個月,其中約10%~20%的患者能達到長期存活,主要為 ECOG評分較好(0~1)和沒有內臟轉移的患者[12-16]。
動脈灌注化療的特點是可以顯著提高膀胱及其周圍盆腔區域的藥物濃度。Collins[17]使用同等劑量的順鉑對比靜脈化療和動脈化療的局部藥物濃度,發現后者在瘤體內的藥物濃度是前者的1.4至5.0倍。Mitsuzane等[18]報道如果動脈灌注化療的同時用導管球囊堵塞腫瘤供應血管,則腫瘤部位的藥物濃度將超過6倍。高濃度的順鉑除了直接誘導腫瘤細胞死亡,有研究[19]指出動脈灌注化療造成的局部區域嚴重缺氧可顯著提高順鉑的抗癌效果。本研究中,有17例(65.4%)患者最終病理分期較臨床分期下降,對手術前后的病理分期結果進行比較,其差異具有統計學意義(P=0.002),動脈灌注化療的局部降期效果顯著,但沒有pT0病例。Maatman等[20]對25例患者進行平均2次的術前動脈灌注化療,有6例完全緩解,其中16例根治患者中有3例術后病理為T0N0M0。本研究中沒有pT0可能是因為僅單次動脈灌注化療,是否根據化療治療效果增加根治術前灌注次數,還需要大樣本隨機臨床試驗進一步驗證。
術前新輔助化療并不會影響手術的可行性和安全性。Grossman等[4]研究顯示術前MVAC方案不會影響患者的手術機會,而且相對于沒有新輔助化療的患者,手術合并癥的發生率也沒有明顯增加。同樣,動脈灌注化療后的毒性反應對圍術期恢復以及術后長期合并癥方面的影響也并不明顯。牛亦農等[21]對19例局部晚期膀胱癌患者進行術前動脈灌注新輔助GC方案化療,結果顯示患者耐受性好,未對化療后手術治療造成不良影響。本研究中術后合并癥共28人次,其中術后30 d內的早期合并癥發生率最高(24人次,92.3%),這明顯高于文獻報道的30%~67%[22]。仔細分析上述數據可見2級合并癥占80.8%(21/26),這其中14例(53.8%)因為給予術后腸外營養而定義為2級合并癥,事實上很大一部分患者并不需要術后腸外營養,既往傳統模式的術后康復正在逐漸被改變。同時,將以上合并癥依據術后病理低級別和高級別腫瘤進行分類,兩者之間差異無統計學意義(P=0.081),術后30 d之后的4人次合并癥均為高級別膀胱癌。術后30 d內、30~90 d內以及超過90 d Clavien 3級以上合并癥分別為3例(11.5%),1例(3.8%)和2例(7.6%),并沒有明顯增加術后合并癥發生率,動脈灌注化療對手術的安全性沒有顯著影響。
盡管本研究平均隨訪時間超過7年,但作為回顧性研究的病例數較少,術后隨訪過程中無法準確提供腫瘤復發方面的數據,僅能以總生存率和腫瘤特異性生存率作為預后指標,這一結果并不能提供令人信服的數據;此外,本研究根據患者肌酐清除率情況調整藥物劑量,早期多采用100%劑量,后期的患者多采用70%的劑量,這主要考慮到術前化療不良反應可能會延遲手術實施時間,非統一的化療劑量對預后的影響可能干擾對預后的判斷。盡管如此,本研究得出LRC術前進行單側動脈灌注化療并沒有明顯增加圍術期合并癥,同時起到顯著地降期降級作用,但在腫瘤學預后方面還需要隨機對照研究進行評估,同時輔助膀胱癌根治術的多模式治療方案仍需進一步探索。
[1] Kamat A M, Hahn N M, Efstathiou J A, et al. Bladder cancer[J]. Lancet,2016,388:2796-2810.
[2] Marcos-Gragera R, Mallone S, Kiemeney L A, et al. Urinary tract cancer survival in europe 1999-2007: results of the population-based study EUROCARE-5[J]. Eur J Cancer, 2015, 51(15): 2217-2230.
[3] Zehnder P, Studer U E, Skinner E C, et al. Unaltered oncological outcomes of radical cystectomy with extended lymphadenectomy over three decades[J]. BJU Int, 2013,112(2):E51-58.
[4] Grossman H B, Natale R B, Tangen C M, et al. Neoadjuvant chemotherapy plus cystectomy compared with cystectomy alone for locally advanced bladder cancer[J]. N Engl J Med, 2003,349(9):859-866.
[5] International Collaboration of Trialists, Medical research council advanced bladder cancer working party (now the National Cancer Research Institute Bladder Cancer Studies group), European Organisation for Research and Treatment of Cancer Genito-Urinary Tract Cancer Group, et al. International phase Ⅲ trial assessing neoadjuvant cisplatin, methotrexate, and vinblastine chemotherapy for muscle-invasive bladder cancer: long-term results of the BA06 30894 trial[J]. J Clin Oncol, 2011,29(16):2171-2177.
[6] Advanced Bladder Cancer Meta-analysis Collaboration.Neoadjuvant chemotherapy in invasive bladder cancer: update of a systematic review and Meta-analysis of individual patient data advanced bladder cancer (ABC) Meta-analysis collaboration[J]. Eur Urol, 2005,48(2):202-205; discussion 5-6.
[7] Reardon Z D, Patel S G, Zaid H B, et al. Trends in the use of perioperative chemotherapy for localized and locally advanced muscle-invasive bladder cancer: a sign of changing tides[J]. Eur Urol, 2015,67(1):165-170.
[8] Shah J B, McConkey D J, Dinney C P. New strategies in muscle-invasive bladder cancer: on the road to personalized medicine[J]. Clin Cancer Res, 2011,17(9):2608-2612.
[9] Koppie T M, Serio A M, Vickers A J, et al. Age-adjusted Charlson comorbidity score is associated with treatment decisions and clinical outcomes for patients undergoing radical cystectomy for bladder cancer[J]. Cancer, 2008,112(11):2384-2392.
[10] Nogueira L, Katz D, Pinochet R, et al. Critical evaluation of perioperative complications in laparoscopic partial nephrectomy[J]. Urology, 2010,75(2):288-294.
[11] Torre L A, Bray F, Siegel R L, et al. Global cancer statistics, 2012[J]. CA Cancer J Clin, 2015,65(2):87-108.
[12] Saxman S B, Propert K J, Einhorn L H, et al.Long-term follow-up of a phase Ⅲ intergroup study of cisplatin alone or in combination with methotrexate, vinblastine, and doxorubicin in patients with metastatic urothelial carcinoma: a cooperative group study[J]. J Clin Oncol, 1997,15(7):2564-2569.
[13] von der Maase H, Sengelov L, Roberts J T, et al.Long-term survival results of a randomized trial comparing gemcitabine plus cisplatin, with methotrexate, vinblastine, doxorubicin, plus cisplatin in patients with bladder cancer[J]. J Clin Oncol, 2005,23(21):4602-4608.
[14] Sternberg C N, de Mulder P, Schornagel J H, et al. Seven year update of an EORTC phase Ⅲ trial of high-dose intensity M-VAC chemotherapy and G-CSF versus classic M-VAC in advanced urothelial tract tumours[J]. Eur J Cancer, 2006,42(1):50-54.
[15] Bajorin D F, Dodd P M, Mazumdar M, et al.Long-term survival in metastatic transitional-cell carcinoma and prognostic factors predicting outcome of therapy[J]. J Clin Oncol, 1999,17(10):3173-3181.
[16] Apolo A B, Ostrovnaya I, Halabi S, et al. Prognostic model for predicting survival of patients with metastatic urothelial cancer treated with cisplatin-based chemotherapy[J]. J Natl Cancer Inst, 2013,105(7):499-503.
[17] Collins J M. Cancer chemotherapy, challenges for the future[J]. Excepta Medica, 1989,4:3-10.
[18] Mitsuzane K, Terada M, Nomura S, et al. Balloon-occluded arterial infusion as chemotherapy in bladder cancer-long-term results. Gan To Kagaku Ryoho, 1990,17(8Pt2):1701-1704.
[19] Abbott D W, Freeman M L, Holt J T. Double-strand break repair deficiency and radiation sensitivity in BRCA2 mutant cancer cells[J]. J Natl Cancer Inst, 1998,90(13):978-985.
[20] Maatman T J, Montie J E, Bukowski R M, et al.Intra-arterial chemotherapy as an adjuvant to surgery in transitional cell carcinoma of the bladder[J]. J Urol, 1986,135(2):256-260.
[21] 牛亦農,閆勇,張軍暉,等. 局部晚期膀胱癌術前動脈灌注新輔助化療的安全性與療效分析[J]. 中華泌尿外科雜志, 2009,30(10):681-684.
[22] Shabsigh A, Korets R, Vora K C, et al. Defining early morbidity of radical cystectomy for patients with bladder cancer using a standardized reporting methodology[J]. Eur Urol, 2009,55(1):164-174.

