荔枝汁中谷蛋白結構及特性
袁星星,余元善,吳繼軍,肖更生,徐玉娟,*,鄒 波
(1.廣東省農業科學院蠶業與農產品加工研究所,農業部功能食品重點實驗室,廣東省農產品加工重點實驗室,廣東 廣州 510610;2.江西農業大學食品科學與工程學院,江西 南昌 330045)
荔枝(Litchi chinensis),屬無患子科荔枝屬植物,原產于中國南部,一直以來,中國都是世界上最大的荔枝生產地,由于荔枝適宜生長在熱帶及亞熱帶地區,因此荔枝主要種植于我國廣東、廣西、福建、臺灣等地,其中廣東是中國荔枝分布最多的省,據2016年廣東統計年鑒[1],近6年來廣東荔枝產量均處于上升趨勢,僅2015年總產量高達128.05萬 t。
大量研究表明,荔枝果實中富含糖分、有機酸、膳食纖維、維生素、蛋白質、氨基酸和礦物質等營養物質,并含有豐富的多酚和花色苷等生物活性物質[2]。由于荔枝成熟期集中且不耐貯藏,故荔枝主要以鮮食為主,據統計,每年有20%以上的荔枝因腐爛變質造成損失[3],因此荔枝深加工在荔枝產業中越來越受重視。近年來,國內外關于荔枝的研究主要集中在荔枝活性成分分離鑒定[4]、荔枝褐變[5-7]、荔枝風味[3,8-9]等方面,而對荔枝汁體系不穩定現象尚未進行深入探討。陳奇[10]、劉爽[11]、陳雪[12]等研究表明酸性蛋白飲料有凝聚沉淀的傾向,原因可能是該酸性蛋白飲料的pH值接近蛋白等電點,導致蛋白沉淀,致使飲料不穩定現象發生。本實驗室前期對荔枝汁果肉沉淀物的營養成分進行分析,發現荔枝汁果肉沉淀物中蛋白質含量非常高,約占干質量的23%。利用Osborne分級法對荔枝蛋白的清蛋白、球蛋白、醇溶蛋白、谷蛋白的含量組成進行分析,發現谷蛋白所占比例最高,超過72%,因此荔枝蛋白主要為谷蛋白,而谷蛋白水溶性較差,一般溶于稀堿溶液,可初步推斷谷蛋白是導致荔枝汁不穩定的重要因素之一[13]。目前,國內外關于谷蛋白的研究主要集中在小麥[14-16]、米糠[17-18]等農作物中,分別研究了小麥谷蛋白結構對面團特性的影響,米糠谷蛋白結構及其功能特性。劉麗等[16]指出,高分子麥谷蛋白亞基與低分子麥谷蛋白亞基通過分子間二硫鍵形成麥谷蛋白聚合體,影響面團流變學特性。關于荔枝谷蛋白結構及其功能特性的研究鮮見報道。
本研究擬以荔枝谷蛋白為研究對象,對其進行十二烷基硫酸鈉-聚丙烯酰胺凝膠電泳(sodium dodecyl sulfate-polyacrylamide gel electrophoresis,SDS-PAGE)分析、熱穩定性和紅外光譜分析,并測定其表面疏水性、巰基和二硫鍵含量,旨在對荔枝谷蛋白的結構及特性作探討,為荔枝飲料穩定性的進一步研究提供參考,同時也促進了荔枝果渣中蛋白質的開發利用。
1 材料與方法
1.1 材料與試劑
供試荔枝汁為熱巴氏殺菌荔枝汁(淮枝),由果香園食品有限公司提供。
SDS-PAGE凝膠快速配制試劑盒 碧云天生物技術研究所;三羥甲基氨基甲烷(Tris) 美國MYM生物科技有限公司;甘氨酸(glycine,Gly)、SDS、5,5’-二硫代雙(2-硝基苯甲酸)(5,5’-dithiobis-(2-nitrobenzoic acid),DTNB)、三氯乙酸(trichloroacetic acid,TCA)上海阿拉丁生化科技股份有限公司;其他試劑均為國產分析純。
1.2 儀器與設備
CR22GIII高速冷凍離心機 日本日立公司;Mini-PROTEAN Tetra Cell電泳儀、Universal HoodII凝膠成像儀 美國Bio-Rad公司;PB-10型pH計 德國Sartorius公司;UV-1800型紫外-可見分光光度計 日本島津公司;DHG-9240型電熱恒溫鼓風干燥箱 上海齊欣科學有限公司;Kjeltec TM8400自動凱氏定氮儀瑞典福斯儀器公司;DSC200F3差示掃描量熱儀 德國耐馳公司;Magna 760紅外光譜儀 美國Nicolet公司。
1.3 方法
1.3.1 荔枝汁谷蛋白的制備
參考Horax等[19]提取荔枝汁沉淀物中不同類型蛋白質(按溶解特性分)的方法,略作改動。稱取10 g荔枝汁沉淀,分別以1∶10(g/mL)加入蒸餾水、1 mol/L的NaCl溶液、體積分數70%的乙醇溶液和0.1 mol/L的NaOH溶液提取荔枝汁清蛋白、球蛋白、醇溶蛋白和谷蛋白,4 ℃、10 000 r/min離心25 min,收集谷蛋白上清液,用1 mol/L的HCl溶液調pH值至等電點,4 ℃、10 000 r/min離心25 min,沉淀再以1∶10(g/mL)加蒸餾水洗滌3 次,收集沉淀,沉淀冷凍干燥后即為荔枝汁谷蛋白樣品,用于指標分析。所制得的樣品經凱氏定氮法測定蛋白質含量,按換算系數為6.25計算,其蛋白質含量為(74.89±0.56)%。
1.3.2 荔枝汁谷蛋白等電點的測定
準確稱取等量的荔枝汁谷蛋白溶液,用0.02 mol/L的HCl溶液分別調至不同的pH值(1.0、2.0、3.0、3.5、4.0、4.5、5.0、5.5、6.0、7.0),4 ℃、10 000 r/min離心25 min,傾去上清液,將離心管倒扣5 min,稱量離心管沉淀物質量。離心沉淀率計算公式如下[13]:

式中:SR為離心沉淀率;m2為離心后沉淀物的質量/g;m1為離心前溶液的質量/g。
1.3.3 SDS-PAGE分析
1.3.3.1 樣品處理
稱取1 g荔枝樣品,以1∶10加入蒸餾水洗3 次,加0.25 g交聯聚乙烯吡咯烷酮,再加5 mL蛋白質裂解液(7 mol/L尿素、2 mol/L硫脲),還原電泳中蛋白質裂解液含有40 mmol/L二硫蘇糖醇(DL-dithiothreitol,DTT),用1 mol/L的HCl和NaOH溶液調pH值至6.8,4 ℃、12 000 r/min離心25 min,上清液用于SDS-PAGE分析。
1.3.3.2 SDS-PAGE實驗步驟
參考黎衛等[20]的方法,略作改動。蛋白樣品加入上樣緩沖液后,沸水浴5 min,冷卻后上樣5 μL,采用5 g/100 mL濃縮膠和10 g/100 mL分離膠進行垂直電泳,預電泳和濃縮膠電壓為80 V,分離膠電壓為100 V,待溴酚藍條帶移動到距離分離膠下邊緣1 cm左右時關閉電源,結束電泳,染色及脫色步驟均參照SDS-PAGE快速配制試劑盒說明書,脫色后拍照保存。
1.3.4 表面疏水性的測定
1.3.4.1 標準曲線的繪制
參考王洪偉等[21]的方法,略作改動。取已知濃度的SDS溶液(0、0.02、0.04、0.06、0.08、0.1 mmol/L)1 mL,加入20 mL氯仿,混合均勻后加入5 mL亞甲基藍溶液(0.24 g/L),充分混合均勻,2 500 r/min離心15 min,取底層SDS與亞甲基藍的混合物,于655 nm波長處測定吸光度。其蛋白質的表面疏水性用1 mg蛋白質結合SDS含量(μg/mg)表示。吸光度(y)與SDS濃度(x)的回歸方程為y=4.74x+0.006 8(R2=0.999 2)。
1.3.4.2 表面疏水性的測定
參考王洪偉等[21]的方法,略作改動。準確稱取10 mg蛋白質樣品溶解于40 mL SDS溶液(0.1 mmol/L),充分攪拌4 h,5 000 r/min離心10 min,上清液在蒸餾水中透析36 h后,取1 mL透析液與20 mL氯仿混合均勻,然后在氯仿層中加入5 mL 0.24 g/L亞甲基藍溶液,充分混合均勻,2 500 r/min離心15 min,取底層SDS與亞甲基藍的混合物,于655 nm波長處測定吸光度。蛋白質表面疏水性的計算公式如下:

1.3.5 巰基和二硫鍵含量的測定
分別稱取0.05 g蛋白質樣品于4 mL Tris-Gly 8 mol/L尿素溶液(pH 8.0),充分攪拌1 h,10 000 r/min離心10 min,取上清液作為蛋白液樣品,采用考馬斯亮藍法測定上清液的蛋白質含量。
1.3.5.1 游離巰基含量的測定
參考Hakimia等[22]的方法,略作改動。準確量取1.0 mL蛋白液樣品,加入5.0 mL Tris-Gly 8 mol/L尿素溶液(pH 8.0)和0.04 mL DTNB溶液(4 mg/mL),迅速混合后于25 ℃保溫反應25 min,然后在412 nm波長處測定吸光度。游離巰基含量按下式計算:
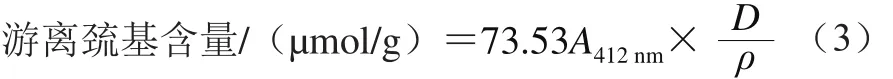
式中:73.53為106/(1.36×104),1.36×104為Ellman試劑的摩爾消光系數/(L/(mol·cm));A412nm為波長412 nm處所測得的吸光度;ρ為蛋白質樣品的質量濃度/(mg/mL);D為稀釋因子,對游離巰基測定中的D值取6.04。
1.3.5.2 總巰基含量的測定
準確量取0.6 m L的蛋白液樣品,然后加入3.0 mL Tris-Gly 8 mol/L尿素溶液(含40 mmol/L DTT,pH 8.0),混合均勻后于25 ℃保溫反應1 h,再加入6 mL 12% TCA,混合均勻后繼續保溫反應1 h,5 000 r/min離心10 min,沉淀物繼續用12% TCA溶液洗滌,重復4 次,沉淀加入9.0 mL Tris-Gly 8 mol/L尿素溶液(pH 8.0),然后加入0.09 mL DTNB溶液(4 mg/mL),混勻后于25 ℃保溫反應25 min,然后在412 nm波長處測定吸光度。總巰基含量按下式計算:

式中:D為稀釋因子,對總巰基含量測定中的D值取16.15。
1.3.5.3 二硫鍵含量的計算
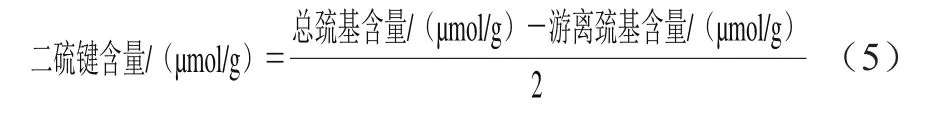
1.3.6 熱穩定性的測定
精確稱取蛋白質樣品(5 mg左右)并記錄質量,將蛋白質均勻地鋪在鋁制坩堝中壓片,然后置于差示掃描量熱儀中進行升溫掃描。以空鋁盒為空白對照,掃描溫度范圍為25~150 ℃,升溫速率為10 ℃/min,氮氣流速為20.0 mL/min。
1.3.7 紅外光譜分析
稱取一定量的蛋白質樣品與溴化鉀混合(質量比1∶100),用研缽研磨成均勻粉末,壓制成薄片,然后于紅外光譜儀中作全波長(400~4 000 cm-1)掃描。利用PeakFit v4.12軟件對酰胺I帶區域(1 600~1 700 cm-1)圖譜進行分析。先基線校正,然后用Gaussian去卷積,再由二階導數擬合,確定各個子峰與各二級結構的對應關系,然后根據各子峰所占面積計算出各部分二級結構所占的比例。
1.4 數據分析
采用SPSS 17.0和Origin 8.5軟件進行相關性和線性回歸分析。
2 結果與分析
2.1 荔枝沉淀谷蛋白等電點
蛋白質由氨基酸組成,其分子表面帶有很多可解離基團,如谷氨酸、天冬氨酸殘基中的γ值和β-羧基,賴氨酸殘基中的ε-氨基,精氨酸殘基中的胍基和組氨酸的咪唑基,此外,在肽鏈兩端還有游離的α-氨基和α-羧基,因此,蛋白質是兩性電解質[23]。當蛋白質處于等電點時,其游離的正、負離子相等,凈電荷為零,此時蛋白質沉淀率最大。由圖1可知,在pH值為3.5處,谷蛋白沉淀率達到最大值14%,根據蛋白質在等電點處溶解度最低原理,因此荔枝谷蛋白等電點pI值為3.5左右。張敏等[18]和王艷玲[24]按照Osbron法提取米糠中4 種蛋白質,采用福林-酚法測定4 種蛋白質的等電點,其中谷蛋白的等電點為4.6;郭榮榮等[25]根據蛋白質在等電點時電導率最低的原理分別測定各蛋白液的等電點,其中谷蛋白的等電點也為4.6左右;李小華等[26]采用雙縮脲法測定山毛豆種子4 種蛋白質的等電點,發現谷蛋白等電點為3.5~3.8。在pH 4.0左右,荔枝谷蛋白沉淀率較高,當pH值大于5.0時沉淀率顯著降低,因此谷蛋白溶于稀堿溶液。酸性荔枝飲料pH值在4.0左右,因此這也是酸性荔枝飲料穩定性差的重要原因之一。
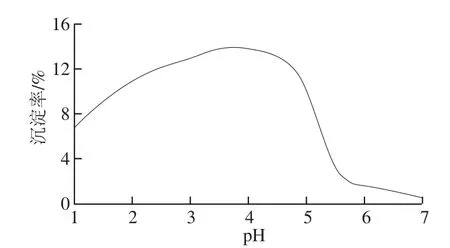
圖1 pH值對荔枝汁谷蛋白沉淀的影響Fig.1 Effect of pH values on glutelin precipitation in litchi juice
2.2 荔枝谷蛋白SDS-PAGE分析
對荔枝谷蛋白組分進行SDS-PAGE分析,判斷荔枝谷蛋白組分分子質量大小。以Marker中各蛋白遷移率(即比移值,樣品點中心處與點樣處的距離除以展開劑前沿與點樣處的垂直距離)為橫坐標,以相應分子質量對數為縱坐標進行作圖,得到標準曲線,其回歸方程為y=-1.039 6x+5.189 4,R2=0.984 8。
由圖2可知,非還原態條帶明顯比還原態條帶少,且非還原態中,117 kDa以上的條帶有3 條,而還原態只有1 條,非還原態中,分子質量較小的亞基條帶明顯比還原態少,但不管是非還原態還是還原態,谷蛋白亞基分子質量大部分處于30~90 kDa,主要集中在50 kDa左右。非還原狀態下,荔枝谷蛋白約有10 個條帶,還原態下約有12 個條帶,說明荔枝谷蛋白組分復雜且含有二硫鍵,經DTT還原后,某些大分子條帶消失,出現新的小分子條帶。通過對比荔枝谷蛋白還原態和非還原態,可知其亞基分子質量大部分都大于50 kDa,說明荔枝谷蛋白分子較大,更易于沉淀,可能是導致荔枝汁體系不穩定的原因之一。Wang Zengxuan等[27]研究指出,米糠谷蛋白分子是由多肽鏈彼此通過二硫鍵及疏水作用連接而成,形成大分子蛋白質聚合體,導致其溶解性較低,限制了米糠谷蛋白在液態食品及飲料中的應用。
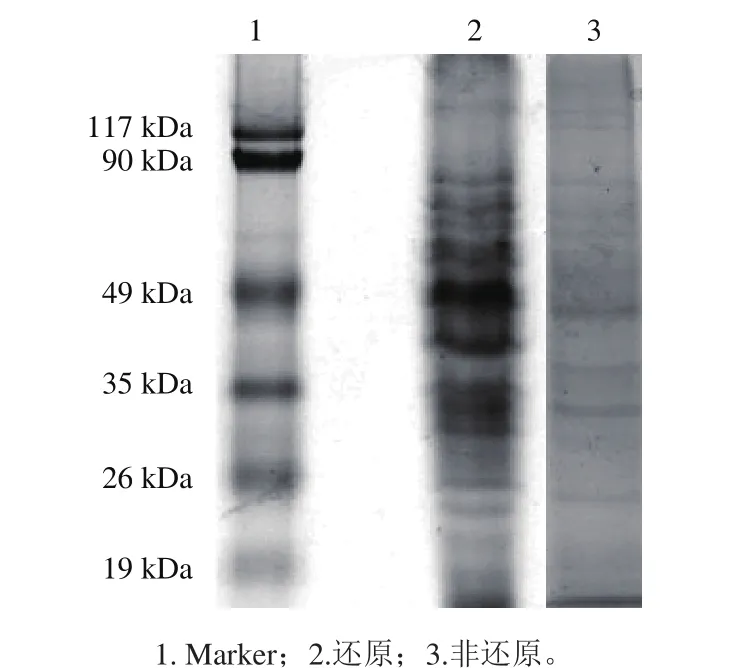
圖2 荔枝汁谷蛋白的SDS-PAGE圖Fig.2 SDS-PAGE prof i le of glutelin in litchi juice
2.3 谷蛋白的表面疏水性
SDS是一種蛋白質變性劑,然而在極低濃度下,SDS還不足以使蛋白質發生變性,但其能與蛋白質疏水鍵相互作用結合到蛋白質分子上,形成蛋白質-SDS復合物,經透析后用氯仿將未結合的SDS提取出來并與亞甲基藍結合,通過測定SDS-亞甲基藍吸光度的不同反映蛋白質表面疏水性基團的多少。本研究運用SDS法測定荔枝谷蛋白表面疏水性,根據所得的標準曲線,計算得知荔枝谷蛋白表面疏水性為(74.25±5.26)μg/mg(1 mg的荔枝谷蛋白樣品結合74.25 μg SDS)。對比耿瑋蔚等[28]運用同樣的方法測定大豆分離蛋白表面疏水性可知,荔枝谷蛋白表面疏水性與經2 g/100 mL SDS溶液處理后的表面疏水性相當,因為隨著SDS質量濃度提高,大豆分離蛋白表面疏水性也有不同程度的提高,因此可推斷荔枝谷蛋白表面疏水性大于大豆分離蛋白表面疏水性。王中江等[29]研究表明大豆分離蛋白的表面疏水性在等電點附近出現最大值,其表面疏水性與溶解度呈現負相關。荔枝汁pH值約為4.5,處于荔枝谷蛋白等電點附近,因此荔枝汁出現不穩定現象。
2.4 谷蛋白的巰基和二硫鍵分析
蛋白質是由氨基酸聚合而成的生物大分子物質,二硫鍵等基團間的相互作用為蛋白質產生維持高級結構和功能提供基礎,其中半胱氨酸殘基中的巰基是所有蛋白質氨基酸殘基中最活潑的基團,在體內參與抗氧化、亞硝基化和巰基-二硫鍵交換等多種重要生理反應[30]。二硫鍵由半胱氨酸殘基的兩個硫醇基氧化而成,在蛋白質三級結構的穩定性方面扮演著重要角色[31]。本研究采用Ellman’s試劑比色法測定荔枝谷蛋白的巰基和二硫鍵,其中游離巰基含量為(29.83±1.72)μmol/g,總巰基含量為(40.59±2.04)μmol/g,二硫鍵含量為(5.38±0.18)μmol/g。可見荔枝汁谷蛋白主要含有游離巰基,其二硫鍵含量較少,結合圖2,對比還原前和還原后的荔枝谷蛋白分子質量,可知經DTT還原后,只有小部分大分子質量的條帶消失,說明經DTT還原的二硫鍵較少,與該結果相符。由于在不同環境下,二硫鍵和游離巰基會發生相互轉化,如半胱氨酸在堿性溶液中易被氧化形成二硫鍵,生成胱氨酸[30],因此氨基酸組成及排列在蛋白質結構及功能中也扮演著重要角色。
2.5 谷蛋白的熱穩定性分析
差示掃描量熱法是一種熱分析法,在程序控制溫度下,測量輸入到試樣和參比物的功率差(如以熱的形式)與溫度的關系。本研究采用差示掃描量熱分析荔枝谷蛋白熱穩定性,由圖3可知,荔枝谷蛋白的變性溫度為105.24℃,均比王洪偉等[21]研究的麥谷蛋白(66.81 ℃)和青稞谷蛋白(71.28 ℃)以及Adebiyi等[32]研究的米糠谷蛋白(75.4±0.2)℃變性溫度高。對于蛋白質,熱處理(差示掃描量熱檢測)是一個變性或蛋白質展開的過程[19],變性溫度越大,熱穩定性越好,說明荔枝谷蛋白的熱穩定性比麥谷蛋白、青稞谷蛋白、米糠谷蛋白好,荔枝汁飲料在熱殺菌過程中可以保持較好的穩定性。黎衛等[33]研究不同pH值(5.0、7.0、9.0)對芡實谷蛋白熱變性的影響,發現蛋白質在pH 5.0時谷蛋白變性溫度最高,原因可能是谷蛋白等電點在pH 5.0附近,蛋白質所帶凈電荷少,凈靜電排斥能量小于其他穩定谷蛋白質的相互作用的能量,谷蛋白較穩定,從而其變性溫度較高[34]。本研究的谷蛋白樣品也是在等電點處制備,有可能導致其變性溫度較高。
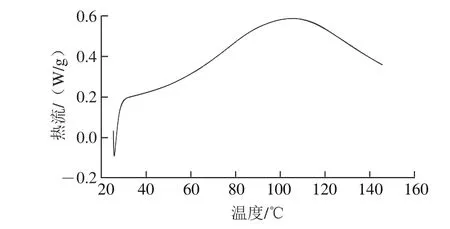
圖3 荔枝汁谷蛋白的差示掃描量熱曲線Fig.3 DSC curve of glutelin in litchi juice
2.6 谷蛋白的紅外光譜分析
蛋白質在中紅外區(4 000~400 cm-1)有若干特征吸收峰,其中酰胺I帶(1 700~1 600 cm-1)對于蛋白質二級結構最有研究價值[35]。酰胺I帶一般能反映蛋白質的二級結構,其主要與C=O的伸縮振動有關,當蛋白質的氨基酸殘基間形成的氫鍵較強時,C=O的電子云密度較低,僅需提供較少的能量就可以使其振動,C=O的吸收峰向低波數方向移動,接近1 600 cm-1,基于此原理,運用紅外光譜分析蛋白質二級結構,其對應關系如下:β-折疊(1 610~1 640 cm-1)、無規則卷曲(1 640~1 650 cm-1)、α-螺旋(1 650~1 660 cm-1)和β-轉角(1 660~1 700 cm-1)[21]。
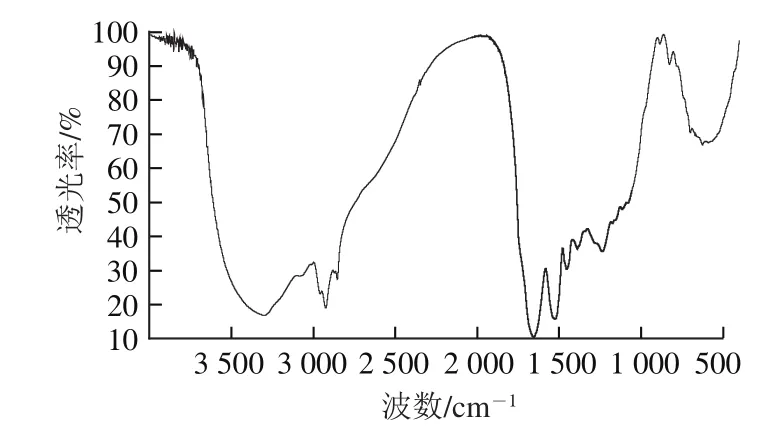
圖4 荔枝汁谷蛋白的紅外光譜圖Fig.4 IR spectrum of glutelin in litchi juice
由圖4可知,樣品酰胺I帶有很強的吸收峰,說明樣品蛋白質含量非常高。運用PeakFit v4.12軟件對紅外光譜圖酰胺I帶進行分析,得知荔枝谷蛋白的二級結構主要由β-折疊和β-轉角為主,其中β-折疊占33.92%,β-轉角占64.7%,少數為無規則卷曲結構。β-折疊是一種具有特定幾何形狀的伸展結構,主要與局部的協同性氫鍵形成有關,它也是一種重復性的結構而且在β-折疊中肽主鏈都處于最伸展的構象,其通常較α-螺旋結構更為穩定,一般β-折疊含量高的蛋白質具有較高的變性溫度。β-轉角則不同,它是一種非重復性結構,主要與多肽鏈的彎曲、回折和重新定向有關,β-轉角大多處在蛋白質分子的表面,因為在這里改變多肽鏈方向的阻力比較小,β-轉角的存在更有利于蛋白質生成結實、球狀的結構[36]。目前,由于對蛋白質二級結構與其宏觀功能性質關系的研究尚存不足,并且蛋白質的二級結構本身就很復雜,加上測定時較多的影響因素及酰胺I帶各子峰的準確歸屬上存有的一些爭議[37],因此僅靠紅外光譜完全解釋二級結構與宏觀功能性的關系仍有很大難度。
3 結 論
本課題組采用Osborne分級法提取荔枝蛋白并用凱氏定氮法進行定量分析,發現谷蛋白所占比例最高,超過72%。本實驗進一步研究荔枝谷蛋白的結構及特性,發現荔枝谷蛋白分子質量較大,主要集中在50 kDa左右,非還原狀態下主要有10 個條帶,成分復雜,經還原后,少量大分子條帶消失,小分子條帶增加;谷蛋白等電點pI值為3.5左右;用蛋白樣品結合SDS的能力表征蛋白質的表面疏水特性,得出1 mg的荔枝谷蛋白樣品結合(74.25±5.26)μg SDS;游離巰基含量為(29.83±1.72)μmol/g,總巰基含量為(40.59±2.04)μmol/g,二硫鍵含量為(5.38±0.18)μmol/g;變性溫度為105.24 ℃。荔枝汁體系偏酸,谷蛋白分子質量較大,且谷蛋白在pH 3~5時溶解性較差,故在制作酸性荔枝飲料時體系不穩定。研究表明,荔枝谷蛋白表面疏水性較大,二硫鍵較少,而其變性溫度高達105.24 ℃,比其他植物蛋白變性溫度(通常低于100 ℃)高[19],Kudre等[38]認為熱穩定性取決于蛋白質結構及相關結合力,且一般β-折疊含量高的蛋白質具有較高的變性溫度。本研究采用紅外光譜對荔枝汁谷蛋白二級結構進行分析,得出β-折疊和β-轉角為其主要結構,分別占33.92%和64.7%,可知荔枝谷蛋白β-折疊結構所占比例較低,但谷蛋白變性溫度高達105.24 ℃,說明僅僅通過紅外光譜解釋蛋白質二級結構與其宏觀功能性的關系仍有較大難度。
[1] 廣東統計年鑒2016[EB/OL]. 北京∶ 中國統計出版社. http∶//www.gdstats.gov.cn/tjnj/2016/directory.html.
[2] 鄭欣. 荔枝汁乳酸菌發酵飲料的工藝研究[D]. 南昌∶ 江西農業大學,2014.
[3] ALVES J A, DE OLIVEIRA L L C, DIAS D R, et al. Effects of spontaneous and inoculated fermentation on the volatile profile of lychee (Litchi chinensis Sonn) fermented beverages[J]. International Journal of Food Science & Technology, 2010, 45(11)∶ 2358-2365.DOI∶10.1111/j.1365-2621.2010.02409.x/full.
[4] REN S, XU D D, GAO Y, et al. Flavonoids from litchi (Litchi chinensis Sonn.) seeds and their inhibitory activities on α-glucosidase[J].Chemical Research in Chinese Universities, 2013, 29(4)∶ 682-685.DOI∶10.1007/s40242-013-3030-x.
[5] BHUSHAN B, PAL A, NARWAL R, et al. Combinatorial approaches for controlling pericarp browning in litchi (Litchi chinensis) fruit[J].Journal of Food Science and Technology, 2015, 52(9)∶ 5418-5426.DOI∶10.1007/s13197-015-1712-8.
[6] REICHEL M, WELLH?FER J, TRIANI R, et al. Postharvest control of litchi (Litchi chinensis Sonn.) pericarp browning by cold storage at high relative humidity after enzyme-inhibiting treatments[J].Postharvest Biology and Technology, 2017, 125∶ 77-90. DOI∶10.1016/j.postharvbio.2016.10.002.
[7] 萬鵬. 荔枝果汁非酶褐變機理研究[D]. 武漢∶ 華中農業大學, 2010.DOI∶10.7666/d.Y1805186.
[8] 郝菊芳. 荔枝汁加工中營養和典型香氣成分的變化研究[D]. 武漢∶華中農業大學, 2008. DOI∶10.7666/d.Y1394693.
[9] 移蘭麗, 余元善, 肖更生, 等. 荔枝果汁飲料和荔枝原汁揮發性成分分析[J]. 熱帶作物學報, 2016, 37(4)∶ 822-828. DOI∶10.3969/j.issn.1000-2561.2016.04.027.
[10] 陳奇. 防止酸性蛋白飲料沉淀的方法[J]. 食品工業科技, 2001, 22(1)∶47-49. DOI∶10.13386/j.issn1002-0306.2001.01.028.
[11] 劉爽, 袁芳, 高彥祥. 植物蛋白乳液穩定性研究進展[J]. 中國食品添加劑, 2014(8)∶ 165-171. DOI∶10.3969/j.issn.1006-2513.2014.08.020.
[12] 陳雪. 酸性羊奶飲料穩定性的研究[D]. 西安∶ 陜西師范大學, 2013.DOI∶10.3969/jissn.1671-9646(X).2013.07.003.
[13] 龔小潔, 余元善, 徐玉娟, 等. 荔枝汁中果肉沉淀物的營養成分分析及其穩定性研究[J]. 廣東農業科學, 2014(19)∶ 90-93. DOI∶10.3969/j.issn.1004-874X.2014.19.021.
[14] 李學紅, 胡鐘毓, 陸勇, 等. 凍藏時間對麥谷蛋白和麥醇溶蛋白二級結構及面團性能的影響研究[J]. 食品工業科技, 2014, 35(1)∶ 83-86.DOI∶10.13386/j.issn1002-0306.2014.01.059.
[15] 王若蘭, 劉曉林, 趙妍, 等. 儲藏微環境對小麥中蛋白質含量變化規律的影響[J]. 現代食品科技, 2014, 30(6)∶ 47-51. DOI∶10.13982/j.mfst.1673-9078.2014.06.045.
[16] 劉麗, 楊金華, 胡銀星, 等. 麥谷蛋白亞基與小麥品質的關系研究進展[J]. 中國農業科技導報, 2012, 14(1)∶ 33-42. DOI∶10.3969/j.issn.1008-0864.2012.01.05.
[17] CYNTHIA F, YI-HSU J. A review on rice bran protein∶ its properties and extraction methods[J]. Critical Reviews in Food Science and Nutrition, 2011, 51(9)∶ 816-827. DOI∶10.1080/10408398.2010.482678.
[18] 張敏, 周梅, 王長遠. 米糠4 種蛋白質的提取與功能性質[J]. 食品科學, 2013, 34(1)∶ 18-21.
[19] HORAX R, HETTIARACHCHY N, OVER K, et al. Extraction,fractionation and characterization of bitter melon seed proteins[J].Journal of Agricultural and Food Chemistry, 2010, 58(3)∶ 1892-1897.DOI∶10.1021/jf902903s.
[20] 黎衛, 毛健, 陳婷, 等. 芡實谷蛋白提取工藝優化及其亞基組成分析[J]. 食品與機械, 2015, 31(2)∶ 205-210. DOI∶10.13652/j.issn.1003-5788.2015.02.047.
[21] 王洪偉, 武菁菁, 闞建全. 青稞和小麥醇溶蛋白和谷蛋白結構性質的比較研究[J]. 食品科學, 2016, 37(3)∶ 43-48. DOI∶10.7506/spkx1002-6630-201603009.
[22] HAKIMIA S, MORTAZAVIAN E, MOHAMMADI Z, et al.Thiolated methylated dimethylaminobenzyl chitosan∶ a novel chitosan derivative as a potential delivery vehicle[J]. International Journal of Biological Macromolecules, 2017, 95∶ 574-581. DOI∶10.1016/j.ijbiomac.2016.10.094.
[23] 徐軍. 富苯丙氨酸堿性短肽的發現及其對蛋白質等電點和免疫交叉反應的影響[D]. 廣州∶ 華南理工大學, 2010.
[24] 王艷玲. 米糠中四種蛋白質的提取工藝及特性研究[D]. 哈爾濱∶ 東北農業大學, 2013.
[25] 郭榮榮, 章肇敏, 關楊, 等. 甜蕎蛋白質組分的物化特性研究[J].中國糧油學報, 2008, 23(2)∶ 52-55.
[26] 李小華, 于新, 畢陽. 非洲山毛豆種子蛋白質組分分析[J]. 食品工業科技, 2010, 31(3)∶ 158-161.
[27] WANG Z X, LI H, LIANG M C, et al. Glutelin and prolamin,different components of rice protein, exert differently in vitro antioxidant activities[J]. Journal of Cereal Science, 2016, 72∶ 108-116.DOI∶10.1016/j.jcs.2016.10.006.
[28] 耿瑋蔚, 楊光, 謝欣怡, 等. SDS結合法測定蛋白質的疏水性[J]. 食品科學, 2009, 30(24)∶ 416-418. DOI∶10.3321/j.issn∶1002-6630.2009.24.095.
[29] 王中江, 江連洲, 魏冬旭, 等. pH值對大豆分離蛋白構象及表面疏水性的影響[J]. 食品科學, 2012, 33(11)∶ 47-51.
[30] 田悅, 杜軍保. 二硫鍵和巰基在蛋白質結構功能中的作用及分析方法[J]. 實用兒科臨床雜志, 2007, 22(19)∶ 1499-1501. DOI∶10.3969/j.issn.1003-515X.2007.19.030.
[31] HAGIHARA Y, SAERENS D. Engineering disulf i de bonds within an antibody[J]. Biochimica et Biophysica Acta, 2014, 1844∶ 2016-2023.DOI∶10.1016/j.bbapap.2014.07.005.
[32] ADEBIYI A P, ADEBIYI A O, HASEGAWA Y, et al. Isolation and characterization of protein fractions from deoiled rice bran[J].European Food Research and Technology, 2009, 228(3)∶ 391-401.DOI∶10.1007/s00217-008-0945-4.
[33] 黎衛, 毛健, 齊斌. 芡實谷蛋白的結構及熱力學性質研究[J].現代食品科技, 2015, 31(10)∶ 129-133. DOI∶10.13982/j.mfst.1673-9078.2015.10.022.
[34] MENG G T, MA C Y. Thermal properties of Phaseolus angularis(red bean) globulin[J]. Food Chemistry, 2001, 73(4)∶ 453-460.DOI∶10.1016/S0308-8146(00)00329-0.
[35] YE M P, ZHOU R, SHI Y R, et al. Effects of heating on the secondary structure of proteins in milk powders using mid-infrared spectroscopy[J]. Journal of Dairy Science, 2017, 100(1)∶ 89-95.DOI∶10.3168/jds.2016-11443.
[36] 王鏡巖, 朱圣根, 徐長法. 生物化學∶ 上冊[M]. 北京∶ 高等教育出版社, 2002.
[37] 盧雁, 張瑋瑋, 王公軻. FTIR用于變性蛋白質二級結構的研究進展[J]. 光譜學與光譜分析, 2008, 28(1)∶ 88-93. DOI∶10.3964/j.issn.1000-0593.2008.01.021.
[38] KUDRE T G, BENJAKUL S, KISHIMURA H. Comparative study on chemical compositions and properties of protein isolates from mung bean, black bean and bambara groundnut[J]. Journal of the Science of Food and Agriculture, 2013, 93(10)∶ 2429-2436. DOI∶10.1002/jsfa.6052.

