糖脅迫下魯氏接合酵母的代謝指紋分析
韓曉江,徐志嬌,岳田利,牛 晨,魏建平,蔡 瑞*,袁亞宏*
(西北農(nóng)林科技大學(xué)食品科學(xué)與工程學(xué)院,陜西 楊凌 712100)
魯氏接合酵母(Zygosaccharomyces rouxii)是一類能夠在高滲透壓培養(yǎng)條件下(高糖或高鹽環(huán)境中)生長(zhǎng)的酵母菌。魯氏接合酵母在pH值為1.5~7.5的范圍內(nèi)均可以生長(zhǎng),最適生長(zhǎng)的pH值為3.0~4.0。在溫度為15~35 ℃的范圍內(nèi)能夠生長(zhǎng),最適生長(zhǎng)的溫度為25~30 ℃[1]。魯氏接合酵母可以用來(lái)生產(chǎn)發(fā)酵食品,也存在于高糖食品中,在合適條件下能夠引起高糖食品腐敗變質(zhì)。由于高糖環(huán)境對(duì)高滲酵母生長(zhǎng)具有抑制作用,高滲酵母污染高糖食品后生長(zhǎng)比較緩慢,但是貯存溫度的快速變化會(huì)導(dǎo)致高糖食品表面生成冷凝水,從而降低糖濃度,加速高滲酵母在高糖食品表面的生長(zhǎng)[2]。
目前對(duì)魯氏接合酵母的研究主要集中在兩個(gè)方面:一是高滲酵母耐高滲機(jī)理的研究,代謝通路以及基因分子;二是高滲酵母發(fā)酵的應(yīng)用,對(duì)食品的危害以及控制方面等。鄭聃等[3]研究得出釀酒酵母和魯氏接合酵母細(xì)胞內(nèi)積累的海藻糖含量均隨著NaCl濃度的升高而遞增,2 種酵母菌胞內(nèi)甘油含量均隨脅迫鹽濃度的增加而上升,在0.9 mol/L NaCl脅迫下胞內(nèi)甘油含量均達(dá)到最高值,當(dāng)NaCl濃度大于0.9 mol/L時(shí)胞內(nèi)甘油含量均有所下降。Tikam等[4]研究發(fā)現(xiàn)在鹽和糖條件下,魯氏接合酵母產(chǎn)生甘油和阿拉伯糖醇,如果糖用作應(yīng)激劑而不是鹽,則D-阿拉伯糖醇高度產(chǎn)生和積累,而甘油濃度保持不變。Hosono[5]研究發(fā)現(xiàn)在15 g/100 mL NaCl溶液條件下,相對(duì)于基本培養(yǎng)基,細(xì)胞膜脂肪酸C16∶1、C18∶1含量增加,C18∶0、C18∶2含量減少,脂肪酸不飽和度降低,麥角甾醇含量增加了2.9 倍,麥角甾醇對(duì)磷脂比率增加了5 倍。Guo Hong等[6]對(duì)不同糖度條件下魯氏接合酵母細(xì)胞總蛋白進(jìn)行了研究,發(fā)現(xiàn)168 個(gè)蛋白點(diǎn)不同,鑒定出47 個(gè)蛋白點(diǎn),這些蛋白參與糖代謝、能量代謝、氨基酸代謝等。Wei Yonghua等[7]利用基因組改組獲得高度耐鹽的魯氏接合酵母突變株,其在鹽條件下增強(qiáng)ZrGPD1轉(zhuǎn)錄并降低ZrFPS1的轉(zhuǎn)錄,研究發(fā)現(xiàn)魯氏接合酵母在鹽條件下都依賴甘油生產(chǎn)的感應(yīng)和抑制促進(jìn)甘油通過(guò)質(zhì)膜擴(kuò)散。此外,對(duì)魯氏接合酵母的應(yīng)用方面也有所研究,利用魯氏接合酵母發(fā)酵生產(chǎn)中間代謝產(chǎn)物以及釀造醬油等。Taing等[8]研究發(fā)現(xiàn),30%葡萄糖、初始pH 5.0和25 ℃培養(yǎng)溫度時(shí),魯氏接合酵母發(fā)酵產(chǎn)生的蘋(píng)果酸和琥珀酸量最大。吳雅男[9]研究在不同醬油釀造工藝中分別添加魯氏接合酵母S和S3-2并考察其風(fēng)味物質(zhì)變化,實(shí)驗(yàn)結(jié)果表明,添加酵母組檢測(cè)到的風(fēng)味物質(zhì)的種類和含量均多于空白組,說(shuō)明添加魯氏接合酵母對(duì)醬油的釀造其風(fēng)味物質(zhì)有著重要作用。在含糖量較高的果汁中,較低的水分活度能夠抑制腐敗菌和致病菌的生長(zhǎng)[10],但高滲酵母能夠繼續(xù)生長(zhǎng),從而對(duì)果汁的品質(zhì)造成一定的影響。主要包括以下3 個(gè)方面:1)高滲酵母為適應(yīng)高滲環(huán)境,代謝一些相容性物質(zhì),如生成強(qiáng)烈的酒精等令人不愉快氣味,引起果汁渾濁,顏色加深,在果汁表面形成菌膜或在果汁底部形成白色沉淀,破壞果汁的感官風(fēng)味并降低其營(yíng)養(yǎng)價(jià)值[11];2)高滲酵母代謝過(guò)程中產(chǎn)生CO2等氣體,會(huì)引起脹袋脹氣,從而使果汁發(fā)生腐敗,危害消費(fèi)者健康[12];3)高滲酵母生長(zhǎng)過(guò)程中會(huì)代謝掉糖類等固形物質(zhì),使果汁中的固形物含量降低,果汁中溶質(zhì)的溶解性發(fā)生變化,從而使水分活度升高,致使腐敗菌生長(zhǎng),導(dǎo)致產(chǎn)品質(zhì)量不合格,造成企業(yè)損失。
近年來(lái),很多學(xué)者從魯氏接合酵母產(chǎn)生的甘油、海藻糖,細(xì)胞壁、細(xì)胞膜以及蛋白質(zhì)方面研究魯氏接合酵母耐高滲的機(jī)理,尚鮮有從魯氏接合酵母在糖質(zhì)量分?jǐn)?shù)80%的高滲培養(yǎng)條件下所產(chǎn)生的細(xì)胞外、胞內(nèi)全物質(zhì)進(jìn)行研究的報(bào)道。本研究采用頂空固相微萃取法和氣相色譜-質(zhì)譜技術(shù)聯(lián)用對(duì)魯氏接合酵母胞外物質(zhì)檢測(cè)分析,利用硅烷化衍生-氣相色譜-質(zhì)譜聯(lián)用技術(shù)對(duì)魯氏接合酵母胞內(nèi)物質(zhì)檢測(cè)分析,可見(jiàn)分光光度計(jì)測(cè)定酵母生長(zhǎng)OD值,采用主成分分析(principal components analysis,PCA)、正交偏最小二乘方判別分析(partial least squares discriminant analysis,PLS-DA)模型進(jìn)行得分分析,對(duì)其物質(zhì)差異性分析,為研究魯氏接合酵母耐高糖滲透壓提供理論依據(jù);對(duì)酵母胞內(nèi)外代謝指紋分析,從物質(zhì)成分角度闡述魯氏接合酵母耐高滲;此外,本研究對(duì)高糖環(huán)境下食品受到魯氏接合酵母污染的檢測(cè)及其污染控制都有重要的意義。
1 材料與方法
1.1 材料與試劑
魯氏接合酵母1130、釀酒酵母2#(Saccharomyces cerevisiae)均由西北農(nóng)林科技大學(xué)食品學(xué)院健康食品制造與安全控制工程實(shí)驗(yàn)室提供。
葡萄糖、蛋白胨、酵母浸粉(均為分析純)北京奧博星生物技術(shù)有限責(zé)任公司;甲基鹽酸鹽、N-甲基-N-三甲基硅烷三氟乙酰胺(N-methyl-N-(trimethylsilyl)trifluoroacetamide,MSTFA) 上海源葉生物有限公司;3-辛醇(氣相色譜標(biāo)準(zhǔn)品,純度>98%) 日本東京化成工業(yè)株式會(huì)社;吡啶 天津市科密歐化學(xué)試劑有限公司;氯化鈉(分析純) 四川西隴化工有限公司。
1.2 儀器與設(shè)備
HC-3018R高速冷凍離心機(jī) 安徽中科中佳科學(xué)儀器有限公司;YXQ-LS-70A型立式壓力蒸汽滅菌器上海博迅實(shí)業(yè)有限公司醫(yī)療設(shè)備廠;UV-1700紫外-可見(jiàn)分光光度計(jì)、120150-T230L氣相色譜-質(zhì)譜聯(lián)用儀 日本島津公司;MD200-1氮吹儀 杭州奧盛儀器有限公司;YT-CJ-2ND型超凈工作臺(tái) 北京亞泰科隆儀器技術(shù)有限公司;ZWY-240恒溫培養(yǎng)振蕩器 上海智城分析儀器制造有限公司。
1.3 方法
1.3.1 菌種的活化與培養(yǎng)
將保存在甘油管的魯氏接合酵母1130、釀酒酵母2#自然條件下解凍后,置于滅菌后的YPD培養(yǎng)基中進(jìn)行活化,于28 ℃、120 r/min搖床中培養(yǎng)24 h。取第1代活化的種子液以2%的接種量接種于滅菌完成的YPD液體培養(yǎng)基中,28 ℃、120 r/min搖床中進(jìn)行培養(yǎng),待菌液濃度達(dá)到108CFU/mL后,作為種子液待用。分別配制糖質(zhì)量分?jǐn)?shù)2%(基本培養(yǎng)條件)、80%(高滲培養(yǎng)條件)的YPD培養(yǎng)基,魯氏接合酵母接種量2%分別接種于2%(記為Z1)、80%(記為Z2)糖的YPD培養(yǎng)基中,釀酒酵母以2%接種量接種于2%糖(記為S1)的YPD培養(yǎng)基中,于28 ℃、120 r/min搖床中進(jìn)行培養(yǎng)。期間定時(shí)取樣測(cè)OD值,并取對(duì)數(shù)期樣品進(jìn)行實(shí)驗(yàn)。
1.3.2 酵母生長(zhǎng)情況分析
根據(jù)王虎玄等[11]對(duì)魯氏接合酵母生長(zhǎng)的研究,采用YPD平板涂布稀釋法進(jìn)行計(jì)數(shù),取樣采用紫外分光光度計(jì)在600 nm波長(zhǎng)下測(cè)定OD值,重復(fù)3 次,取平均值。
1.3.3 胞外物質(zhì)的測(cè)定
1.3.3.1 樣品制備與前處理
根據(jù)宋江等[13]測(cè)定方法進(jìn)行改進(jìn)。YPD培養(yǎng)基培養(yǎng)的菌液生長(zhǎng)到對(duì)數(shù)期時(shí),取4 mL于10 mL離心管中10 000 r/min離心10 min,上清液轉(zhuǎn)移至固相萃取樣品瓶中,每個(gè)樣品瓶中加入1.2 g氯化鈉、3 μL質(zhì)量濃度為3.267 mg/L的3-辛醇溶液,上機(jī)測(cè)定。
1.3.3.2 色譜條件
色譜柱:DB-17MS毛細(xì)管色譜柱(30 m×0.25 mm,0.25 μm);采用自動(dòng)進(jìn)樣,進(jìn)樣口溫度250 ℃,載氣為He,流速1.8 mL/min,不分流進(jìn)樣。程序升溫:起始溫度40 ℃,保持3 min后以4 ℃/min的速度升溫至120 ℃,再以6 ℃/min的速度升溫至240 ℃,保持9 min。
1.3.3.3 質(zhì)譜條件
電子電離源,電子能量為70 eV,離子源溫度為230 ℃,接口溫度為230 ℃,質(zhì)量掃描范圍m/z 35~500。
1.3.4 胞內(nèi)物質(zhì)的測(cè)定
1.3.4.1 胞內(nèi)物質(zhì)的淬滅與提取
根據(jù)Kim等[14]測(cè)定方法進(jìn)行改進(jìn)。菌液培養(yǎng)至對(duì)數(shù)期,取5 mL菌液緩慢加入到含20 mL預(yù)冷(-20 ℃)淬滅試劑(體積分?jǐn)?shù)60%甲醇溶液)的50 mL離心管中,于-20 ℃淬滅30 min,4 ℃、10 000 r/min離心5 min,取出倒掉上清液,用5 mL清洗劑進(jìn)行清洗2 次,離心5 min,去上清液。2.5 mL無(wú)水甲醇(-40 ℃)重懸酵母泥,冷凍3 次,離心5 min,吸取上清液,再加2.5 mL無(wú)水甲醇(-40 ℃),渦旋30 s,離心5 min,合并兩次上清液,氮?dú)獯蹈伞?/p>
1.3.4.2 胞內(nèi)物質(zhì)的衍生
離心管中淬滅、提取的胞內(nèi)物經(jīng)氮?dú)獯蹈珊螅蛎總€(gè)離心管中加入100 μL含20 mg/mL甲基鹽酸鹽的吡啶溶液,30 ℃水浴2 h,進(jìn)行污化反應(yīng)。反應(yīng)結(jié)束后,再向每個(gè)樣品中加入100 μL的MSTFA溶液,37 ℃水浴反應(yīng)30 min,過(guò)0.22 μm濾膜,上機(jī)測(cè)定。
1.3.4.3 色譜條件
色譜柱:DB-17MS毛細(xì)管色譜柱(60 m×0.25 mm,0.25 μm);采用自動(dòng)進(jìn)樣,進(jìn)樣口溫度270 ℃,載氣為He,不分流進(jìn)樣,進(jìn)樣體積1 μL,程序升溫:起始溫度150 ℃,保持2 min,以5 ℃/min的速度升溫至270 ℃,保持24 min。
1.3.4.4 質(zhì)譜條件
電子電離源,電子能量為70 eV,離子源溫度為250 ℃,接口溫度為280 ℃,質(zhì)量掃描范圍m/z 80~500。
1.3.5 定性與定量
氣相色譜-質(zhì)譜測(cè)定的圖譜,根據(jù)保留時(shí)間、NIST14質(zhì)譜數(shù)據(jù)庫(kù)和相似度對(duì)檢測(cè)出的各個(gè)物質(zhì)進(jìn)行匹配,相似度大于80的物質(zhì)作為檢測(cè)出物質(zhì)成分進(jìn)行定性分析。胞外物質(zhì)成分根據(jù)加入的3-辛醇含量,計(jì)算檢測(cè)出的各個(gè)物質(zhì)含量,重復(fù)取平均值。

1.4 數(shù)據(jù)處理
數(shù)據(jù)用Excel軟件處理,SIMCA-P軟件對(duì)各物質(zhì)做PCA模型、PLS-DA模型分析。
2 結(jié)果與分析
2.1 魯氏接合酵母、釀酒酵母生長(zhǎng)期間OD值變化
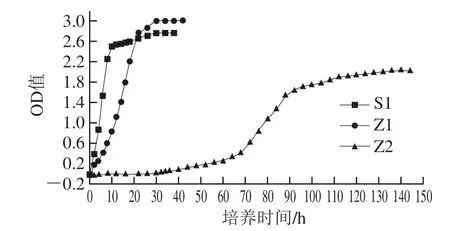
圖1 酵母生長(zhǎng)期間OD值變化Fig.1 Changes in OD value during yeast growth
由圖1可知,Z2的適應(yīng)期時(shí)間基本在45 h,這與王虎玄等[11]研究的溫度與pH值條件對(duì)魯氏接合酵母生長(zhǎng)影響的研究適應(yīng)趨勢(shì)基本一致,在80%高糖質(zhì)量分?jǐn)?shù)條件下,魯氏接合酵母為了適應(yīng)高滲環(huán)境,會(huì)改變細(xì)胞組成以及產(chǎn)生相容性物質(zhì)抵御高滲環(huán)境帶來(lái)的沖擊。此研究中,滲透壓較高,適應(yīng)時(shí)間在45 h左右,Z2在45~70 h處于緩慢生長(zhǎng),70~100 h生長(zhǎng)速率較快,此時(shí)期也處于對(duì)數(shù)時(shí)期,后期生長(zhǎng)變慢趨于穩(wěn)定。S1、Z1的適應(yīng)時(shí)間較短,S1在12 h后對(duì)數(shù)期就結(jié)束,生長(zhǎng)較慢趨于穩(wěn)定,Z1的適應(yīng)時(shí)間比S1長(zhǎng)2 h,在24 h后生長(zhǎng)變慢趨于穩(wěn)定,但到穩(wěn)定期時(shí)Z1比S1的OD值高,可以達(dá)到3.01,而S1趨于穩(wěn)定時(shí)OD值為2.78,Z2達(dá)到穩(wěn)定期時(shí)OD值為2.01。
2.2 胞外物質(zhì)成分分析
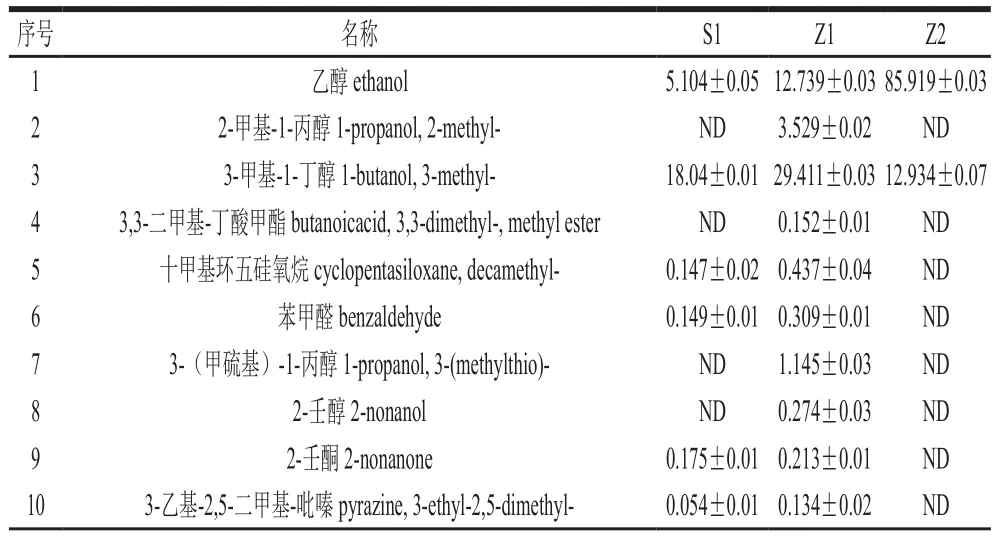
表1 S1、Z1、Z2發(fā)酵胞外物質(zhì)成分及其質(zhì)量濃度Table1 Concentrations of extracellular compounds from Z. rouxii and S. cerevisiae mg/L
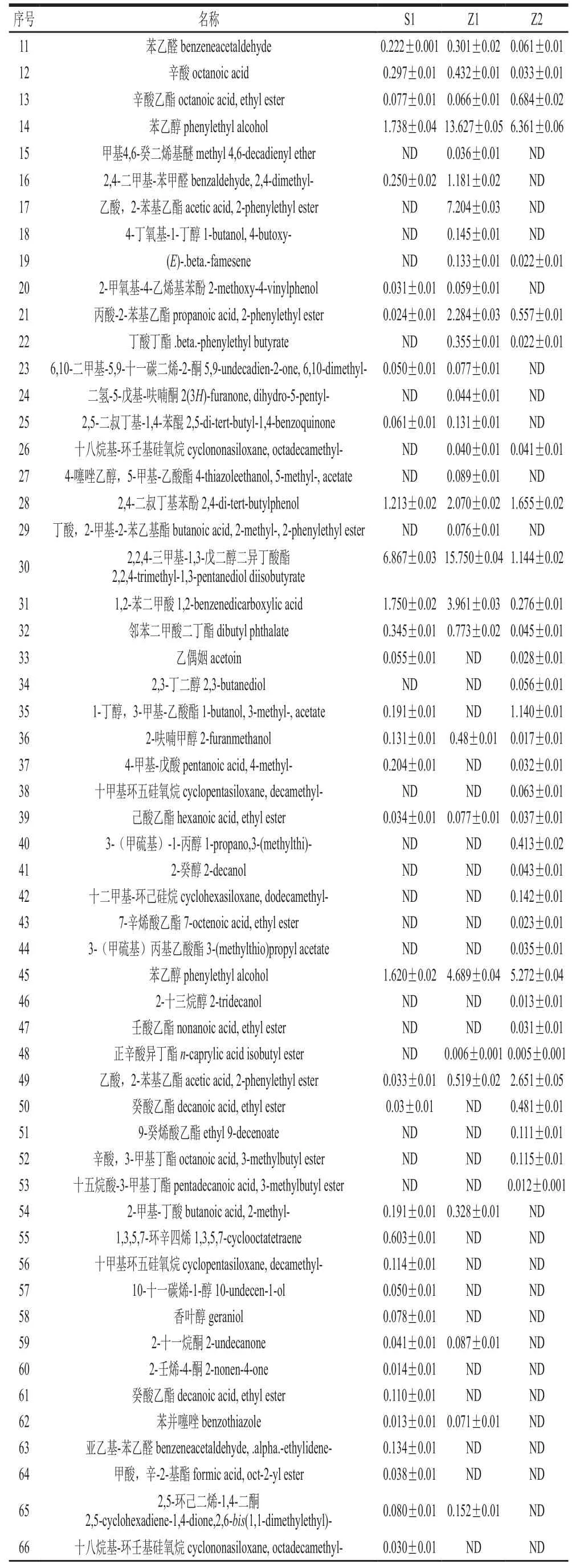
續(xù)表1 mg/L
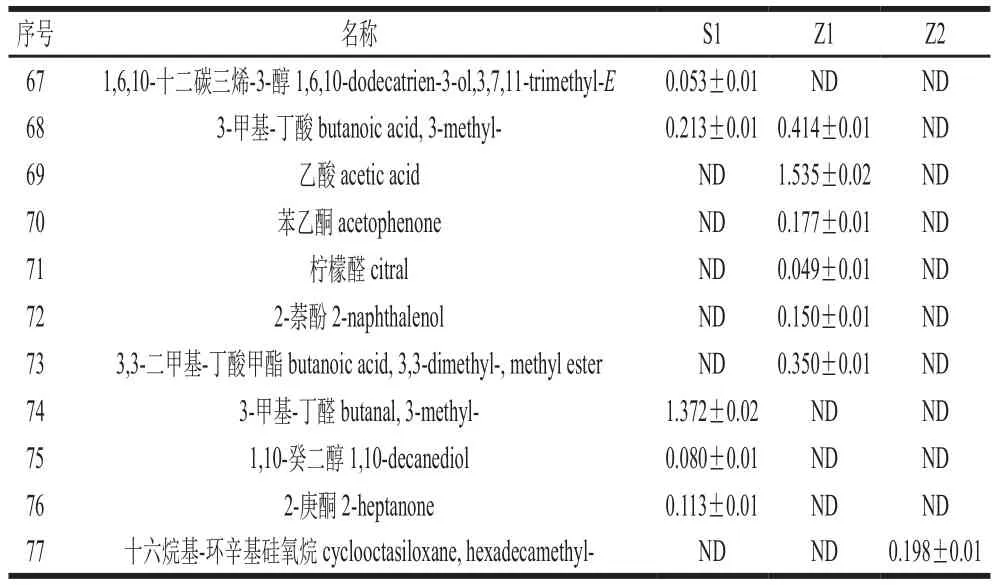
續(xù)表1 mg/L
如表1所示,Z2共36 種,其中醇類9 種,酯類16 種,酸類3 種,無(wú)酮類物質(zhì);Z1共47 種,其中醇類9 種,酯類12 種,酸類5 種,酮類6 種;S1共45 種,其中醇類9 種,酯類10 種,酸類5 種,酮類6 種。在Z2以醇類、酯類居多,與Z1、S1比較沒(méi)有產(chǎn)生酮類化合物。
2.3 胞外物質(zhì)的PCA
根據(jù)已有報(bào)道[15-16]利用PCA、PLS-DA模型對(duì)檢測(cè)物質(zhì)的分析,采用無(wú)監(jiān)督的PCA模型對(duì)S1、Z1、Z2胞外物質(zhì)分析,見(jiàn)圖2。
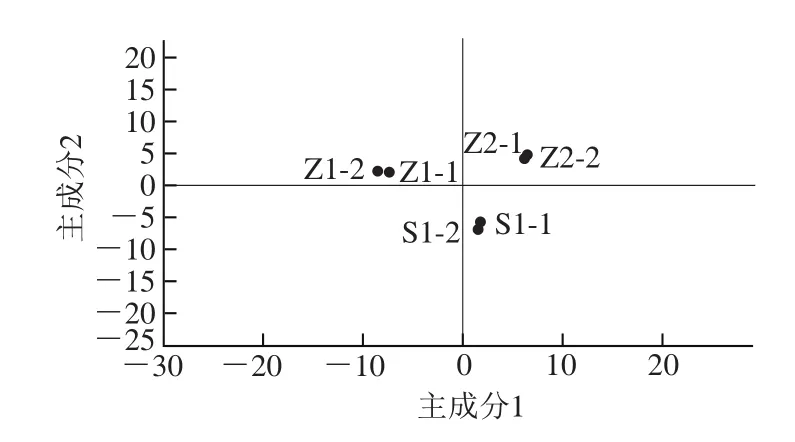
圖2 S1、Z1、Z2發(fā)酵胞外物質(zhì)PCA圖Fig.2 PCA score plot of extracellular substances from Z. rouxii and S. cerevisiae
軟件自動(dòng)對(duì)數(shù)據(jù)進(jìn)行模型擬合分析,共獲得2 個(gè)主成分,R2X=0.881,Q2=0.702。由圖2可以觀察到,S1、Z1、Z2分別分布在PCA得分圖不同的區(qū)域,顯示S1、Z1、Z2具有顯著差異。一般來(lái)說(shuō)R2X值大于0.4表示該模型可靠,此研究中PCA的R2X=0.881,因此當(dāng)前PCA模型能可靠地用于解釋S1、Z1、Z2樣本之間的差異性。
2.4 胞外物質(zhì)的PLS-DA分析
采用有監(jiān)督的PLS-DA模型對(duì)S1、Z1、Z2胞外物質(zhì)進(jìn)行更進(jìn)一步分析[17-20],見(jiàn)圖3。并通過(guò)PLS-DA模型VIP(variable importance in the projection)值(閾值>1)尋找它們之間的差異物質(zhì),PLS-DA模型主成分的VIP值如圖4所示。
從圖3可以觀察到,S1、Z1、Z2在得分圖可以完全分開(kāi),R2=0.996 7,Q2=0.980 7,兩者都接近1,說(shuō)明所建模型可信度高,Z1、Z2在得分圖完全分開(kāi),說(shuō)明80%糖的高滲透壓與2%糖條件下魯氏接合酵母生長(zhǎng)所產(chǎn)生的物質(zhì)有顯著差異;S1、Z1是在2%糖條件下生長(zhǎng)的不同菌種,兩者也可以分開(kāi),說(shuō)明不同的菌種也有顯著差異。Z2能夠在高滲透壓下生長(zhǎng),為了篩選出受高糖滲透壓影響的標(biāo)志性代謝物,選取VIP值大于1的差異變量,并是Z2產(chǎn)生的物質(zhì),43、44、46、53、51、40和41號(hào)物質(zhì),即7-辛烯酸乙酯、3-(甲硫基)丙基乙酸酯、2-十三烷醇、十五烷酸-3-甲基丁酯、9-癸烯酸乙酯、3-(甲硫基)-1-丙醇、2-癸醇7 種物質(zhì),同時(shí)這些醇類、酯類也賦予了特殊的氣味和風(fēng)味。在高滲培養(yǎng)條件下,為了適應(yīng)高滲環(huán)境,魯氏接合酵母會(huì)產(chǎn)生一些特殊的物質(zhì)來(lái)抵御高滲環(huán)境,主要是醇類物質(zhì),此研究檢測(cè)出3 種醇類物質(zhì)。
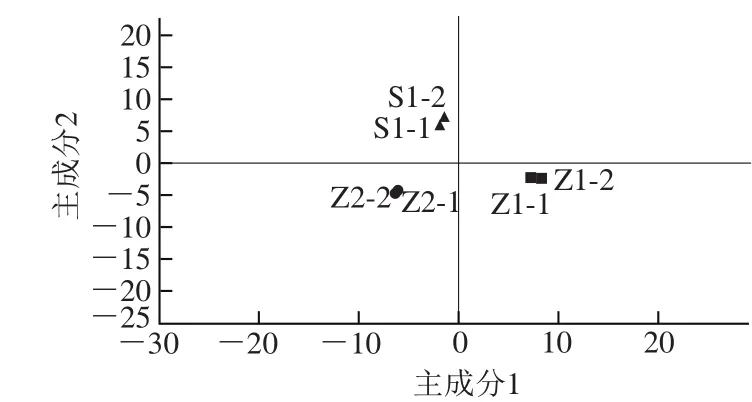
圖3 S1、Z1、Z2發(fā)酵胞外物質(zhì)PLS-DA圖Fig.3 PLS-DA score plot of extracellular substances from Z. rouxii and S. cerevisiae
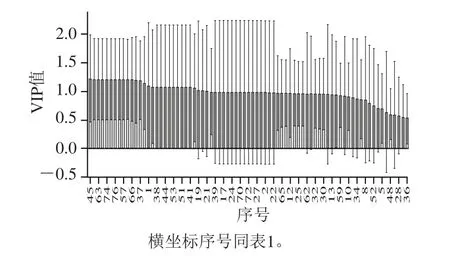
圖4 PLS-DA模型主成分的VIP值Fig.4 VIP values of principal components in the PLS-DA model
2.5 胞內(nèi)物質(zhì)成分分析
對(duì)Z1、Z2培養(yǎng)至對(duì)數(shù)期的菌液淬滅、提取、硅烷化衍生后,氣相色譜-質(zhì)譜聯(lián)用上機(jī)測(cè)樣,根據(jù)NIST 14質(zhì)譜數(shù)據(jù)庫(kù)對(duì)各物質(zhì)進(jìn)行匹配,進(jìn)行定性分析,挑選匹配度大于80的物質(zhì),其分類及百分比見(jiàn)表2,Z1、Z2各物質(zhì)成分見(jiàn)表3。
魯氏接合酵母為了適應(yīng)高滲環(huán)境,會(huì)產(chǎn)生一些相容性物質(zhì)使細(xì)胞能夠適應(yīng)高滲透壓環(huán)境,生長(zhǎng)時(shí)期、碳源、氮源不同,產(chǎn)生的物質(zhì)種類和含量也會(huì)有差別[21],主要是一些醇類、糖類物質(zhì),還會(huì)有酮類物質(zhì)。由表2可以看出,Z2與Z1相比較,物質(zhì)數(shù)量減少,醇類物質(zhì)增加了2 種,但百分占比較Z1低,酸類物質(zhì)百分占比無(wú)太大變化;酯類物質(zhì)Z2比Z1物質(zhì)少了6 種,百分占比降低至13.72%,降低幅度較大,這也說(shuō)明魯氏接合酵母實(shí)際運(yùn)用中,在基本的葡萄糖含量條件下產(chǎn)生的酯類種類含量較高,在醬油生產(chǎn)中,魯氏接合酵母能夠產(chǎn)生較多的風(fēng)味物質(zhì)[22];糖類種類及含量增加,魯氏接合酵母為了適應(yīng)高糖環(huán)境,會(huì)產(chǎn)生海藻糖、中間代謝的麥芽糖及其他糖類物質(zhì),來(lái)抵御外界的高滲環(huán)境,產(chǎn)生的糖類物質(zhì)促進(jìn)了魯氏接合酵母在高糖環(huán)境下的生長(zhǎng),同時(shí)氨基酸百分占比增加。研究結(jié)果表明,Z2產(chǎn)生的醇類、糖類、氨基酸類物質(zhì)是主要增加的物質(zhì),Tikam等[4]綜述的魯氏接合酵母對(duì)食品中糖脅迫下的反應(yīng)會(huì)使酵母細(xì)胞產(chǎn)生甘油等醇類、海藻糖等糖類以及代謝物變化,與本研究相似。表3中Z1、Z2產(chǎn)生的相同物質(zhì)有23 種,Bubnova等[23]研究魯氏接合酵母耐鹽調(diào)節(jié)方式中,檢測(cè)到甘油、海藻糖的含量是動(dòng)態(tài)變化的,但一直存在魯氏接合酵母生長(zhǎng)中,在本研究Z1、Z2產(chǎn)生的不同物質(zhì)中,也檢測(cè)到甘油、海藻糖。產(chǎn)生的麥芽糖也在一定程度上促進(jìn)魯氏接合酵母耐高滲,以麥芽糖為底物,海藻糖在海藻糖合成酶催化下以TreS途徑進(jìn)行生物合成[24],本研究Z2產(chǎn)生的麥芽糖說(shuō)明海藻糖在高糖環(huán)境下是以TreS途徑合成的海藻糖。Z1、Z2都檢測(cè)到角鯊烯,說(shuō)明兩者都在生長(zhǎng)過(guò)程生成了角鯊烯,但在不同物質(zhì)中,Z1檢測(cè)到了膽固醇,而Z2檢測(cè)到的是羊毛固醇,鯊烯可以與固醇載體蛋白接合,經(jīng)加氧酶、環(huán)化酶催化反應(yīng),生成羊毛固醇,再經(jīng)一系列氧化、脫羧、還原步驟,生成膽固醇,Z1產(chǎn)生了膽固醇,說(shuō)明此反應(yīng)鏈完整;Z2只產(chǎn)生了羊毛固醇,研究表明,在高糖條件下,膽固醇反應(yīng)鏈被切斷或者還沒(méi)到膽固醇的合成這一步驟,也有可能羊毛固醇這一物質(zhì)能夠抵御高滲環(huán)境,羊毛固醇在此反應(yīng)鏈中積累,而不再進(jìn)行下一步反應(yīng)。Z1產(chǎn)生了尿素、戊二胺、丁二胺等含氮物質(zhì),Z2并沒(méi)有產(chǎn)生含氮的化合物,高糖滲透環(huán)境下魯氏接合酵母對(duì)氮的代謝有所減弱,說(shuō)明高糖影響了氮代謝。酪氨酸脫氨基可以參與延胡索酸的合成,賴氨酸參與乙酰CoA的合成,半胱氨酸參與丙酮酸的合成,說(shuō)明在高糖環(huán)境下產(chǎn)生的這些氨基酸間接影響了魯氏接合酵母耐高滲,此外,景天庚酮糖、木糖醇、D-木糖、D-半乳糖也可參與碳水化合物的代謝[25-30]。
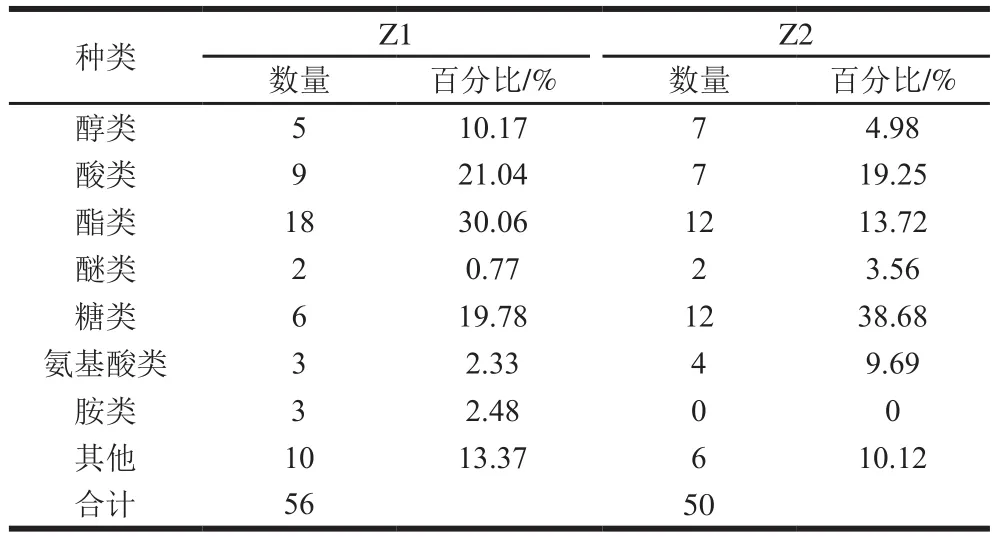
表2 Z1、Z2胞內(nèi)物質(zhì)種類Table2 Classes of intracellular materials from Z. rouxii

表3 Z1、Z2胞內(nèi)物質(zhì)成分Table3 Comparison of intracellular materials from Z. rouxii under two culture conditions
3 結(jié) 論
在高糖滲透壓下,魯氏接合酵母Z2適應(yīng)期達(dá)45 h,菌體呈對(duì)數(shù)生長(zhǎng),生長(zhǎng)100 h后趨向穩(wěn)定,但生長(zhǎng)穩(wěn)定后,其OD值低于基本培養(yǎng)條件下的OD值。
采用固相微萃取,通過(guò)氣相色譜-質(zhì)譜檢測(cè)酵母胞外物質(zhì),高滲培養(yǎng)條件下魯氏接合酵母共有36 種;基本培養(yǎng)條件下魯氏接合酵母共有47 種;基本培養(yǎng)條件培養(yǎng)釀酒酵母共45 種。得到高滲培養(yǎng)條件下魯氏接合酵母的特征性物質(zhì)為7-辛烯酸乙酯、3-(甲硫基)丙基乙酸酯、2-十三烷醇、十五烷酸-3-甲基丁酯、9-癸烯酸乙酯、3-(甲硫基)-1-丙醇、2-癸醇。
采用硅烷化衍生處理,氣相色譜-質(zhì)譜檢測(cè)酵母胞內(nèi)物質(zhì),高糖滲透壓與基本培養(yǎng)條件下魯氏接合酵母產(chǎn)生了27 種不同的物質(zhì),沒(méi)有產(chǎn)生含氮化合物,氮代謝受到了影響,此外這些物質(zhì)參與糖代謝、能量代謝,其中海藻糖在高糖環(huán)境下是以TreS途徑合成的海藻糖。本研究為后續(xù)研究魯氏接合酵母耐高糖滲透壓提供了理論依據(jù),對(duì)魯氏接合酵母的檢測(cè)以及控制都有重要的意義,對(duì)于產(chǎn)生的差異性物質(zhì)誘導(dǎo)基因的形成和其耐高滲機(jī)理還需進(jìn)一步研究。
[1] 白靜, 岳田利, 王虎玄, 等. 射頻加熱殺滅濃縮蘋(píng)果汁中魯氏接合酵母的工藝優(yōu)化[J]. 農(nóng)業(yè)工程學(xué)報(bào), 2016, 32(2)∶ 273-279.DOI∶10.11975/j.issn.1002-6819.2016.02.039.
[2] 李國(guó)良. 濃縮蘋(píng)果汁中耐高滲酵母的檢測(cè)與控制技術(shù)[D]. 楊凌∶ 西北農(nóng)林科技大學(xué), 2012.
[3] 鄭聃, 付暢, 戴紹軍, 等. 鹽脅迫下釀酒酵母和魯氏酵母滲透調(diào)節(jié)方式的對(duì)比與分析[J]. 哈爾濱師范大學(xué)自然科學(xué)學(xué)報(bào), 2007, 23(2)∶91-95.
[4] TIKAM C D, LISA S, PAOLO G. Adaptive response and tolerance to sugar and salt stress in the food yeast Zygosaccharomyces rouxii[J].International Journal of Food Microbiology, 2014,185∶ 140-157.DOI∶10.1016/j.ijfoodmicro.2014.05.015.
[5] HOSONO K. Effect of salt stress on lipid composition and membrane fluidity of the salttolerant yeast Zygosaccharomyces rouxii[J].Journal of General and Applied Microbiology, 1992, 138(1)∶ 91-96.DOI∶10.1099/00221287-138-1-91.
[6] GUO H, NIU C, LIU B, et al. Protein abundance changes of Zygosaccharomyces rouxii in different sugar concentrations[J].International Journal of Food Microbiology, 2016, 233∶ 44-51.DOI∶10.1016/j.ijfoodmicro.2016.05.003.
[7] WEI Y H, WANG C, WANG M, et al. Comparative analysis of salttolerant gene HOG1 in a Zygosaccharomyces rouxii mutant strain and its parent strain[J]. Journal of the Science of Food & Agriculture,2013, 93(11)∶ 2765-2770. DOI∶10.1002/jsfa.6096.
[8] TAING O, TAING K. Production of malic and succinic acids by sugartolerant yeast Zygosaccharomyces rouxii[J]. European Food Research &Technology, 2007, 224(3)∶ 343-347. DOI∶10.1007/s00217-006-0323-z.
[9] 吳雅男. 醬油魯氏酵母S、S3-2關(guān)鍵風(fēng)味代謝物對(duì)比研究[D]. 天津∶天津科技大學(xué), 2015.
[10] SPERBER W, DOYLE M P. Compendium of the microbiological spoilage of foods and beverages[M]. Springer, 2009. DOI∶10.1007/978-1-4419-0826-1.
[11] 王虎玄, 胡仲秋, 牛晨, 等. 糖度與酸度對(duì)魯氏接合酵母生長(zhǎng)的影響[J]. 農(nóng)業(yè)機(jī)械學(xué)報(bào), 2015, 46(10)∶ 279-284. DOI∶10.6041/j.issn.1000-1298.2015.10.037.
[12] MARTORELL P, STRATFORD M, STEELS H, et al. Physiological characterization of spoilage strains of Zygosaccharomyces bailii, and Zygosaccharomyces rouxii, isolated from high sugar environments[J].International Journal of Food Microbiology, 2007, 114(2)∶ 234-242.DOI∶10.1016/j.ijfoodmicro.2006.09.014.
[13] 宋江. 醬油釀造用魯氏接合酵母菌的生長(zhǎng)及其產(chǎn)香氣成分研究[D].長(zhǎng)沙∶ 湖南農(nóng)業(yè)大學(xué), 2013.
[14] KIM S, KIM J, SONG J H, et al. Elucidation of ethanol tolerance mechanisms in Saccharomyces cerevisiae by global metabolite profiling[J]. Biotechnology Journal, 2016, 11(9)∶ 1221-1229.DOI∶10.1002/biot.201500613.
[15] 孫茂成. 保加利亞乳桿菌代謝組學(xué)樣品的前處理研究[D]. 哈爾濱∶東北農(nóng)業(yè)大學(xué), 2013.
[16] 練榮偉. 代謝物對(duì)微生物調(diào)控作用的色譜-質(zhì)譜聯(lián)用分析[D]. 大連∶大連工業(yè)大學(xué), 2013.
[17] CUI F X, ZHANG R M, LIU H Q, et al. Metabolic responses to Lactobacillus plantarum, contamination or bacteriophage treatment in Saccharomyces cerevisiae, using a GC-MS-based metabolomics approach[J]. World Journal of Microbiology and Biotechnology, 2015,31(12)∶ 2003-2013. DOI∶10.1007/s11274-015-1949-4.
[18] HARADA R, YUZUKI M, ITO K, et al. Influence of yeast and lactic acid bacterium on the constituent profile of soy sauce during fermentation[J]. Journal of Bioscience & Bioengineering, 2017,123(2)∶ 203-208. DOI∶10.1016/j.jbiosc.2016.08.010.
[19] ZHAO J, DAI X, LIU X, et al. Comparison of aroma compounds in naturally fermented and inoculated Chinese soybean pastes by GC-MS and GC-olfactometry analysis[J]. Food Control, 2011, 22(6)∶ 1008-1013. DOI∶10.1016/j.foodcont.2010.11.023.
[20] QI W, GUO H L, WANG C L, et al. Comparative study on fermentation performance in the genome shuff l ed Candida versatilis and wild-type salt tolerant yeast strain[J]. Journal of the Science of Food & Agriculture, 2016, 97(1)∶ 284-290.
[21] 徐瑩, 姜維, 何曉霞. 耐鹽性魯氏酵母的研究進(jìn)展[J]. 中國(guó)釀造,2009, 28(10)∶ 1-4. DOI∶10.3969/j.issn.0254-5071.2009.10.001.
[22] 王聰, 王檬, 赫景鈺, 等. 醬油釀造風(fēng)味菌株T酵母耐鹽機(jī)理的初步研究[J]. 中國(guó)釀造, 2015, 34(2)∶ 26-30. DOI∶10.11882/j.issn.0254-5071.2015.02.006.
[23] BUBNOVA M, ZEMANCIKOVA J, SYCHROVA H. Osmotolerant yeast species differ in basic physiological parameters and in tolerance of non-osmotic stresses[J]. Yeast, 2014, 31(8)∶ 309-321. DOI∶10.1002/yea.3024.
[24] 王繼花. 鹽脅迫下釀酒酵母生理生化特性的研究[D]. 大連∶ 大連工業(yè)大學(xué), 2008.
[25] TOMASZEWSKA L, RYWINSKA A, GLADKOWSKI W.Production of erythritol and mannitol by Yarrowia lipolytica yeast in media containing glycerol[J]. Journal of Industrial Microbiology &Biotechnology, 2012, 39(9)∶ 1333-1343. DOI∶10.1007/s10295-012-1145-6.
[26] 楊陽(yáng), 鄧岳, 劉彥希, 等. 一株醬油中耐鹽酵母Meyerozyma guilliermondii的分離鑒定及其揮發(fā)性香氣成分分析[J]. 中國(guó)測(cè)試,2016, 42(11)∶ 55-59. DOI∶10.11857/j.issn.1674-5124.2016.11.012.
[27] 張繼冉, 方芳, 陳堅(jiān), 等. 魯氏接合酵母對(duì)醬油中氨基甲酸乙酯前體物的代謝[J]. 微生物學(xué)報(bào), 2016, 56(6)∶ 956-963. DOI∶10.13343/j.cnki.wsxb.20150394.
[28] 謝夢(mèng)琴. 鹽脅迫下魯氏接合酵母產(chǎn)MAP酶條件優(yōu)化與其耐鹽機(jī)理的研究[D]. 長(zhǎng)沙∶ 湖南農(nóng)業(yè)大學(xué), 2014.
[29] 閆美. 高耐鹽醬油酵母的選育及其在醬油釀造中的應(yīng)用[D]. 武漢∶湖北工業(yè)大學(xué), 2014.
[30] 王偉偉, 唐鴻志, 許平. 嗜鹽菌耐鹽機(jī)制相關(guān)基因的研究進(jìn)展[J].微生物學(xué)通報(bào), 2015, 42(3)∶ 550-558. DOI∶10.13344/j.microbiol.china.140528.

