基于常規MRI圖像的紋理分析鑒別:血管周細胞瘤/孤立性纖維瘤與血管瘤型腦膜瘤
董俊伊,苗延巍*,劉雙,韓亮,李曉欣,劉楊穎秋,宋清偉,韋玉山,劉愛連
血管周細胞瘤(hemanyiopericytoma,HPC)在中樞神經系統較少見,約占腦腫瘤的1%[1-2]。HPC是來源于腦膜間質血管外皮細胞的一種惡性腫瘤,具有明顯的侵襲性,術后不僅可以復發,而且可以向腦外轉移[3]。而血管瘤型腦膜瘤(hemangioma meningioma,HM)起源于蛛網膜絨毛頂端的帽狀細胞,以良性腫瘤居多,其多數預后良好,如切除徹底,可獲永久性治愈[4-5]。HPC與HM在治療及預后方面完全不同,所以對于兩者的術前鑒別是非常必要的。有研究顯示HPC在形態、大小、信號(囊變壞死,血管流空影)、與硬腦膜關系等方面與HM存在顯著差異[5]。在常規情況下,磁共振成像(magnetic resonance imaging,MRI)是鑒別HPC與HM的首選方法,然而由于兩者的發病部位以及MRI表現非常相似,因此如果僅依靠肉眼分析影像學征象的方法來鑒別兩者,臨床誤診率較高。而紋理分析是一種新的圖像分析方法[6],已應用于頭頸部、子宮、直腸等惡性腫瘤分級或評估預后[7-12]。另外,以往對腫瘤的定量大多采用選擇局部感興趣區(region of interest,ROI)法,但這種方法不能全面、準確地反映腫瘤整體的異質性,并且這種方法存在個人選擇誤差及樣本誤差[13-14]。基于腫瘤全域的ROI方法則涵蓋了整個腫瘤,消除了潛在的抽樣偏差,可以提供更全面的腫瘤異質性的信息[11,15-17]。目前尚無腫瘤全域基于常規MRI序列的紋理分析血管周細胞瘤及血管瘤型腦膜瘤的相關報道。因此,本研究擬探討基于常規MRI圖像,腫瘤全域的紋理分析在兩者的鑒別診斷價值。
1 材料與方法
1.1 臨床資料
回顧性收集自2010年1月至2017年3月在大連醫科大學附屬第一醫院進行MRI掃描,并手術或活檢病理證實的HPC及HM患者22例。入組標準:(1)術后組織學診斷依據《WHO 2016版中樞神經系統腫瘤分類》[18];(2) MRI掃描前未行手術、穿刺,也未行放化療;檢查前已簽署知情同意書;(3)均使用GE Signa HDxt 3.0 T進行常規MRI序列T1WI、T2WI、T1WI增強掃描。5例患者因圖像部分丟失或圖像質量欠佳(n=2)及MRI掃描前已進行手術(n=3)被排除。最終共有17例患者入組,其中HPC 8例(男1例,女7例),年齡(66.0±22.3)歲;HM 9例(男4例,女5例),年齡(57.0±21.5)歲。
1.2 數據采集
本研究采用美國GE Signa HDxt 3.0 T MRI掃描儀,患者仰臥位,采用標準頭線圈。MRI平掃序列包括:快速自旋回波(fast spin echo,FSE)T1WI矢狀位及軸位、FSE T2WI 軸位。然后行T1WI增強掃描,依次采用三維結構像掃描(threedimensional brain volume,3D BRAVO)及自旋回波(spin echo,SE)序列T1WI軸位,增強掃描用釓賁替酸葡甲胺,經肘靜脈注射,劑量0.1 mmol/kg,注射流速3.0 ml/s。具體掃描參數見表1。
1.3 圖像處理
將T1WI、T2WI、T1WI增強圖的DICOM格式數據拷貝至個人電腦,導入Omni-Kinetics軟件得到相應的信號強度圖進行后處理。結合T2WI及T1WI增強圖確認腫瘤實質、水腫區,沿腫瘤水腫的邊緣逐層手動描繪ROI,涵蓋全部腫瘤實質部分及水腫區域,保證T1WI、T2WI、T1WI增強圖的ROI范圍一致。將所有層面的ROI累加為一個3D ROI (圖1),軟件將分別自動計算出相應強度直方圖。記錄腫瘤全域的紋理參數,包括最小值、最大值、平均值、標準差、相對偏差、體素數、偏度、峰度、一致性、百分位數、均方根值、值域、平均差、集群陰影、集群突出。
1.4 統計學處理
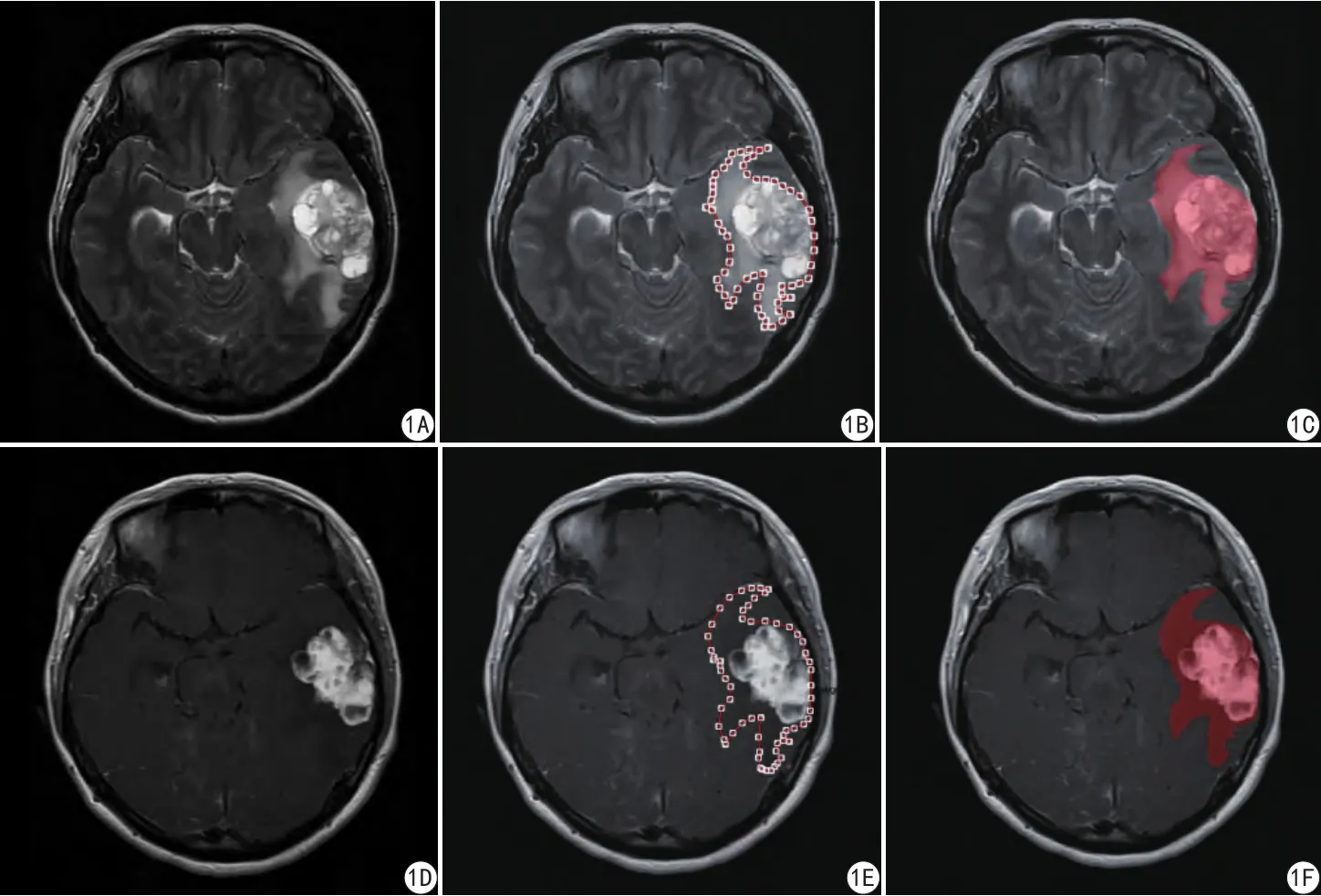
圖1 A、D為腫瘤T2、增強T1原始圖;B、E為利用Omni-Kinetics軟件描繪出腫瘤T2、增強T1的ROI;C、F為各層面疊加計算出的腫瘤T2、增強T1的3D ROI圖像(紅色)Fig. 1 Image analysis work flow, the work flow for image analysis is presented. A, D were T2WI and enhanced T1WI images of the tumor; B, E were ROIs which further delineated based on the Omni-Kinetics software; C, F were the 3D ROI image(red) that further calculated at all levels.
應用統計軟件包SPSS 17.0進行數據分析。將本研究中HPC與血管瘤型腦膜瘤的發病年齡、性別及影像特征進行統計學分析,其中計數資料組間比較采用Fisher確切概率法,計量資料組間比較采用兩獨立樣本t檢驗;采用Mann-Whitney U檢驗進行腫瘤間對照分析。對于有統計學意義的紋理參數,利用受試者操作特性(receiver operating characteristic,ROC)曲線來確定各紋理參數對于鑒別HPC及HM診斷的效能。
2 結果
2.1 一般資料及影像學征象差異
本研究中HPC約87.5%(7/8)呈分葉狀或不規則形,而HM約77.8%(7/9)呈類圓形或橢圓形,并且HPC與HM的形態學差異具有統計學意義(P<0.05)。本研究中囊變壞死在HPC較HM更多見;HPC與HM的瘤周水腫程度不同,HPC多為輕中度水腫(5/8),而HM以中重度水腫(7/9)為主,但兩者囊變壞死以及瘤周水腫之間的差異無統計學意義。而且本研究中HPC與HM患者的年齡、性別,以及HPC與HM腫瘤的大小、T1WI信號、T2WI信號、血管流空影、與腦膜附著形式、腦膜尾征、瘤內出血、中線結構移位等因素差異均無統計學意義(P>0.05)。詳見表2。

表1 掃描序列及參數Tab. 1 Scan sequence and parameters
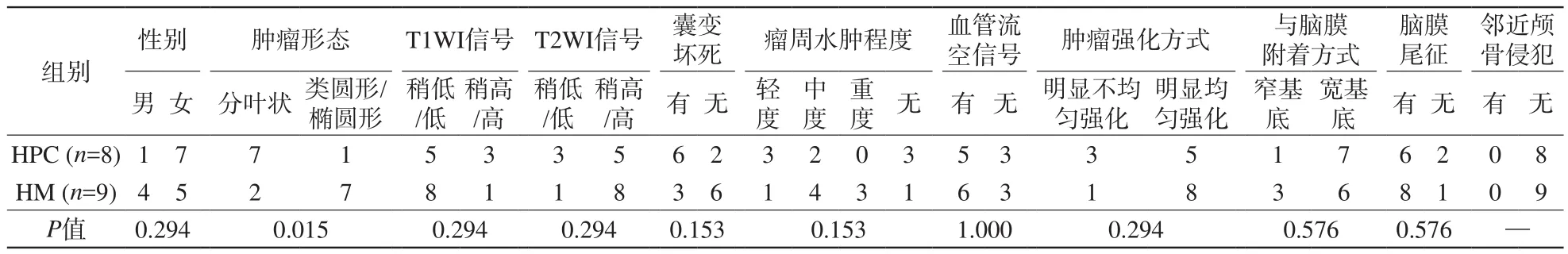
表2 HPC組與HM組的常規資料及影像表現對比Tab. 2 The comparative analysis of general data and different imaging signs in both HPC and HM

續表2 HPC組與HM組的常規資料及影像表現對比Tab.2 (Cont) The comparative analysis of general data and different imaging signs in both HPC and HM
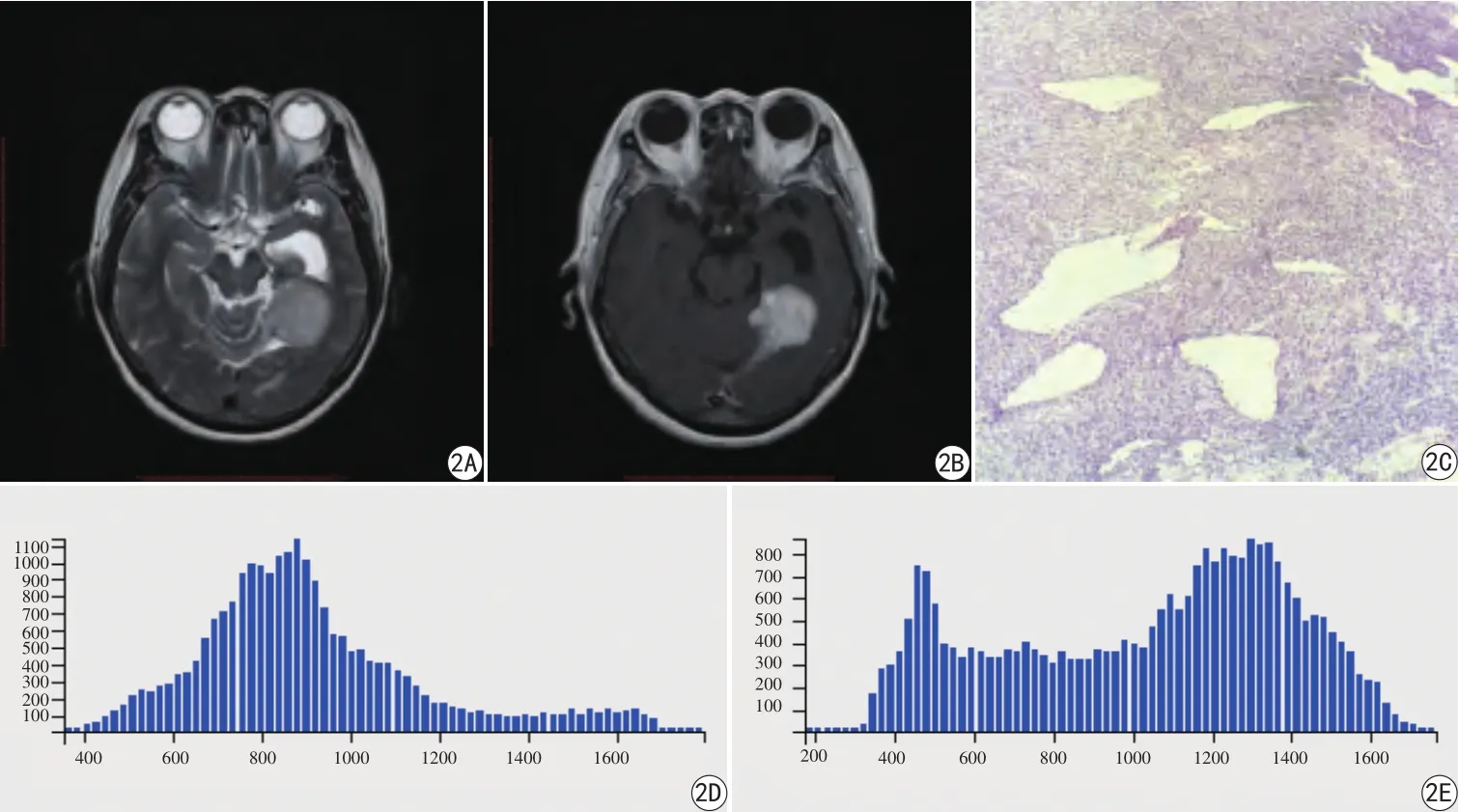
圖2 女,62歲,左側顳部血管周細胞瘤。A:T2WI示腫瘤信號混雜,周圍可見片狀水腫樣信號影;B:T1增強示增強掃描腫瘤明顯強化;C:病理圖顯示鏡下可見大量梭形或多角形細胞,細胞核卵圓形,深染,偶見核分裂像,細胞排列致密,多圍繞血管分布(HE× 100);D: T2WI信號值的直方圖,示圖像中心左偏;E:T1WI增強信號值的直方圖。T2WI直方圖偏度值及峰度值為0.96、3.83,T1WI增強直方圖偏度值及峰度值為-0.32、1.91Fig. 2 Female, 62 years old, left temporal HPC. A: T2WI shows slight high signal intensity with the surrounding patchy edema area. B: The contrasted T1WI shows the homogenous enhancement of tumor; C: Pathology of HPC:microscopically, abundant branches or antlers-shaped thin-walled vessels in tumor stroma, the tumor cells exhibit a dense and diffuse growth pattern with ovoid nuclei (HE × 100); D: The T2WI signal value histogram shows the image center is left skewed, with skewness and kurtosis value of 0.96 and 3.83; E: The contrasted T1WI signal histogram shows widen double leak with skewness and kurtosis of -0.32 and 1.91.
2.2 紋理參數差異
在T1增強信號強度圖像紋理參數中,HPC的平均差和偏度明顯高于HM (P<0.05),而前者的最小值、平均值、均方根值、平均差、均一性、第5、10、25、50(中位數)、75、90百分位數明顯低于后者(P<0.05)。見表3。
T2信號強度圖像紋理參數中,HPC的偏度、集群陰影、集群突出明顯高于HM(P<0.05),而前者的
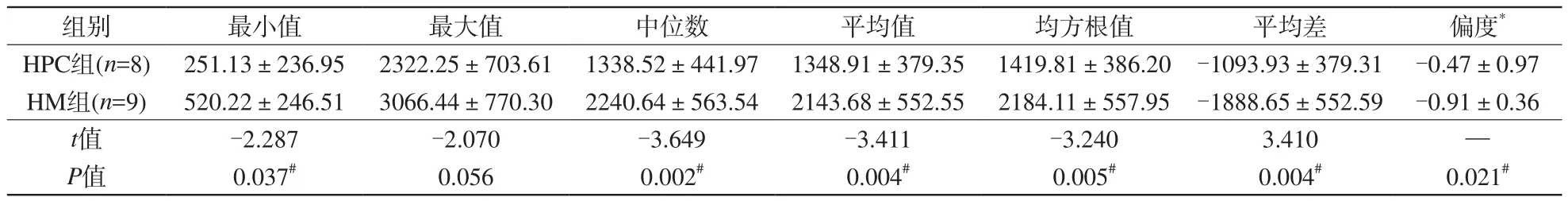
表3 血管周細胞瘤及血管瘤型腦膜瘤增強T1信號強度圖像紋理參數差異Tab. 3 Difference of contrasted T1WI signal intensity texture parameters between HM and HPC

續表3 血管周細胞瘤及血管瘤型腦膜瘤增強T1信號強度圖像紋理參數差異Tab. 3 (Cont) Difference of contrasted T1WI signal intensity texture parameters between HM and HPC
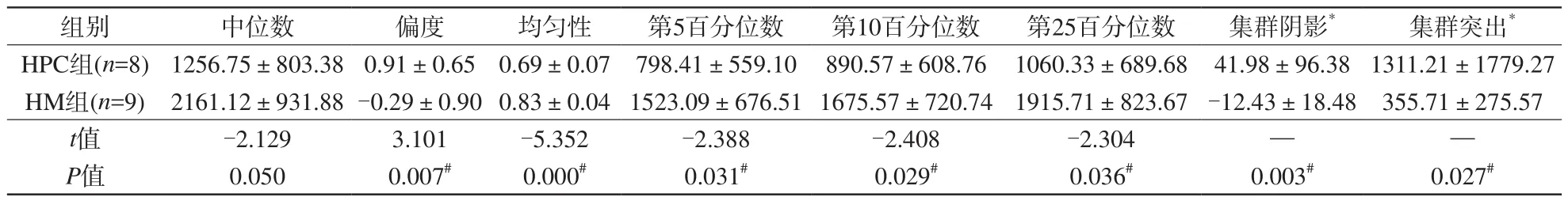
表4 血管周細胞瘤及血管瘤型腦膜瘤T2信號強度圖像紋理參數差異Tab.4 Difference of T2WI signal intensity texture parameters between HM and HPC

圖3 女,58歲,左側顳部血管瘤型腦膜瘤。A:T2WI示腫瘤呈稍高信號,周圍亦可見片狀水腫樣信號影;B:T1增強示增強掃描腫瘤明顯均勻強化;C:病理圖顯示鏡下可見豐富血管組織,管壁厚薄不一,血管間可見小團或散在增生的腦膜皮細胞(HE×100);D、E分別為其T2WI信號值及T1WI增強信號值的直方圖,示圖像中心均明顯右偏。T2WI直方圖偏度值及峰度值分別為-0.32、3.95,T1WI增強直方圖偏度值及峰度值分別為-1.11、3.60Fig. 3 Female, 58 years old, left temporal HM. A: T2WI shows markedly high signal intensity with the surrounding patchy edema area; B: The contrasted T1WI shows homogenous enhancement of tumor; C: Pathology of HM: a large number of blood vessels with thick and thin wall scattering in tumor stroma, and between the blood vessels can see small groups or scattered proliferative meningitis cells (HE ×100); D: The T2WI signal value histogram show the center of the image is clearly right with skewness and kurtosis of -0.32 and 3.95; E: The contrasted T1WI signal histogram also show the center of the image is clearly right with skewness and kurtosis value were -1.11, 3.60.

表5 T1增強信號強度圖像紋理參數鑒別血管周細胞瘤及血管瘤型腦膜瘤的效能Tab.5 ROC results for contrasted T1WI signal intensity texture parameters
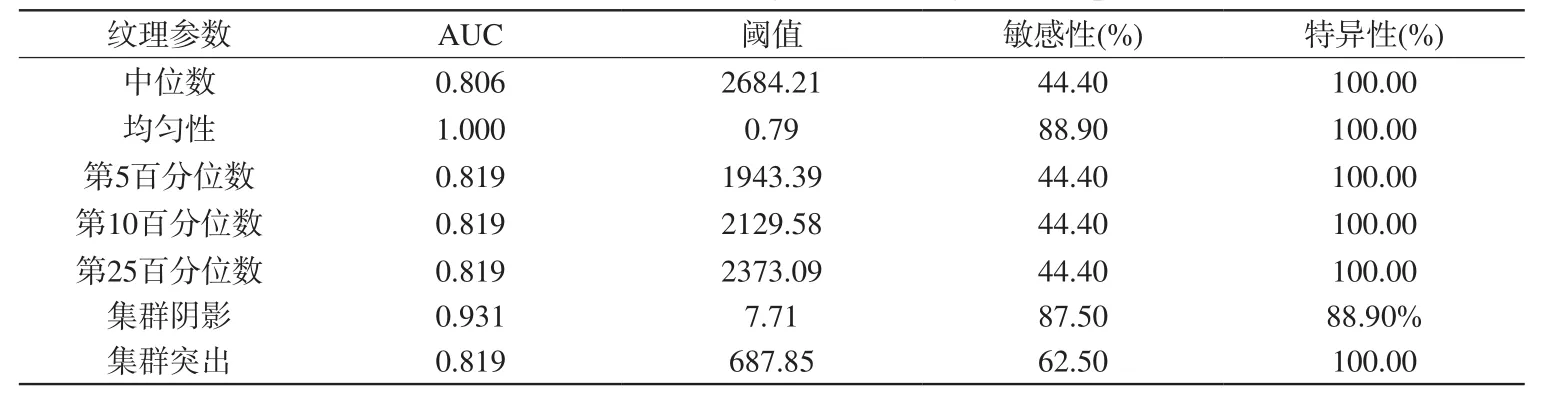
表6 T2信號強度圖像紋理參數鑒別血管周細胞瘤及血管瘤型腦膜瘤的效能Tab.6 ROC results for T2WI signal intensity texture parameters
注:*代表符合非正態分布,用中位值±四分位間距表示;余符合正態分布,用均值±標準差表示。#代表P<0.05均一性、第5、10、25百分位數明顯低于后者(P<0.05)。而兩種腫瘤間T1信號強度圖像各紋理參數值差異均無統計學意義(P>0.05)。見表4。
本研究中,HPC T2WI信號值直方圖的圖像中心明顯左偏,T1WI增強信號值直方圖的圖像表現為高、低雙峰,而高峰的主體偏右。HM T2WI信號值及T1WI增強信號值直方圖的圖像中心均表現出明顯右偏(圖2、3)。
2.3 兩種腫瘤紋理參數的ROC曲線分析
R O C曲線分析顯示,T1增強信號中,以第25百分位數1873.07為閾值鑒別HPC與HM的曲線下面積(area under the curve,AUC)最大,診斷能力最佳(AUC=0.917),敏感性及特異性分別為66.7%、100.0%,而中位值(第50百分位數)的診斷能力次之(AUC=0.903);T2信號中,以均一性0.79為閾值鑒別二者的診斷能力最佳(AUC=1.00),敏感性及特異性分別為88.9%、100%,而集群陰影診斷能力次之(AUC=0.931),見表5、6。
3 討論
3.1 HPC與HM常規影像學、病理表現
本研究顯示HPC與HM在形態學上差異具有統計學意義(P<0.05),即HPC多呈分葉狀或不規則狀,可能因為HPC各部位生長速度不一致,而且與侵襲性生長有關[19-20],而HM多為類圓形及橢圓形;由于HPC腫瘤生長速度過快,侵蝕腫瘤的部分滋養血管,腫瘤血供減少,從而導致HPC中囊變壞死較HM更常見[5],這與本研究結果一致。本研究中,HPC多表現為輕中度瘤周水腫,是由腫瘤迅速浸潤臨近腦組織導致,而HM多表現為中重度瘤周水腫,可能與血管源性水腫有關[5]。并且以往有研究顯示HPC常具有豐富的血管流空現象,MRI信號多不均勻,無腫瘤內鈣化和骨質增生、局部顱骨呈溶骨性破壞,而HM這些表現相對少見,所以其信號多較均勻;MRI增強示HPC和HM腫瘤實體均呈顯著增強效應,但HPC腫瘤實質多為不均勻性強化,而HM腫瘤多為均勻顯著強化[21]。有研究發現ADC值對于HPC及不同亞型腦膜瘤之間的鑒別有一定的價值,但其結果顯示HPC的mADC及NADC值與HM差異無統計學意義[22]。在病理表現方面,HPC鏡下(圖3C)顯示腫瘤細胞主要由密集的梭形細胞構成,血管大小不等,較有特異性的表現為包繞著腫瘤細胞,并環繞著毛細血管內皮細胞、向外放射狀走行網狀纖維[23],而HM鏡下(圖4C)顯示腫瘤瘤組織為增生豐富的厚壁、薄壁血管,其間有散在分布的腦膜上皮細胞[19]。綜上所述,HPC與HM在MRI表現以及病理表現上具有特征性鑒別點,但在大多數情況下,HPC與HM的常規MRI表現有較多相似之處,鑒別診斷極其困難,而且病理檢查屬于有創檢查,不能作為鑒別診斷的首選。
3.2 紋理分析在HPC與HM鑒別中的應用
基于像素分布的紋理分析是通過計算整個組織內部信號值,并分別以MR信號值以及相同信號范圍內像素值為X軸和Y軸,可用來測量ROI的平均信號值、像素數及像素數信號變化范圍,提供定量的腫瘤異質性信息[24-27]。本研究表明,通過涵蓋腫瘤實質和水腫區域的全域測量,兩種腫瘤增強T1WI圖像紋理參數中的最小值、平均值、均方根值、平均差、偏度、均一性、百分位數差異均存在統計學意義(P<0.05),除了平均差和偏度,其余HM各參數值均高于HPC。HM的峰度值高于HPC,表示HM圖像的灰度分布更集中于平均灰度附近[28-29]。筆者認為這主要是由于HM內瘤細胞多均勻分布,結構致密,而HPC內細胞成分混雜所致,但差異并不顯著。本研究中的HPC與HM的偏度值均偏向于負值,其絕對值HPC低于HM。筆者認為發生此現象的原因主要是由于HPC存在較多壞死、囊變,使得曲線分布向左偏移;而HM實質成分較均勻,偏度較大,曲線右偏。而各值區的增強T1WI參數差異均有統計學意義(P<0.05),有理由推斷上述各參數對于兩者之間的鑒別診斷均有意義,而且第25百分位數、第50百分位數(或中位數)具有較好的診斷效能,可能會是相對較為可靠的鑒別診斷參數。
均一性反映的是腫瘤ROI內的異質性程度,數值越小,表明ROI內灰階強度值分布越不均勻,或者說數值范圍大小越大,異質性程度越大[30]。本研究中增強T1WI、T2WI信號的均一性差異存在統計學意義(P<0.05),HM的均一性均高于HPC,說明后者異質性程度較前者更明顯,瘤內存在更多的出血、囊變或壞死。在本研究中,T2WI信號圖像紋理參數中HM的第10百分位數、第25百分位數均顯著高于HPC,說明低值區的T2WI信號強度對于兩者之間的診斷更有意義。集群陰影與集群突出均為衡量灰度共生矩陣偏度和一致性的指標,兩者的值越高,說明不對稱性更大,本研究顯示HPC中上述兩參數均顯著高于HM,與HPC的惡性腫瘤異質性明顯相吻合。本研究結果顯示,以均一性鑒別HPC與HM診斷效能最佳,當閾值為0.79時,ROC曲線AUC為1.00,敏感性及特異性分別為88.9%、100%,這有望作為鑒別二者的一個良好的影像學指標。
3.3 不足之處
本研究也存在局限性。首先,本研究是回顧性研究,無法在外科手術切除前或切除中獲得更多信息。其次,由于HPC與HM均屬于少見腫瘤,因此研究樣本量相對較小,可能會對結果造成一些影響,例如本研究出現AUC為1的情況,這極有可能是由于病例數過小所導致的,因此筆者將繼續收集和總結病例資料,為進一步提高HPC與HM的精確診斷率積累資料。
參考文獻 [References]
[1]Yu GY, Liu XB. Study on the incidence of warthin tumor in parotid gland. J Oral Maxil Surg, 1997, 7(2): 88-91.俞光巖, 柳曉冰. 腮腺沃辛瘤發病情況分析. 口腔頜面外科雜志,1997, 7(2): 88-91.
[2]Wang JH, Tan YH, Zhang G. Clinical analysis of 52 cases of cystadenolymphoma (Warthin' s tumor)in parotid gland. Acta Acad Med Mil Tert, 2004, 26(1): 4.王建華, 譚穎徽, 張綱. 腮腺腺淋巴瘤52例臨床分析. 第三軍醫大學學報, 2004, 26(1): 4.
[3]Zhang J, Du GH. Clinical analysis of 106 cases of central nervous system hemangiopericytoma. Chin J Neurosurg, 2010, 26(10): 935-937.張頡, 杜固宏. 中樞神經系統血管外皮細胞瘤106例臨床分析. 中華神經外科雜志, 2010, 26(10): 935-937.
[4]Liu ML, Han T, Liu L, et al. MRI features and pathological analysis of hemangiopericytoma occurred in the central nervous system. J Chin Comput Med Imag, 2007, 13(6): 389-396.劉梅麗, 韓彤, 劉力, 等. 中樞神經系統血管外皮細胞瘤的MRI表現與病理分析. 中國醫學計算機成像雜志, 2007, 13(6): 389-396.
[5]Chen R, Peng DC, Hu ZL, et al. Differences in MRI findings between intracranial hemangiopericytoma and angiomatous meningioma.Chin J Magn Reson Imaging, 2016, 7(3): 173-179.陳榮, 彭德昌, 胡祖力, 等. 顱內血管周細胞瘤與血管瘤型腦膜瘤的磁共振成像征象對比分析. 磁共振成像, 2016, 7(3): 173-179.
[6]Shahabaz, Somwanshi DK, Yadav AK, et al. Medical images texture analysis: A review. International Conference on Computer,Communications and Electronics. IEEE, 2017: 436-441.
[7]Tozer DJ, J?ger HR, Danchaivijitr N, et al. Apparent diffusion coeffcient histograms may predict low-grade glioma subtype. NMR Biomed, 2007, 20(1): 49-57.
[8]Ahn SJ, Choi SH, Kim YJ, et al. Histogram analysis of apparent diffusion coefficient map of standard and high B-value diffusion MR imaging in head and neck squamous cell carcinoma: a correlation study with histological grade. Acad Radiol, 2012, 19(10): 1233-1240.
[9]Suo ST, Chen XX, Fan Y, et al. Histogram analysis of apparent diffusion coefficient at 3.0 T in urinary bladder lesions: correlation with pathologic findings. Acad Radiol, 2014, 21(8): 1027-1034.
[10]Ma X, Zhao X, Ouyang H, et al. Quantified ADC histogram analysis:a new method for differentiating mass-forming focal pancreatitis from pancreatic cancer. Acta Radiol, 2014, 55(7): 785-792.
[11]Woo S, Cho JY, Kim SY, et al. Histogram analysis of apparent diffusion coefficient map of diffusion-weighted MRI in endometrial cancer: a preliminary correlation study with histological grade. Acta Radiol, 2014, 55(10): 1270-1277.
[12]Cho SH, Kim GC, Jang YJ, et al. Locally advanced rectal cancer:post-chemoradiotherapy ADC histogram analysis for predicting a complete response. Acta Radiol, 2015, 56(9): 1042-1050.
[13]Kang Y, Choi SH, Kim YJ, et al. Gliomas: histogram analysis of apparent diffusion coefficient maps with standard or high-b-value diffusion-weighted MR imaging-correlation with tumor grade.Radiology, 2011, 261(3): 882.
[14]Just N. Improving tumour heterogeneity MRI assessment with histograms. Br J Cancer, 2014, 111(12): 2205-2213.
[15]Ahn SJ, Choi SH, Kim YJ, et al. Histogram analysis of apparent diffusion coefficient map of standard and high B-value diffusion MR imaging in head and neck squamous cell carcinoma: a correlation study with histological grade. Acad Radiol, 2012, 19(10): 1233.
[16]Jin RY, Hong CS, Joon PS, et al. Glioma: application of whole-tumor texture analysis of diffusion-weighted imaging for the evaluation of tumor heterogeneity. PLoS One, 2014, 9(9): e108335.
[17]Zhang YD, Wang Q, Wu CJ, et al. The histogram analysis of diffusion-weighted intravoxel incoherent motion (IVIM) imaging for differentiating the gleason grade of prostate cancer. Eur Radiol, 2015,25(4): 994.
[18]Louis DN, Perry A, Refenberger G, et al. The 2016 World Health Organization classification of tumors of the central nervous system :a summary. Acta Neuropathol, 2016, 131(6): 803-820.
[19]Bai LC, Zhou JL, Xu R, et al. MRI features of intracranial anaplastic hemangiopericytoma. J Pract Radiol, 2012, 28(8): 1186-1188.白亮彩, 周俊林, 徐瑞, 等. 顱內間變型血管周細胞瘤的MR特征.實用放射學雜志, 2012, 28(8): 1186-1188.
[20]Wei XH, Zhou JL, Li WP, et al. Correlation between cystic necrosis of cranio-hemangiopericytoma and the expression of P73. J Chin Clin Med Imaging, 2010, 21(1): 9-12.魏曉輝, 周俊林, 黎衛平, 等. 顱內血管外皮細胞瘤囊變壞死與P73表達相關性的研究. 中國臨床醫學影像雜志, 2010, 21(1): 9-12.
[21]Zhou JL, Zhao JH, He N, et al. Comparison of MRI sign and pathological findings in intracranial hemangiopericytomas and angiomatous type meningioma. J Chin Clin Med Imaging, 2006,17(12): 669-678.周俊林, 趙建洪, 何寧, 等. 顱內血管外皮細胞瘤與血管瘤型腦膜瘤的MRI與病理對照. 中國臨床醫學影像雜志, 2006, 17(12): 669-672.
[22]Li Q, Zhou BJ, He HJ, et al. Application of ADC values in differentiating hemangiopericytomas from meningiomas. J Chin Comput Med Imag, 2015, 21(5): 419-425.李橋, 周碧婧, 何慧瑾, 等. ADC值在鑒別血管外皮細胞瘤與腦膜瘤中的應用. 中國醫學計算機成像雜志, 2015, 21(5): 419-425.
[23]Tang F, Liu H. MRI manifestations of intracranial hemangiopericytoma:comparison study with pathological findings. J Clin Radiol, 2014,33(9): 1438-1441.唐菲, 劉輝. 顱內血管周細胞瘤的MRI表現與病理對照分析. 臨床放射學雜志, 2014, 33(9): 1438-1441.
[24]Shang Z, Li M. Combined feature extraction and selection in texture analysis. International Symposium on Computational Intelligence and Design. IEEE, 2017: 398-401.
[25]Zhang S, Li YL, Huang S. Post contrast-enhanced T1WI histogram analysis for differentiating glioblastom from solitary brain metastasis.Chin J Med Imaging, 2017, 25(2): 89-92.張勝, 李玉林, 黃送. 增強T1WI直方圖在膠質母細胞瘤和腦單發轉移瘤鑒別診斷中的應用. 中國醫學影像學雜志, 2017, 25(2): 89-92.
[26]Xu XQ, Hu H, Su GY, et al. Utility of histogram analysis of ADC maps for differentiating orbital tumors. Diagn Interv Radiol, 2016,22(2): 161.
[27]Liu H, Wang XY, Long XY. Research progress and clinical application of tumor heterogeneity based on CT texture analysis. Int J Med Radiol, 2016, 29(5): 543-548.劉慧, 王小宜, 龍學穎. 基于CT圖像紋理分析腫瘤異質性的研究進展及應用. 國際醫學放射學雜志, 2016, 29(5): 543-548.
[28]Wesseling P, Ruiter DJ, Burger PC. Angiogenesis in brain tumors;pathobiological and clinical aspects. J Neurooncol, 1997,32(3): 253-265.
[29]Bakry A, Elfadil M, Osama F. Characterizations of brain glioma in MRI using image texture analysis. LAP LAMBERT Academic Publishing, 2017.
[30]Lubner MG, Smith AD, Sandrasegaran K, et al. CT texture analysis:definitions, applications, biologic correlates, and challenges.Radiographics, 2017, 37(5): 1483-1503.

