血竭素高氯酸鹽對阿爾茨海默病大鼠學習記憶及海馬TGF-β1通路相關蛋白的影響
張路贏,馬丹霞,楊艾堂,彭會明
0 引言
阿爾茨海默病(Alzheimer disease,AD)是一種常見的中樞性神經系統退行性疾病,是一種由多基因和多因素影響的神經性疾病,但具體的發病機制尚未完全明確[1]。AD患者主要表現為認知功能障礙、語言障礙、記憶障礙和人格改變等,嚴重影響患者的社交和生活質量[2],因此,探究有效治療AD的藥物是神經內科醫生研究的重點。血竭素是從血竭中提取的,其主要有效成分是黃酮類物質[3],具有抗菌消炎、活血生肌、收斂止血的功效[4],近年來研究表明,炎癥反應在AD的發生、發展中起重要作用[5],而且血竭素高氯酸鹽對AD的療效尚未見報道。本研究以阿爾茨海默病模型大鼠為研究對象,探究血竭素高氯酸鹽對模型大鼠學習記憶及海馬轉化生長因子β1(TGF-β1)通路相關蛋白的影響。
1 材料與方法
1.1 材料
1.1.1 實驗動物及飼料 健康雄性SD大鼠70只,SPF級,6~8周齡,體重(150±20)g,購自北京生命科學研究所,許可證號:SYXK(京)2015-0002。
1.1.2 主要材料與儀器 血竭素高氯酸鹽(純度為99.2%)購自中國藥品生物制品檢定所;多奈哌齊(國藥準字H20050978)購自衛材(中國)藥業有限公司;TRIzol reagent購自美國Invitrogen公司;反轉錄試劑盒購自寶生物(大連)有限公司;TaqDNA聚合酶購自英國NEB公司;兔抗鼠Aβ、TGF-β1、SMAD2和p-SMAD2多克隆抗體購自武漢博士德生物工程有限公司;3K15超低溫離心機購自德國Sigma公司;超凈臺購自上海蘇凈實業有限公司;引物序列由深圳華大基因合成。
1.2 方法
1.2.1 阿爾茨海默病動物模型建立 隨機選取10只大鼠作為假手術組,其余大鼠按照文獻資料構建AD模型[6],具體操作如下,將大鼠稱重,腹腔注射4%水合氯醛進行麻醉,頭部剪毛消毒,將大鼠固定于腦立體定位儀上,于頭皮正中切開,剝離右側顱頂骨膜,用顱骨鉆刺一2 mm的骨窗,剝開硬腦膜,用微量注射器向大鼠大腦海馬區注入5 μl Aβ1-42磷酸鹽溶液(注射速度1 μl/min);假手術組以相同方法注射等量磷酸緩沖液,手術后均用牙科水泥固定骨孔處,干燥后縫合頭皮,給大鼠腹腔注射120 000 U/kg,將大鼠回籠飼養48 h(排除手術和麻醉干擾)。
1.2.2 動物分組 將造模成功的大鼠隨機分成5組,每組10只,分別命名為模型組、多奈哌齊組、DP低劑量組、DP中劑量組、DP高劑量組,多奈哌齊組給予0.33 mg/kg多奈哌齊,DP組按低、中、高劑量分別給予10、20、30 mg/kg DP,所有大鼠均行灌胃治療,假手術組及模型組給予等量容積生理鹽水,持續治療4周。
1.2.3 六組大鼠水迷宮(Morris water maze,MWM)實驗 持續治療4周后,采用MWM實驗檢測六組大鼠學習記憶能力:①學習訓練:將大鼠分別從4個象限放入水中,記錄其在2 min內找到平臺的時間(s),連續訓練5 d,保證每只大鼠每天訓練次數相同;②定位航行實驗:在MWM實驗的第5天,將大鼠從某一固定的象限放入水中,記錄其找到平臺的時間(s),即為逃避潛伏時間,超過2 min的即為2 min,連續測試4 d,保證每天大鼠的入水順序不同;③空間探索實驗:定位航行實驗結束后,撤走安全平臺,將大鼠從放置平臺象限的對側放入水中,記錄大鼠2 min內穿越平臺的次數(即為探索次數)。
1.2.4 六組大鼠腦組織分離 按照“1.2.1”項中的方法將大鼠麻醉,酒精消毒后,在無菌的超凈臺剪開大鼠胸腔,暴露心臟,用4%多聚甲醛灌注固定,直至肝臟變白、四肢僵硬,斷頭后剪開頭皮及顱骨,取出全腦,在體視顯微鏡下去除腦膜及血管后,置于-80 ℃冰箱保存備用。
1.2.5 qRT-PCR檢測六組大鼠海馬組織中Aβ mRNA表達水平 取六組大鼠海馬區域組織,用TRIzol reagent提取其總RNA,用反轉錄試劑盒將其反轉成cDNA,操作步驟嚴格按照試劑盒說明書進行。根據Aβ的cDNA序列設計引物,以GAPDH為內參進行qRT-PCR。PCR的反應體系:5×緩沖液10 μl,TaqDNA聚合酶1 μl,上游引物F2 μl,下游引物R 2 μl,10 mmol dNTP mix 1 μl,cDNA 1 μl,ddH2O 33 μl;PCR的反應條件:預變性:95 ℃ 5 min,變性:95 ℃ 30 s,延伸:62 ℃ 15 s,40個循環。采用最大二階導數法(2-△△Ct)對數據進行統計,計算Aβ的相對表達量。
1.2.6 免疫組化染色檢測六組大鼠海馬組織中Aβ的表達水平 取六組大鼠海馬區域組織,用冰凍切片機制作組織切片(不超過5 μm),將組織切片在92~98 ℃條件下存放20 min進行抗原修復,滴加正常山羊血清中和非特異性反應后,在組織玻片上滴加稀釋的兔抗鼠Aβ多克隆抗體,于4 ℃過夜放置,復溫后滴加二抗,于避光條件下室溫孵育1 h,用甘油封片后,于顯微鏡下觀察六組大鼠海馬組織中Aβ的表達情況,并采集照片(400×)。
1.2.7 Western blot檢測海馬組織中TGF-β1、SMAD2和p-SMAD2表達水平 取六組大鼠海馬區域組織,加入2 ml細胞裂解液,提取總蛋白,以GAPDH為內參,進行聚丙烯酰胺凝膠電泳(SDS-PAGE),每孔上樣體積20 μl,電泳結束后,半干轉膜儀轉膜50 min,分別滴加兔抗鼠TGF-β1、SMAD2和p-SMAD2多克隆抗體,置于4 ℃下過夜,滴加二抗后37 ℃放置1 h。加入發光劑顯影,自動凝膠成像系統采集圖像,Gel-Pro analyzer4軟件對SDS-PAGE電泳圖目的條帶進行掃描,分析TGF-β1、SMAD2和p-SMAD2表達水平。
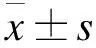
2 結果
2.1 定位航行實驗檢測六組大鼠逃避潛伏時間 與假手術組相比,模型組大鼠逃避潛伏時間明顯延長(P<0.05),提示AD模型制備成功。與模型組相比,多奈哌齊組和DP組大鼠逃避潛伏時間明顯縮短(P<0.05),且隨DP劑量增加,大鼠逃避潛伏時間逐漸縮短,呈劑量依賴性。見表1。
2.2 定位探索實驗檢測六組大鼠穿越平臺的次數 與假手術組相比,模型組大鼠穿越平臺的次數明顯減少(P<0.05)。與模型組相比,多奈哌齊組和DP組大鼠穿越平臺的次數明顯增加(P<0.05),且呈劑量依賴性,結果如圖1所示。
2.3 qRT-PCR檢測海馬組織中Aβ mRNA表達水平 與假手術組相比,模型組大鼠海馬組織中Aβ mRNA的表達水平顯著升高(P<0.05)。與模型組相比,多奈哌齊組和DP組大鼠海馬組織中Aβ mRNA的表達水平顯著降低(P<0.05),且呈劑量依賴性。見圖2。
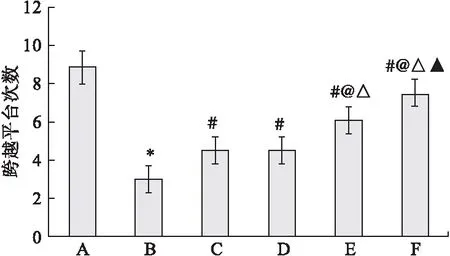
圖1 六組大鼠定位探索實驗穿越平臺的次數
注:A.假手術組,B.模型組,C.多奈哌齊組,D.DP低劑量組,E.DP中劑量組,F.DP高劑量組。與假手術組比較,*P<0.05;與模型組比較,#P<0.05;與多奈哌齊組比較,@P<0.05;與DP低劑量比較,△P<0.05;與DP中劑量組比較,▲P<0.05
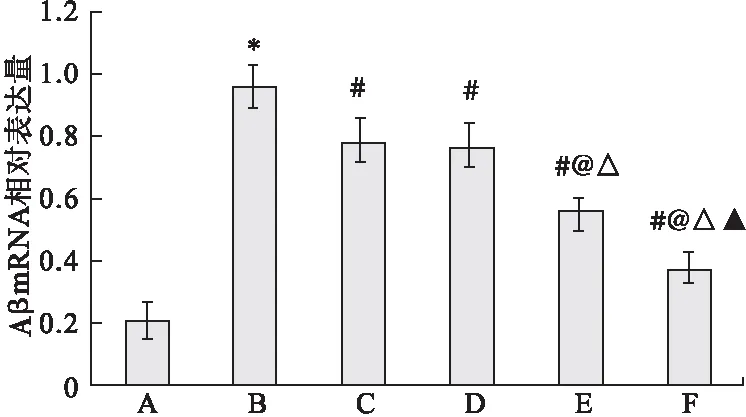
圖2 qRT-PCR檢測海馬組織中Aβ mRNA表達水平
注:A.假手術組,B.模型組,C.多奈哌齊組,D.DP低劑量組,E.DP中劑量組,F.DP高劑量組。與假手術組比較,*P<0.05;與模型組比較,#P<0.05;與多奈哌齊組比較,@P<0.05;與DP低劑量比較,△P<0.05;與DP中劑量組比較,▲P<0.05
2.4 免疫組化染色檢測六組大鼠海馬組織中Aβ的表達水平 與假手術組相比,模型組大鼠海馬組織中Aβ的表達水平升高。與模型組相比,多奈哌齊組和DP組大鼠海馬組織中Aβ的表達水平降低,且隨著DP劑量增加,大鼠海馬組織中Aβ的表達水平逐漸降低見圖3。
2.5 Western blot檢測海馬組織中TGF-β1、SMAD2和p-SMAD2表達水平 與假手術組相比,模型組大鼠海馬組織中TGF-β1的表達水平顯著降低(P<0.05)。與模型組相比,多奈哌齊組和DP組大鼠海馬組織中TGF-β1的表達水平顯著升高(P<0.05),且隨DP劑量增加,大鼠海馬組織中TGF-β1的表達水平逐漸升高,呈現劑量依賴性,見圖4、圖5。
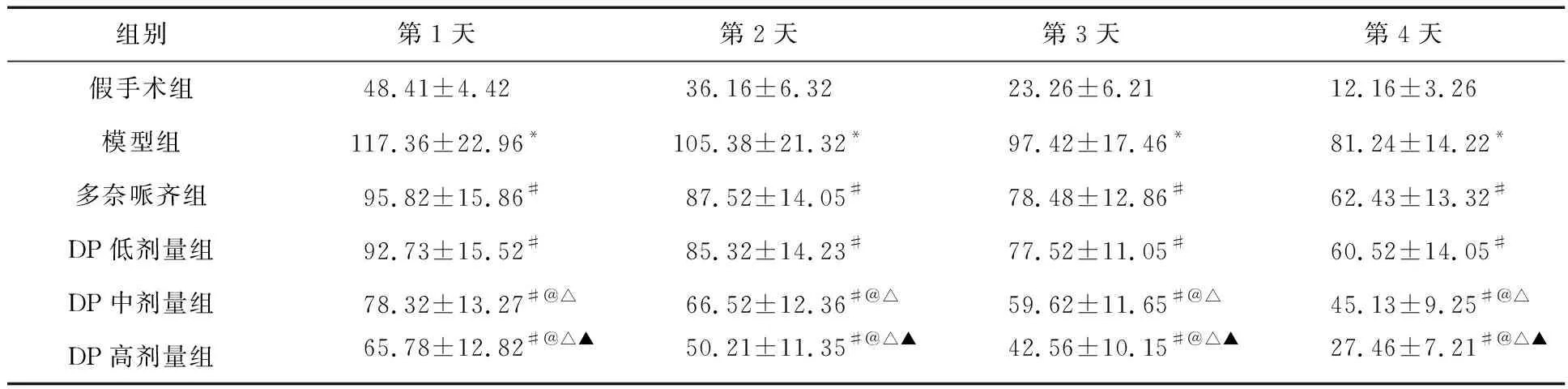
表1 六組大鼠定位航行實驗逃避潛伏時間比較(s)
注:與假手術組比較,*P<0.05;與模型組比較,#P<0.05;與多奈哌齊組比較,@P<0.05;與DP低劑量組比較,△P<0.05;與DP中劑量組比較,▲P<0.05
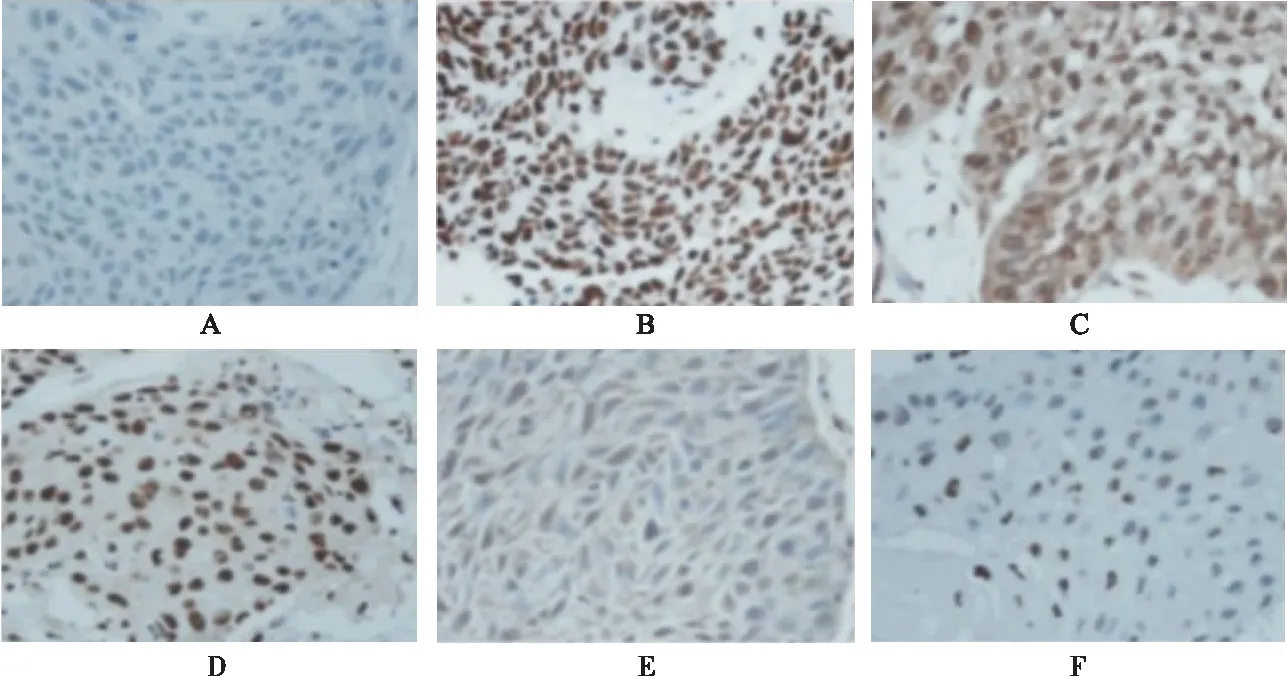
圖3 免疫組化染色檢測六組大鼠海馬組織中Aβ的表達水平(400×)
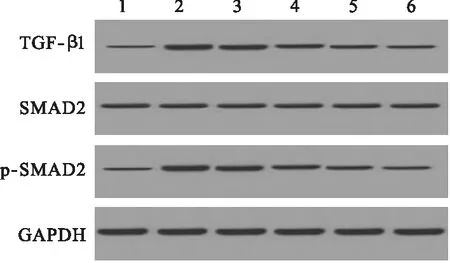
圖4 Western blot檢測海馬組織中TGF-β1、SMAD2和p-
注:1.假手術組,2.模型組,3.多奈哌齊組,4.DP低劑量組,5.DP中劑量組,6.DP高劑量組
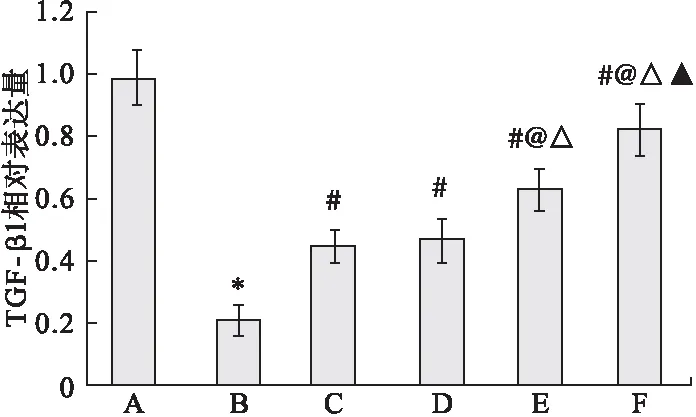
圖5 海馬組織中TGF-β1的相對表達量
注:A.假手術組,B.模型組,C.多奈哌齊組,D.DP低劑量組,E.DP中劑量組,F.DP高劑量組。與假手術組比較,*P<0.05;與模型組比較,#P<0.05;與多奈哌齊組比較,@P<0.05;與DP低劑量比較,△P<0.05;與DP中劑量組比較,▲P<0.05
Western blot檢測結果顯示,各組間SMAD2的表達水平比較差異無統計學意義(P>0.05);與假手術組相比,模型組大鼠海馬組織中p-SMAD2的表達水平顯著升高(P<0.05)。與模型組相比,多奈哌齊組和DP組大鼠海馬組織中p-SMAD2的表達水平顯著降低(P<0.05),且隨DP劑量增加,大鼠海馬組織中p-SMAD2的表達水平逐漸降低,呈現劑量依賴性。見圖4、圖6。
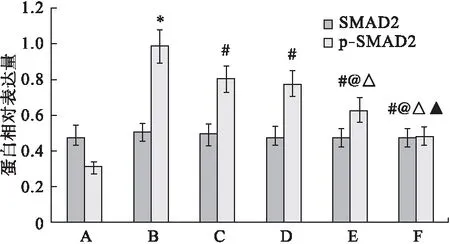
圖6 海馬組織中SMAD2和p-SMAD2的相對表達水平
注:A.假手術組,B.模型組,C.多奈哌齊組,D.DP低劑量組,E.DP中劑量組,F.DP高劑量組。與假手術組比較,*P<0.05;與模型組比較,#P<0.05;與多奈哌齊組比較,@P<0.05;與DP低劑量比較,△P<0.05;與DP中劑量組比較,▲P<0.05
3 討論
中醫學認為,AD屬于老年癡呆的范疇,以細胞外老年斑(SP)、神經細胞內神經纖維纏結(NFT)和神經元丟失為主要的病理改變[7]。大腦皮層和海馬組織中出現大量β-淀粉樣蛋白(Amyloid beta,Aβ)為其直接的致病原因[8],因此,本研究采用向大鼠大腦海馬區注射Aβ1-42磷酸鹽溶液的方法制備AD模型。結果表明,與假手術組相比,模型組大鼠逃避潛伏時間明顯延長、穿越平臺的次數明顯降低,提示AD模型制備成功。
目前,治療AD的藥物主要有扁豆堿、他克林、維吖啶、多奈哌齊和西坦類藥物,這些藥物治療AD有一定療效,但也存在諸多缺點,如藥物安全范圍小、半衰期短,還會引起哮喘、心臟功能障礙、肝功能異常及消化不良等[9]。近年來研究表明,AD的發生、發展與大腦內的慢性炎癥反應密切相關[10]。Pfützner等[11]研究表明,慢性炎癥能夠促進膠質細胞釋放炎性細胞因子IL-6。IL-6能夠刺激神經細胞產生淀粉樣前體蛋白,進而促進AD的發生、發展。DP的主要有效成分是血竭素,血竭素來源于血竭,具有抗菌消炎、活血生肌的功效。袁慶等[12]研究表明,龍血竭能夠抑制小膠質細胞活化,進而抑制小膠質細胞釋放炎性因子,抑制AD的發生、發展。本研究表明,采用DP對AD大鼠模型治療后,與模型組相比,DP組大鼠逃避潛伏時間明顯縮短、穿越平臺的次數明顯增加、大鼠海馬組織中Aβ的表達水平顯著降低,且呈劑量依賴性,結果提示,DP能夠清除海馬組織中Aβ,進而抑制AD的發生、發展。
AD是一種多因素相關的神經性疾病,但具體的發病機制尚未完全明確,有研究表明,TGF-β1通路在神經系統內發揮著重要作用[13-14]。Chen等[15]在AD模型大鼠腦側注射TGF-β1,結果表明,TGF-β1能夠抑制膠質細胞介導的炎癥反應,從而減輕AD模型大鼠神經退行性病。SMAD2是TGF-β1下游的信號分子之一,TGF-β1/SMAD2信號通路能夠將細胞表面的信號傳導到細胞核,進而調節細胞核內個基因的表達。Ueberham等[16]研究表明,SMAD2在大腦和神經的發育過程中發揮著重要作用,而且參與AD的發生、發展過程。Song等[17]研究表明,Dab2能夠靶向作用于小鼠的TGF-β1/SMAD2信號通路,抑制APP/PS1小鼠腦內神經損傷,進而抑制AD的發生、發展過程。SMAD2磷酸化后,無法進入細胞核,導致p-SMAD2在細胞內異常聚集,進而導致神經元纏結。因此,降低SMAD2的磷酸化水平,有助于抑制AD的發生發展。然而DP對TGF-β1和p-SMAD2蛋白的調控尚未見報道。本研究表明,DP能夠上調TGF-β1的表達水平,下調SMAD2的磷酸化水平,進而抑制AD的發生發展,且存在劑量依賴關系。
綜上所述,DP能夠改善AD模型大鼠的學習記憶,推測這一作用是通過調控海馬組織中TGF-β1和p-SMAD2的表達水平實現的,為AD的臨床治療提供一定理論基礎。
參考文獻:
[1] 高雅,王魯寧,張紅紅.APP swe/PS1dE9雙轉基因阿爾茨海默病模型小鼠生物學特征[J].中華老年心腦血管病雜志,2015,17(1):106-108.
[2] 李傳盛,魏文華,沈正榮,等.金屬離子在阿爾茲海默癥發病機制中的作用[J].中國現代應用藥學,2017,34(3):470-474.
[3] 王芳芳,胡琳,王興紅.龍血竭主要黃酮類成分及其DPPH自由基清除活性研究[J].云南民族大學學報:自然科學版,2015,24(3):189-193.
[4] 李凡.龍血素A調控毛囊干細胞增殖分化修復大鼠觸須部皮膚創面的研究[D].廣州中醫藥大學,2016.
[5] 梁躍霞,曹國瓊,張文生.阿爾茨海默癥炎癥反應及中藥干預研究進展[J].中國藥理學通報,2017,33(5):597-602.
[6] O′Hare E,Weldon DT,Mantyh PW,et al.Delayed behavioral effects following intrahippocampal injection of aggregated Aβ(1-42)[J].Brain Res,1999,815(1):1-10.
[7] 狄婷婷,王瑞婷.小膠質細胞與β淀粉樣蛋白致阿爾茨海默病研究進展[J].中國老年學雜志,2015,35(24):7270-7272.
[8] 張海靜,趙春暉,張文生.β淀粉樣蛋白跨血腦屏障轉運機制研究進展[J].中國藥理學通報,2016,32(10):1348-1352.
[9] 劉根.運用數據挖掘方法對益智抗老年性癡呆類方劑核心藥物組合的篩選研究[D].山西中醫學院,2016.
[10]陳漢澤,田力,薛維爽,等.阿爾茨海默病中炎癥反應的研究進展[J].中國臨床神經科學,2017,25(3):342-347.
[11]Pfützner A,Sch?ndorf T,Hanefeld M,et al.High-sensitivity C-reactive protein predicts cardiovascular risk in diabetic and nondiabetic patients:effects of insulin-sensitizing treatment with pioglitazone[J].J Diabetes Sci Technol,2010,4(3):706-716.
[12]袁慶.龍血竭抑制脂多糖誘導小膠質細胞活化的作用研究[D].佳木斯大學,2016.
[13]Pratt BM,McPherson JM.TGF-beta in the central nervous system:potential roles in ischemic injury and neurodegenerative diseases[J].Cytokine Growth Factor Rev,1997,8(4):267-292.
[14]郭艷芹,李校堃.TGF-β與老年性癡呆[J].中華臨床醫學雜志,2005,6(4):50-52.
[15]Chen JH,Ke KF,Lu JH,et al.Protection of TGF-β1 against neuroinflammation and neurodegeneration in Aβ1-42-induced Alzheimer′s disease model rats[J].PLoS One,2015,10(2):e0116549.
[16]Ueberham U,Lange P,Ueberham E,et al.Smad2 isoforms are differentially expressed during mouse brain development and aging[J].Int J Dev Neurosci,2009,27(5):501-510.
[17]Song L,Gu Y,Jie J,et al.Dab2 attenuates brain injury in APP/PS1 mice via targeting transforming growth factor-beta/SMAD signaling[J].Neural Regen Res,2014,9(1):41-50.

