痰熱清對內毒素誘導致急性肺損傷肺微血管通透性的保護作用
肖仲祥,鄭海珍,趙樂萍
(樂清市人民醫院 藥劑科,浙江 樂清 325600)
急性肺損傷(acute lung injury, ALI)是以肺內彌漫性炎癥細胞浸潤、肺組織循環障礙、肺毛細血管通透性增加以及低氧血癥為特征的常見臨床綜合征,可迅速發展為急性呼吸窘迫綜合征(acute respiratory distress syndrome, ARDS)[1]。由于急性肺損傷的高病死率和致病因素的多樣性,一直以來都是研究的熱點與難點。目前臨床上治療急性肺損傷主要依賴于支持性治療,治療手段主要包括采用抗生素、腎上腺皮質激素、機械通氣及吸氧等措施[2],尋找更安全有效的ALI治療和預防藥物是臨床急危重病研究領域急需解決的難題[3]。痰熱清注射液具有清熱、解毒和化痰的功效,是一種純中藥注射液,由黃岑、金銀花、熊膽粉、山羊角、連翹制備而成[4]。本研究采用內毒素建立急性肺損傷模型,通過觀察痰熱清注射液對大鼠肺微血管通透性和肺含水量的變化,分析痰熱清注射液對內毒素所致大鼠肺損傷血管通透性的影響。
1 材料與方法
1.1動物96只成年健康清潔級SD大鼠,雄性,體重250±50 g,由溫州醫科大學動物實驗中心提供。動物實驗前適應性喂養2~3 d,實驗前8 h禁食。
1.2主要試劑與儀器痰熱清注射液(10 mL/支,上海凱寶藥業股份有限公司),甲基潑尼松龍注射液(40 mg/瓶,輝瑞投資有限公司),大腸桿菌內毒素(美國Sigma公司),伊文思藍(evans blue,EB)(美國Sigma公司),甲酰胺(美國Amresco公司),KH-45BA實驗用烤箱(吉首市中誠制藥機械廠),UV-2802H型紫外分光光度計(日本島津公司),AB204-A分析天平(梅特勒-托利多上海儀器公司)。
1.3大鼠ALI模型的制備[5]腹腔注射10 %水合氯醛(5 mL/kg)麻醉大鼠后,經尾靜脈注射內毒素(6 mL/kg),然后禁食12 h,自由飲水。
1.4分組及給藥將96只SD大鼠隨機分為四組:正常對照組、內毒素組、痰熱清組和甲基潑尼松龍組,每組各24只。除正常對照組外,其余各組均建立ALI模型。正常對照組:尾靜脈注射6 mL/kg生理鹽水后腹腔注射10 mL/kg生理鹽水;內毒素組:尾靜脈注射內毒素建模后立即腹腔注射10 mL/kg生理鹽水;痰熱清組:尾靜脈注射內毒素建模后后立即腹腔注射痰熱清注射液2.5 mL/kg;甲基潑尼松龍組:尾靜脈注射內毒素建模后后立即腹腔注射甲基潑尼松龍20 mg/kg。各組加生理鹽水配齊至10 mL/kg進行腹腔注射。每組24只大鼠分別于術后2、6、12 h分批處死,每個時間點各8只,取右肺組織測定肺微血管通透性,左肺組織測定肺含水量。
1.5肺微血管通透性測定15 mg/mL EB在各時間點前20 min經舌下靜脈注射(50 mg/kg),注射EB后15min由頸動脈處放血處死動物,打開胸腔并經左心室灌注300 mL生理鹽水將血液及器官中殘存的EB沖出。然后取肺組織,定位稱取右下肺葉組織0.1~0.3 g,剪去周圍組織后放入甲酰胺內(甲酰胺的用量按照組織重量給予,1 mL/100 mg),置37℃溫箱中溫育72 h,待肺組織中的色素全部浸出以后取出,4 000 r/min離心5 min后取上清液,采用分光光度計選擇波長為620 nm進行比色,根據標準曲線計算組織中EB含量,EB含量越高代表肺微血管通透性越大。
1.6肺含水量檢測在各時間點處死大鼠后,準確稱量整個左肺組織的濕重,放入90 ℃烤箱中72 h后稱量干重,計算含水量。肺組織含水量(%)=(濕重-干重)濕重×100%。
1.7統計學分析應用SPSS19.0統計軟件處理數據,多組間比較采用單因素方差分析,兩兩比較采用SNK-q檢驗,P<0.05為差異有統計學意義。
2 結果
2.1肺微血管通透性的改變建立大鼠ALI模型后,經內毒素處理的各組肺微血管通透性增加,6 h時達到峰值。內毒素組、痰熱清組、甲基潑尼松龍組各時間點的EB含量均高于正常對照組,差異有統計學意義(P<0.05);痰熱清組和甲基潑尼松龍組各時間點的EB含量均低于內毒素組,差異有統計學意義(P<0.05);2 h時,痰熱清組與甲基潑尼松龍組比較,EB含量差異有統計學意義(P<0.05),見表1。
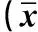
表1 各組大鼠伊文思藍含量比較±s, mg/L)
注:*與正常組比較,△與內毒素組比較,▲與甲基潑尼龍組比較,均P<0.05;下同。
2.2肺含水量變化建立大鼠ALI模型后,經內毒素處理的各組肺含水量增加,6 h時達到峰值。內毒素組、痰熱清組、甲基潑尼松龍組各時間點的肺含水量均高于正常對照組,差異有統計學意義(P<0.05);痰熱清組和甲基潑尼松龍組各時間點的肺含水量均低于內毒素組,差異有統計學意義(P<0.05);2 h時,痰熱清組與甲基潑尼松龍組比較肺含水量差異有統計學意義(P<0.05),見表2。
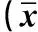
表2 各組大鼠肺含水量比較±s, %)
3 討論
由于革蘭氏陰性菌感染的敗血癥患者越來越多,敗血癥導致的ALI日益成為臨床醫生關注的焦點[6]。革蘭陰性菌細胞壁主要成分是內毒素,研究證實[7],動物靜脈輸注內毒素可復制ALI模型,內毒素作用于肺泡毛細血管膜引起肺損傷,造成肺毛細血管通透性增加,肺臟內血管與組織之間液體交換功能紊亂,使肺間質和肺泡內聚積大量水分甚至蛋白質,導致肺含水量增加,液體在肺臟內潴留和氣體交換發生障礙,肺順應性下降,通氣/血流比例失調,導致低氧血癥,最終發展成為呼吸衰竭。肺血管的通透性改變是ALI病理生理變化的基礎,有效預防和控制肺微血管通透性的改變對ALI患者的治療非常重要。
痰熱清注射液是我國研制的二類新藥,具有獨家知識產權,是采用中藥指紋圖譜檢測標準生產的中藥注射液,由中藥材黃芩、山羊角、熊膽粉、連翹、金銀花等提取精制而成[8]。黃芩具有抗病毒、抗炎、降壓、鎮靜和解熱的功效;山羊角、熊膽粉具有清熱解毒、平肝息風、化痰解痙的作用;金銀花、連翹具有清熱解毒、宣肺化痰、疏風散結的功效。諸藥配伍,可增強清熱解毒、化痰止咳、鎮驚安神的作用,通過注射途徑給藥,可以達到高效、速效的治療效果[9]。痰熱清注射液目前已被廣泛應用于臨床,研究表明[10],痰熱清能有效改善血液循環、清除體內自由基、提高血氧飽和度,減輕喘憋癥狀,加速炎癥的吸收,但尚未見有關痰熱清對肺損傷肺微血管通透性影響的研究。
本研究以內毒素建立大鼠ALI模型,模擬臨床急性肺損傷的發展進程,建模的同時注射痰熱清,觀察痰熱清對肺損傷大鼠肺微血管通透性的影響。本研究結果顯示,大鼠經內毒素建模后肺含水量和EB含量增加較快,6 h時達到最高,與文獻報道相一致[11],表明大鼠肺損傷后6 h時肺通透性增加最多,隨后的肺通透性下降可能與肺損傷后大鼠的自身免疫恢復有一定關系。注入痰熱清和甲基潑尼松龍后2、6、12 h,急性肺損傷大鼠的肺含水量和EB含量明顯低于內毒素組而高于正常對照組,表明痰熱清和甲基潑尼松龍均可降低內毒素所致的急性肺損傷大鼠的肺微血管通透性。2 h時,甲基潑尼松龍組的肺微血管通透性小于痰熱清組,其余時間點無差異,可能與甲基潑尼松龍的起效時間比痰熱清快有關,痰熱清屬中藥注射液,半衰期相對較長,而隨著痰熱清的逐漸起效,其保護肺損傷肺微血管通透性的作用與甲基潑尼松龍相當。
綜上所述,痰熱清注射液可降低內毒素誘導的大鼠急性肺損傷肺微血管通透性和肺含水量,對內毒素所致的急性肺損傷有保護作用。

