無機化學工藝流程中物質的轉換試題剖析
江蘇 王建華
化學工藝流程題是將化工生產中的生產流程用框圖形式表示出來,并根據生產流程中有關的化學知識步步設問。它以現代工業生產為基礎,與化工生產成本、產品提純、環境保護等相融合,考查物質的制備、檢驗、分離提純等基本實驗原理在化工生產中的實際應用,要求考生依據流程圖分析原理,緊扣信息,抓住關鍵,準確答題。這類試題具有較強的實用性和綜合性,是近幾年高考化學命題的常考和熱點題型,所占的分值比重大,區分度也很好。下面就無機化學工藝流程中物質的轉換試題略加剖析。
一、無機化學工藝流程特點及解題思維
無機化學工藝流程大致流程如下:

此類題目多以金屬礦物加工為載體,綜合考查物質間的轉換、化學反應原理、實驗操作等,難度較大,綜合性強。解此類題型的一般思維過程:
1.粗讀題,得目的,標記有用信息
將題目從頭到尾粗讀一遍,初步了解大意。由于題頭一般是簡單介紹該工藝生產的原材料和工藝生產的目的(包括副產品),以及提供一些教材上未出現過但題中必須用到的信息。因此要求先養成良好的做題習慣,閱讀題干時要隨手畫出目的及相關信息。
2.看箭頭,析過程
箭頭打進的是反應物,打出的是生成物,有進又有出的是可循環利用的物質。
3.細分析,看控制,找分離
分析流程圖中的原料與產品,找出兩者的關系,結合問題思考:原料轉化為產品的過程中都發生了什么反應,每一步得出什么產物,都標在相應的步驟中。物質制備工業都涉及物質的分離提純,注意制備過程中所需的原料、條件的控制(如溶液pH與沉淀、溶度積常數與沉淀等)以及物質分離方法的選擇(如過濾、萃取分液、蒸餾等)。若出現工業評價問題,從成本、環保、現實等角度考慮分析即可。
二、以教材為藍本,熟悉設計
以鋁土礦(主要成分為Al2O3,含SiO2和Fe2O3等雜質)為原料制備鋁的工藝流程:
流程一(酸溶1):

分析過程:鋁土礦(Al2O3、SiO2、Fe2O3),經鹽酸反應后所得物(Al3+、Fe3+、SiO2),濾渣1是SiO2,經過量氫氧化鈉溶液反應后所得物[AlO2-、OH-、Fe(OH)3],濾渣2是 Fe(OH)3,濾液經通入CO2反應后所得物[Al(OH)3、NaHCO3],濾液3是NaHCO3,濾渣是Al(OH)3,經灼燒后得到Al2O3,經電解后得Al。
流程二(酸溶2):

部分金屬離子在實驗條件下開始沉淀和完全沉淀的pH如下表。

金屬離子Fe3+Al3+開始沉淀時pH1.93.3沉淀完全時pH3.25.2
分析過程:鋁土礦(Al2O3、SiO2、Fe2O3),經鹽酸反應后所得物(Al3+、Fe3+、SiO2),濾渣1是SiO2,結合表格信息,經調節pH后所得物[Al3+、Fe(OH)3],濾渣2是Fe(OH)3,濾液3是Al3+,經加入氨水后所得物[Al(OH)3、NH4Cl],濾液是NH4Cl,濾渣是Al(OH)3,經灼燒后得Al2O3,經電解后得Al。
流程三(堿溶):

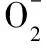
三、典型例題
(2016全國Ⅲ)以硅藻土為載體的五氧化二釩(V2O5)是接觸法生產硫酸的催化劑。從廢釩催化劑中回收V2O5既避免污染環境又有利于資源綜合利用。廢釩催化劑的主要成分見下表。

物質V2O5V2O4K2SO4SiO2Fe2O3Al2O3質量分數/%2.2~2.92.8~3.122~2860~651~2<1
以下是一種廢釩催化劑回收工藝路線:

回答下列問題:



(5)“流出液”中陽離子最多的是________。
(6)“沉釩”得到偏釩酸銨(NH4VO3)沉淀,寫出“煅燒”中發生反應的化學方程式:_______________________________________。


(2)0.5 (3)Fe(OH)3、Al(OH)3(4)堿 (5)K+


