重組子宮內膜抗原制備及其在蛋白芯片檢測中的應用
王明珠,羅莉,蔡祥勝
(1.西安市第四醫院生殖醫學中心,西安 710004;2.廣東藥科大學第一附屬醫院,廣州 510080)
抗子宮內膜抗體(EMAb)是造成女性不孕的常見原因[1]。正常位置的子宮內膜對機體無抗原性,但異常位置的子宮內膜可以作為抗原激活機體的免疫系統[2],常見于子宮內膜異位癥患者。其產生的條件與異位內膜刺激以及免疫失調等因素相關,另外和生殖道的炎癥反應等因素也相關[3]。抗子宮內膜抗體會引發子宮內膜產生抗原抗體免疫反應,在子宮內產生局部免疫反應,刺激機體的補體系統,導致子宮內膜發生病理性損傷[4]。破壞子宮內膜結構,影響內膜發育和內分泌功能[5]。子宮中營養胚胎的糖原水平降低,免疫復合物的水平升高,導致受精卵的著床失敗以及胚胎發育不良,從而引起不孕或流產[6-7]。抗子宮內膜抗體針對的抗原為孕激素依賴蛋白(PAEP)、S100P和Nidogen-1等蛋白[8-9]。目前臨床檢測EMAb主要采用酶聯免疫法吸附(ELISA)方法。ELISA影響因素多,不能確定抗體結合部位。子宮內膜抗原需從組織勻漿中提取,不僅組織來源困難而且也難于分離到高純度的蛋白。另外抗原成分復雜,特異性差,檢測批間差異較大。本研究通過生物信息學方法設計一種由多個蛋白的抗原表位組成的重組多表位子宮內膜抗原,使用原核分泌表達系統進行表達[10-12],并將其應用于蛋白芯片檢測抗子宮內膜抗體。
材料與方法
一、實驗材料
1.大腸桿菌DH5α(dlacZDeltaM15DeltalacZYA-argFU169recA1endA1hsdR17(rK-mK+)supE44thi-1gyrA96relA1)用于重組質粒擴增。大腸桿菌YK537 (supE44hsdRhadMrecA1phoA8leuB6thilacYrpsL20galK2ara-14xyl-5mlt-1) 用于目的蛋白表達。PhoA質粒用于構建表達載體。菌株與質粒均為廣東藥科大學第一附屬醫院檢驗科贈與。
2.血清樣本:選取2015年1月至2017年8月在西安市第四醫院生殖醫學中心因不孕就診的71例患者,收集血清。患者年齡23~39歲,平均年齡(31.6±2.3)歲;排除因生殖器官病變以及病毒感染引起的不孕癥患者。
二、主要試劑和儀器
內切酶NheI和BamHI、質粒提取試劑盒(大連寶生物),Ni-NTA His-Bind Resin親和層析柱(Merck,德國),Biodot-AD1510點樣儀(BioDot,美國),酶標儀(Thermo,美國)。
三、實驗方法
1.目的基因合成和表達載體構建:使用DNASTAR軟件于子宮內膜相關的PAEP、S100P和Nidogen-1序列分析抗原表位,設計新的人重組子宮內膜(rhEM)多肽抗原序列,在不改變氨基酸序列的條件下,合成重組子宮內膜抗原序列質粒pGEM-T-EM和引物模版(上海生工生物)。引物序列以pGEM-T-EM為模版擴增目的片段,引物序列為:rhEM-F:5′-GGTGGTGCTAGCGCTCAGAAGGGTAAACGTAACACCTTCC-3′,rhEM-R:5′-GGTGGTGGATCCGGTTTTGGTTTTAGAGTCTTTTTGG-3′。PCR產物和載體pGEM-T經過酶切連接并進行擴增,隨后酶切鑒定。目的片段和PhoA分別用NheI和BamHI酶切后連接,膠純化后連接轉化感受態細胞,于含氨芐青霉素LB平板中培養,挑克隆于5 ml LB培養基中擴大培養后,提質粒酶切鑒定,將陽性克隆送測序(圖1)。
2.rhEM蛋白在YK537中表達:挑取PhoA-EM/YK537單菌落于5 ml LB培養基37℃,振搖培養過夜。收集菌并轉移到低磷培養基[低磷培養基為每100 ml培養基中含蛋白胨1 g,酵母浸膏0.25 g,MgSO4·7 H2O 0.05 g,1 mol/L Tris-Cl(pH 8.0)5 ml,苯酚紅0.2 ml,葡萄糖1 g]培養10 h后,離心收集沉淀,然后重懸至1 000 ml TSE溶液中(20 mmol/L Tris-Hcl,pH 7.0,20%葡萄糖,1 mmol/L EDTA)。冰浴30 min后,5 000 rpm離心,收集沉淀并棄去上清。之后將沉淀重懸至1 000 ml的TE溶液中(20 mmol/L Tris-Hcl,pH 7.0,1 mmol/L EDTA),收集上清保存于-20℃準備下一步純化。
3.rhEM抗原蛋白分離與純化:將收集的上清通過Ni-NTA His-Bind Resin進行親和層析柱純化。蛋白稀釋于含0.2 mol/L NaCl的20 mmol/L Tris-HCl(pH 8.0)中并進行SDS-PAGE分析。
4.rhEM抗原蛋白的聚丙烯酰胺凝膠電泳(SDS-PAGE),免疫印記和高效液相色譜法(HLPC)分析鑒定:純化后的重組EM抗原蛋白通過12% SDS-PAGE電泳和免疫印記(Western blot)鑒定。按照Bio-rad電轉儀操作方法進行,首先剪硝酸纖維膜(PVDF膜)適當大小,泡甲醇20 min,然后同濾紙及海綿墊一起泡在轉移緩沖液中。按照黑板-海綿墊-3層濾紙-PAGE膠-PVDF膜-3層濾紙-海綿墊-白板的順序,將膠固定好,黑板對著轉移槽的黑板,黑板一邊放置冰盒,將轉移槽放在冰浴中200 mA,轉膜90 min后,將PVDF膜取出用0.01 M PBS漂洗,加5%脫脂奶粉封閉2 h。然后將1∶100封閉液稀釋的羊抗人的6His單抗點到PVDF膜上,4℃濕盒中孵育過夜。第二日,取出PVDF膜用PBS洗膜10 min,洗2次。室溫下與結合有辣根過氧化物酶(HRP)的兔抗羊的二抗(1∶200)孵育90 min。用含0.05% Tween 20的PBST洗膜10 min,洗2次,再用PBS洗膜10 min。將PVDF膜在二氨基聯苯胺(DAB)顯色液中顯色,至印記帶出現后,用H2O終止顯色。按廠家操作說明步驟對目的蛋白進行HPLC鑒定(貝克曼,美國)。
5.蛋白芯片檢測方法的建立以及臨床應用:采用棋盤法(0.3 mol/L包被緩沖、0.2% 甘油、0.01% Triton X-100和1.5%甘露醇)確定包被芯片的EM抗原濃度。此外,通過2倍連續稀釋法優化所需血清濃度。采用Biodot-AD1510點樣儀將EM抗原稀釋液點樣到蛋白芯片上。蛋白質芯片檢測過程如下:室溫下PBS緩沖液沖洗芯片5 min,用紙巾拍干芯片,添加75 μl 10倍稀釋的血樣到每個孔,置于恒溫搖床(37℃,150 r)孵育30 min。接下來,加入75 μl 結合HRP的單抗,將芯片放入搖床(37℃,150 rpm)振搖30 min。將芯片取出用PBST沖洗。晾干芯片。采用市售常用抗子宮內膜抗體ELISA檢測試劑盒(廣州康遂生物)并根據產品操作說明檢測抗子宮內膜抗體。用蛋白芯片和ELISA方法檢測了71份不孕癥患者血清標本。
結 果
一、rhEM蛋白原核表達系統的建立
重組EM的基因序列位置于phoA質粒中堿性磷酸酶信號序列下游,通過phoA中堿性磷酸酶啟動子就可以控制蛋白的表達。多抗原表位的重組蛋白EM序列與表達質粒連接后成功轉入表達載體YK537。rhEM蛋白片段約500 bp(圖2)。
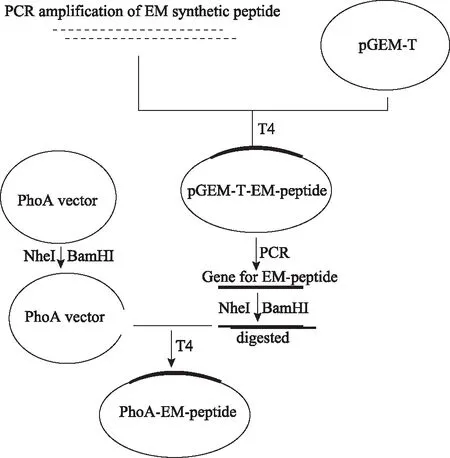
圖1 phoA載體和rhEM的構建示意圖
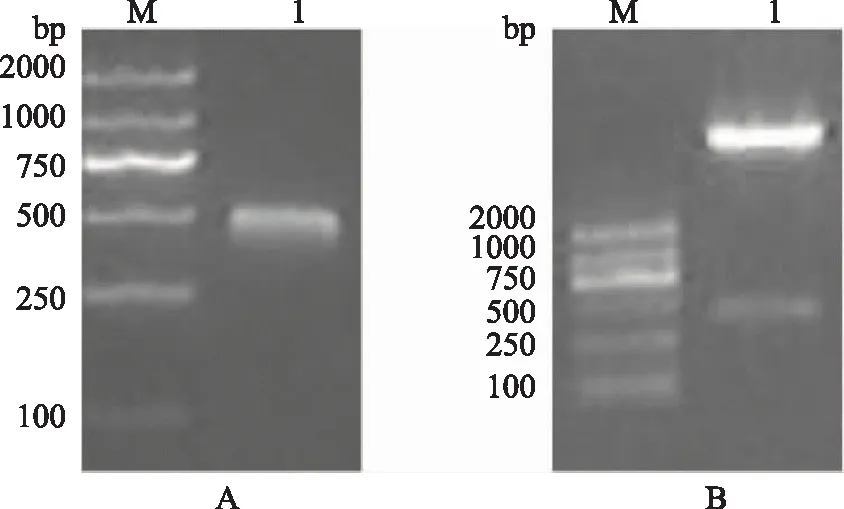
A.rhEM的PCR鑒定電泳圖,M:marker,1:rhEM蛋白的基因片段,大小約500bp;B.雙酶切鑒定電泳圖,M:marker,1:phoA和rhEM的雙酶切產物圖2 PCR和酶切鑒定rhEM基因和phoA載體
二、rhEM蛋白的表達和純化
rhEM蛋白的重組通過宿主菌YK537分泌表達。攜帶phoA質粒的宿主菌株在30 L發酵罐中培養12 h,將質粒重組EM蛋白分泌到周質腔。18 h后,重組蛋白約占總蛋白的20%(圖3A)。達到最大生產重組EM抗原20 mg/L的產量。
通過TSE溶液抽提后,接著使用Ni-NTA His-Bind樹脂純化rhEM抗原蛋白。大多數rhEM蛋白緊密結合的Ni-NTA His-Bind樹脂。0.4 mol/L咪唑洗脫含有大部分rhEM蛋白,純度約為90%。將0.4 M咪唑溶液洗脫的液體混合,超濾濃縮后,進一步使用分子篩層析柱進行分離(圖3B)。在SDS-聚丙烯酰胺凝膠電泳和高效液相色譜分析中顯示,rhEM蛋白純度均達到95%以上(圖3C、D)。免疫印跡法確定了一條強染色條帶為rhEM蛋白(圖3E)。
三、蛋白質芯片和ELISA兩種方法檢測抗子宮內膜抗體
分別用市售常用檢測抗子宮內膜抗體ELISA檢測試劑盒和本研究的蛋白質芯片檢測71例不明原因不孕患者。酶聯免疫吸附試驗檢測到陽性樣本21份,50份樣本呈陰性。蛋白質芯片鑒定陽性23份,陰性品48份(圖4)。ELISA試劑盒與蛋白芯片檢測結果的符合率為96.2%,陽性符合率為91%,陰性符合率為96%。用蛋白芯片法檢出陽性血清23份(陽性率為32%);ELISA檢出9份陽性血清(陽性率為30%)(表1)。總的來說,比較兩種方法,分別用受試者工作特征曲線(ROC曲線)分析評價,受試者工作曲線下面積(AUC)分別為蛋白質芯片的0.89和ELISA的0.96(圖5),表明蛋白芯片的檢測性能與ELISA法檢測不孕不育患者的相似。

A.rhEM蛋白在YK537中表達的SDS-PAGE電泳圖。M:Marker,1:未攜帶質粒的YK537,2:在發酵罐中培養12h,3:誘導蛋白表達前,4:誘導蛋白表達后;B.親和層析后SDS-PAGE電泳圖,1:周質腔抽提,2、3:鎳柱親和層析;C.分子篩層析后SDS-PAGE電泳結果;D.高效液相色譜結果;E.Western blot結果圖3 重組子宮內膜抗原的表達與純化

A.抗子宮內膜抗體陰性結果;B.抗子宮內膜抗體陽性結果圖4 蛋白芯片檢測結果

ELISA蛋白芯片+-總數+ 15823- 64248總數 215071
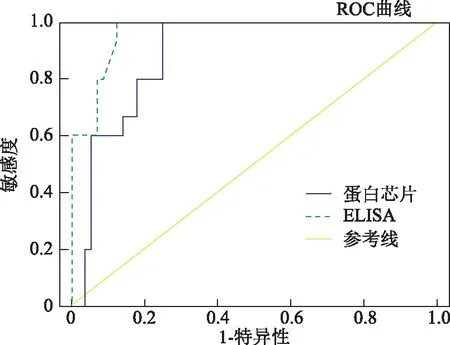
曲線下面積分別為蛋白芯片0.89,ELISA 0.96圖5 受試者工作曲線(ROC曲線)
討 論
對于免疫不孕患者,不育相關抗體的檢測越來越受到臨床的重視[13]。抗子宮內膜抗體的產生會導致受精卵的著床失敗以及胚胎發育不佳,進而引起不孕或者流產[14]。檢測抗子宮內膜抗體對于診斷和治療有重要意義。目前文獻所報道的不育抗體陽性率差別很大,其中一個重要原因是現在所采用的子宮內膜抗原制備方法仍比較粗糙,常用子宮內膜組織研磨后提取蛋白作為抗原成分制備檢測試劑盒。導致各實驗室檢測結果一致性較差。本研究使用的重組子宮內膜抗原,通過大腸桿菌分泌表達,抗原蛋白純度高,能減少天然提取時無法避免的干擾,以重組子宮內膜抗原蛋白制備的蛋白芯片使不同批次間檢測結果的差異最小化,結果更為可信。
大腸桿菌表達蛋白由于其簡便易行和低成本的優點已經成為常用的生物工程技術,而蛋白表達的關鍵在于保持其生物活性[15]。一般情況下,蛋白是以可溶還是包涵體形式存在,都表達于胞漿內,必須經過超聲波破碎菌體后才能使蛋白釋放出來,不但對蛋白本身有破壞作用,而且也增加了純化的難度與成本[16]。在本研究中使用信號肽使重組子宮內膜蛋白分泌到大腸桿菌周質腔,優點在于使蛋白處于有利于二硫鍵形成和提高可溶性的環境,且不需要破菌提純,大大簡化提純步驟并提高產量。為抗體檢測的標準化提供了基礎。再加上蛋白芯片檢測技術高通量,高靈敏,所需上樣量小等特點,將會給不孕抗體的檢測提供更多技術選擇[17]。
目前,仍缺少檢測不孕相關抗體的金標準。本研究利用蛋白芯片檢測結果與市售常用的ELISA比較,結果顯示蛋白芯片和ELISA檢測不孕癥患者抗子宮內膜抗體基本符合。盡管如此,我們還需要進行更深入的研究,通過不斷地優化抗原和改進工藝,實現對抗子宮內膜抗體的準確診斷。

