不同熱加工方式對(duì)核桃蛋白致敏性的影響
姜松松,趙 博,韓詩(shī)雯,車會(huì)蓮
(北京食品營(yíng)養(yǎng)與人類健康高精尖創(chuàng)新中心,中國(guó)農(nóng)業(yè)大學(xué)食品科學(xué)與營(yíng)養(yǎng)工程學(xué)院,北京 100083)
食物過(guò)敏已經(jīng)成為一個(gè)世界范圍內(nèi)嚴(yán)重的公共衛(wèi)生問(wèn)題,嚴(yán)重影響人們的生活質(zhì)量。有研究指出,超過(guò)90%的食物過(guò)敏都是由小麥、花生、大豆、堅(jiān)果類、牛奶、雞蛋、魚(yú)和甲殼類這8 類食物引起的[1],其中核桃引起的過(guò)敏是一種嚴(yán)重的堅(jiān)果過(guò)敏,常常伴隨著嚴(yán)重的臨床癥狀,甚至導(dǎo)致休克和死亡[2-3]。目前,不少研究證實(shí),核桃過(guò)敏主要是免疫球蛋白(immunoglobulin,Ig)E介導(dǎo)的速發(fā)型過(guò)敏反應(yīng)[4-6],而利用核桃過(guò)敏患者血清發(fā)現(xiàn)的核桃過(guò)敏原包括Jug r 1、Jug r 2、Jug r 3、Jug r 4[7-9],其中Jug r 1可以被80%以上的核桃過(guò)敏患者血清所識(shí)別,被認(rèn)為是核桃中的主要過(guò)敏原蛋白[10]。
通過(guò)不同的加工方式能夠改善食物的功能、營(yíng)養(yǎng)、感官等性質(zhì),在加工過(guò)程中,食物蛋白的物理特性和化學(xué)結(jié)構(gòu)常常會(huì)發(fā)生變化。此前有研究發(fā)現(xiàn),將魚(yú)煮熟后食用能夠引發(fā)過(guò)敏反應(yīng),而生魚(yú)不能[11],這引起了人們對(duì)加工能否影響食物蛋白致敏性的關(guān)注。有研究發(fā)現(xiàn),對(duì)牛奶中β-乳球蛋白進(jìn)行加熱處理可顯著降低其致敏性[12];Alvarez-Alvarez等[13]發(fā)現(xiàn),高壓處理羽扇豆能夠通過(guò)降低其IgE結(jié)合能力來(lái)降低其致敏性;而Maleki等[14]發(fā)現(xiàn),烤花生可以增強(qiáng)其IgE結(jié)合能力,從而增強(qiáng)其致敏性。這些研究結(jié)果提示不同的加工方式對(duì)不同蛋白的致敏性影響不同,這主要是因?yàn)椴煌募庸し绞綄?duì)食物蛋白結(jié)構(gòu)等性質(zhì)的影響不同。大多數(shù)的物理過(guò)程(加熱、加壓、輻射和超聲)主要通過(guò)改變食物蛋白的二級(jí)和三級(jí)結(jié)構(gòu)來(lái)影響構(gòu)象表位(破壞、掩蓋、暴露),而生物化學(xué)加工方式一般通過(guò)酸水解、酶水解或者劇烈的美拉德反應(yīng)來(lái)改變食物蛋白的線性表位從而影響食物蛋白致敏性。Cabanillas等[15]發(fā)現(xiàn)核桃蛋白經(jīng)高壓處理后Jug r 4的IgE結(jié)合能力顯著降低,提示高壓處理能夠有效降低核桃蛋白抗原性。但其他一些常用的加工方式對(duì)核桃蛋白致敏性的影響仍缺少相關(guān)研究。
熱處理是食品中應(yīng)用最普遍的加工技術(shù),能夠通過(guò)改變分子內(nèi)、分子間的共價(jià)鍵或非共價(jià)鍵的相互作用,破壞二級(jí)結(jié)構(gòu)和三級(jí)結(jié)構(gòu),影響構(gòu)象表位,改變食物蛋白致敏性。本研究首先對(duì)核桃蛋白進(jìn)行粗提取,然后分別對(duì)其進(jìn)行煮沸、烘烤、高溫高壓以及微波等不同的熱處理,通過(guò)對(duì)核桃蛋白可提取質(zhì)量濃度、核桃過(guò)敏患者血清IgE結(jié)合能力及兔多克隆抗體IgG結(jié)合能力的變化,分析不同熱處理方式對(duì)核桃蛋白抗原性、致敏性的影響,旨在探索能夠有效降低核桃蛋白致敏性的熱處理方法,從而為研發(fā)低致敏性或無(wú)致敏性核桃制品提供科學(xué)依據(jù),保障核桃過(guò)敏患者的安全。
1 材料與方法
1.1 材料與試劑
本實(shí)驗(yàn)所用血清來(lái)自于6 個(gè)對(duì)核桃過(guò)敏的患者,篩選條件為:具有攝食核桃之后發(fā)生系統(tǒng)過(guò)敏反應(yīng)的病史,或者在醫(yī)院進(jìn)行皮膚點(diǎn)刺實(shí)驗(yàn)對(duì)核桃產(chǎn)生陽(yáng)性反應(yīng)。過(guò)敏原特異性IgE抗體篩查定量檢測(cè)顯示其血清中核桃特異性IgE水平在0.6~2.7 kU/L之間。采用兩個(gè)對(duì)雞蛋過(guò)敏而非核桃過(guò)敏的受試者血清樣本作為對(duì)照組,本研究獲得中國(guó)農(nóng)業(yè)大學(xué)人體研究倫理委員會(huì)批準(zhǔn)(批準(zhǔn)號(hào):0312150129),均取得血清提供者的知情同意。
核桃(Juglans regia)產(chǎn)自中國(guó)天津薊縣。二辛可酸(bicinchoninic acid,BCA)蛋白定量試劑盒美國(guó)Novagen公司;辣根過(guò)氧化物酶(horseradish peroxidase,HRP)標(biāo)記羊抗兔IgG抗體 美國(guó)Cell Signaling Technology公司;牛血清白蛋白(bovine serum albumin,BSA) 美國(guó)Sigma公司;四甲基聯(lián)苯胺顯色液美國(guó)Promega公司;乙二胺四乙酸 北京藍(lán)弋公司。
1.2 儀器與設(shè)備
5804 R型低溫高速離心機(jī) 德國(guó)Eppendoff公司;多功能旋轉(zhuǎn)搖床 海門市其林貝爾儀器制造有限公司;DYY-6C-電泳儀 北京六一儀器廠;電轉(zhuǎn)儀 美國(guó)Bio-Rad公司;GelDoc-ItTM影像系統(tǒng) 美國(guó)UVP公司;Varloskan Flash多功能酶標(biāo)儀 美國(guó)Thermo Scientific公司;MSL-3750高壓滅菌鍋 日本Sanyo公司。
1.3 方法
1.3.1 核桃蛋白粗提取及熱處理
去除核桃外硬殼并去皮,液氮研磨成細(xì)粉末。稱取l0 g所得核桃粉,加入100 mL正己烷溶液,于4 ℃磁力攪拌脫脂2 h,然后于4 ℃ 8 000×g離心30 min,棄上清液,將所得沉淀再重復(fù)脫脂1 次,置于通風(fēng)櫥內(nèi)晾干備用。
對(duì)上述獲得的核桃蛋白粗提取物進(jìn)行不同方式的熱處理,包括濕熱、干熱、高溫高壓、微波加熱[16],詳見(jiàn)表1。處理后樣品分別使用磷酸鹽緩沖液(phosphate buffer saline,PBS)溶解(1∶20,m/V),4 ℃攪拌過(guò)夜,將溶液10 000×g離心20 min,取上清液使用BCA蛋白定量試劑盒進(jìn)行蛋白質(zhì)量濃度測(cè)定。

表1 不同熱處理方式Table1 Description of treatments applied to walnut powders
1.3.2 Jug r 1多克隆抗體制備
使用凝膠過(guò)濾層析以及陰離子交換層析的方法[17]純化出核桃致敏蛋白Jug r 1。以此作為抗原,制備多克隆抗體[18]:基礎(chǔ)免疫以500 μg Jug r 1抗原溶于2 mL弗氏完全佐劑中,使之充分乳化,皮下多點(diǎn)注射新西蘭家兔。加強(qiáng)免疫時(shí)用弗氏不完全佐劑,抗原劑量為首次的1/2。每2~3 周加強(qiáng)免疫1 次。在每次加強(qiáng)免疫之后1 周,從耳緣靜脈取血2~3 mL,分離血清,用酶聯(lián)免疫吸附測(cè)定(enzyme linked immunosorbent assay,ELISA)方法檢測(cè)抗體效價(jià),直至抗體效價(jià)在1∶10 000以上。大量采血,室溫凝固后4 ℃冷藏4 h,離心分離血清,使用正辛酸-硫酸銨兩步沉淀法純化多克隆抗體,-20 ℃冷凍保存。
1.3.3 SDS-PAGE分析
采用電泳儀進(jìn)行不連續(xù)雙垂直板十二烷基硫酸鈉-聚丙烯酰胺凝膠電泳(sodium dodecyl sulfate-polyacrylamide gel electrophoresis,SDS-PAGE)分析熱處理對(duì)不同核桃蛋白質(zhì)量濃度的影響。將核桃蛋白粗提取物與樣品緩沖液(pH 6.8、0.5 mol/L Tris-HCl緩沖液2.0 mL、無(wú)水丙三醇2.0 mL、20%十二烷基硫酸鈉2.0 mL、質(zhì)量分?jǐn)?shù)0.1%溴酚藍(lán)0.5 mL、β-巰基乙醇1.0 mL、去離子水2.5 mL)按1∶1的體積比混合,100 ℃煮沸5 min,離心,上樣20 μL,分離膠質(zhì)量濃度12 mg/100 mL,濃縮膠質(zhì)量濃度3.9 mg/100 mL。開(kāi)始電流10 mA,進(jìn)入分離膠后電流為20 mA,電泳時(shí)間2.5~3.5 h。考馬斯亮藍(lán)R-250染色過(guò)夜,放入脫色液中脫色,直至膠片背景藍(lán)色變?yōu)橥耆该鳡睿娪咀詣?dòng)成像儀拍照,使用Image J軟件進(jìn)行半定量分析。
1.3.4 血清學(xué)分析
1.3.4.1 Dot blot實(shí)驗(yàn)
采用斑點(diǎn)印跡(Dot blot)實(shí)驗(yàn)分析不同熱處理方式對(duì)核桃蛋白IgE結(jié)合能力的影響。使用0.01 mol/L PBS(pH 7.4)稀釋上述各處理組的3 mg/mL蛋白溶液,取2 μL點(diǎn)于硝酸纖維素膜上,置于37 ℃恒溫箱中干燥20~30 min,使蛋白吸附至膜上;使用TBST/5% BSA封閉1 h,使用6 個(gè)對(duì)核桃過(guò)敏患者血清(每?jī)蓚€(gè)分為一組,混合成3 個(gè)血清池)以體積比1∶10稀釋進(jìn)行孵育,4 ℃過(guò)夜;一抗孵育后,用TBST洗滌6 次,加入質(zhì)量比1∶8 000生物素標(biāo)記的羊抗人IgE抗體,37 ℃孵育1 h,用TBST洗滌6 次;再加入質(zhì)量比1∶500 HRP標(biāo)記的鏈霉親和素37 ℃孵育1 h,TBST洗滌6 次后使用二氨基聯(lián)苯胺(diaminobezidin,DAB)染液避光孵育顯色,去離子水沖洗終止反應(yīng)。分析核桃蛋白粗提取物與過(guò)敏患者血清IgE的結(jié)合能力。
1.3.4.2 Western blot實(shí)驗(yàn)
采用免疫印跡(Western blot)實(shí)驗(yàn)進(jìn)一步分析核桃中主要過(guò)敏原Jug r 1的IgE、IgG結(jié)合能力的變化。對(duì)各處理組的核桃粗提取物進(jìn)行SDS-PAGE分析后,在80 V下恒壓電轉(zhuǎn)2 h,將蛋白條帶印跡到硝酸纖維素膜上。采用TBST(5% BSA)封閉1 h,加入制備的抗Jug r 1蛋白的兔多抗血清或過(guò)敏病人血清孵育過(guò)夜。一抗孵育完后,用TBST洗滌6 次,用HRP標(biāo)記羊抗兔IgG抗體或羊抗人IgE抗體孵育1 h,用TBST洗滌8 次。加DAB顯色液孵育5 min,顯色后去離子水沖洗,照相。
1.4 數(shù)據(jù)分析
2 結(jié)果與分析
2.1 熱處理方式對(duì)核桃蛋白質(zhì)量濃度的影響
使用BCA試劑盒對(duì)不同熱處理后核桃蛋白的可提取質(zhì)量濃度進(jìn)行分析,如圖1A所示,與對(duì)照組相比,干熱、濕熱及高溫高壓處理后,可提取核桃總蛋白的質(zhì)量濃度顯著降低(P<0.05),其中高溫高壓處理的效果最為顯著,可提取總蛋白質(zhì)量濃度降為(6.84±0.10)mg/mL,降低了32.3%,這可能是由于高溫高壓引起部分蛋白質(zhì)變性凝固,從而降低了其可提取蛋白質(zhì)量濃度。與對(duì)照組相比,微波處理組反而在一定程度上增加了核桃蛋白的可提取質(zhì)量濃度,這可能與微波加熱的作用方式有關(guān)。
核桃主要過(guò)敏原為Jug r 1,其分子質(zhì)量約為16 kDa[10]。采用SDS-PAGE進(jìn)一步分析不同熱處理方式對(duì)Jug r 1質(zhì)量濃度的影響。如圖1B所示,在16 kDa處,與對(duì)照組相比,干熱處理的電泳條帶灰度未發(fā)生顯著變化;濕熱、高溫高壓處理組的電泳條帶灰度顯著降低;微波處理組的蛋白條帶灰度略有加深。這提示干熱處理對(duì)核桃中Jug r 1的質(zhì)量濃度沒(méi)有顯著影響,濕熱和高溫高壓處理顯著降低了Jug r 1的可提取質(zhì)量濃度,而微波處理增加了核桃中Jug r 1的可提取質(zhì)量濃度,這與上述BCA法測(cè)定蛋白質(zhì)量濃度結(jié)果基本一致。
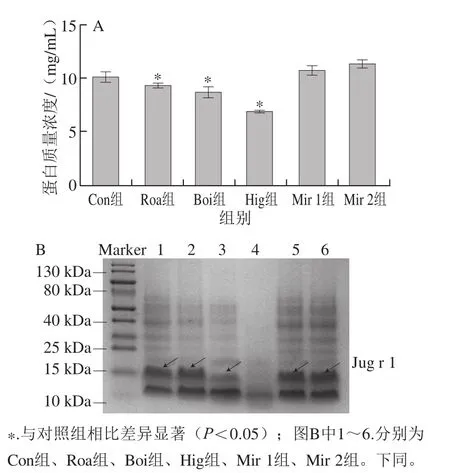
圖1 不同熱處理提取核桃蛋白質(zhì)量濃度(A)和SDS-PAGE分析(B)Fig. 1 Walnut protein concentration (A) and SDS-PAGE (B) of protein extracts walnuts from subjected to different thermal treatments
2.2 熱處理方式對(duì)核桃蛋白IgE結(jié)合能力的影響
絕大多數(shù)的核桃過(guò)敏反應(yīng)由IgE介導(dǎo),IgE與肥大細(xì)胞等效應(yīng)細(xì)胞表面的Fc受體結(jié)合,過(guò)敏原再次進(jìn)入機(jī)體后,與肥大細(xì)胞表面的IgE抗體結(jié)合,形成橋聯(lián),引起脫顆粒反應(yīng),釋放出炎性介質(zhì),從而引起臨床癥狀[19]。為探究不同熱處理方式對(duì)核桃蛋白IgE結(jié)合能力的影響,對(duì)收集的6 個(gè)核桃過(guò)敏患者的血清進(jìn)行Dot blot實(shí)驗(yàn)。結(jié)果如圖2A所示,干熱處理對(duì)核桃蛋白與IgE結(jié)合程度沒(méi)有明顯影響,濕熱和高溫高壓處理顯著降低了核桃蛋白與病人血清池中IgE的結(jié)合程度,尤其經(jīng)高溫高壓處理后,核桃蛋白幾乎已不能與患者血清池中IgE結(jié)合,而微波處理在一定程度上增強(qiáng)了核桃蛋白與患者血清池中IgE的結(jié)合程度。
為了對(duì)其結(jié)合程度進(jìn)行精確量化,使用Image J軟件對(duì)Dot blot實(shí)驗(yàn)的結(jié)果進(jìn)行半定量分析,結(jié)果如圖2B所示。以患者血清池與對(duì)照組蛋白結(jié)合的灰度作為基準(zhǔn),與對(duì)照組相比:干熱處理對(duì)核桃蛋白與IgE的結(jié)合能力沒(méi)有顯著影響(P>0.05);濕熱和高溫高壓處理顯著降低了核桃蛋白與核桃過(guò)敏患者血清中IgE的結(jié)合能力(P<0.05),分別降低了約50%、90%;而微波處理使核桃蛋白的IgE結(jié)合能力顯著增強(qiáng)了約30%(P<0.05),這提示高溫高壓能夠顯著降低核桃蛋白的抗原性,而微波處理能夠顯著增強(qiáng)其抗原性。
由于Dot blot實(shí)驗(yàn)使用的是核桃粗蛋白,因此,采用Western blot實(shí)驗(yàn)進(jìn)一步探究核桃蛋白中主要發(fā)揮致敏性作用的蛋白。結(jié)果如圖2C所示,所選取的兩名核桃過(guò)敏患者的血清都在10~17 kDa以及20~30 kDa處有結(jié)合條帶,根據(jù)分子質(zhì)量推測(cè)前者為核桃中主要過(guò)敏原Jug r 1,而后者的電泳遷移規(guī)律與過(guò)敏原數(shù)據(jù)庫(kù)中已知的4 種核桃致敏原蛋白并不相符,因此推測(cè)這可能是一種并未被鑒定與表征的核桃過(guò)敏原蛋白。結(jié)果顯示,濕熱和高溫高壓處理顯著降低了核桃主要過(guò)敏原Jug r 1與核桃過(guò)敏患者血清IgE的結(jié)合能力(P<0.05),其中高溫高壓處理效果最顯著,而干熱處理對(duì)Jug r 1的IgE結(jié)合能力沒(méi)有顯著影響,微波處理一定程度上增強(qiáng)了Jug r 1的IgE結(jié)合能力,這和Dot blot實(shí)驗(yàn)的結(jié)果基本一致。

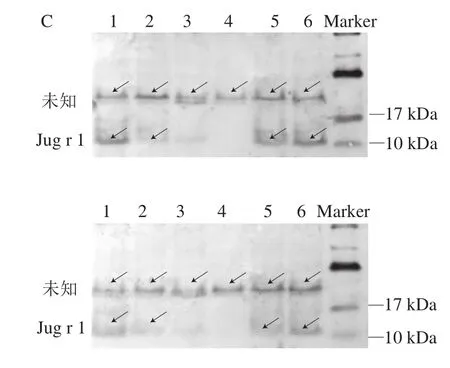
圖2 Dot blot實(shí)驗(yàn)(A)、相對(duì)灰度分析(B)以及IgE免疫印跡實(shí)驗(yàn)(C)Fig. 2 Results of dot blot tests (A), relative gray value analysis (B) and IgE immunoblotting tests (C)
2.3 熱處理方式對(duì)核桃蛋白IgG結(jié)合能力的影響

圖3 IgG免疫印跡結(jié)果(A)和相對(duì)灰度分析(B)Fig. 3 Results of IgG immunoblotting tests (A) and relative gray value analysis (B)
本研究中收集了6 名核桃過(guò)敏患者的血清以分析不同熱處理方式對(duì)核桃蛋白抗原性的影響,但其血清中IgE濃度相對(duì)較低,為進(jìn)一步確定不同熱處理方式對(duì)核桃蛋白抗原性的影響,使用核桃主要過(guò)敏原Jug r 1制備的特異性多克隆抗體進(jìn)行Western blot實(shí)驗(yàn)。如圖3所示,在分子質(zhì)量約為15 kDa處有明顯的結(jié)合條帶(箭頭指示),與Jug r 1約16 kDa的表觀分子質(zhì)量相吻合,除了80 kDa左右存在少量非特異性條帶外,蛋白與多克隆抗體的特異性結(jié)合能力很強(qiáng)。結(jié)果顯示:干熱處理對(duì)核桃蛋白的IgG結(jié)合能力沒(méi)有顯著影響(P>0.05);濕熱和高溫高壓處理顯著降低了核桃蛋白IgG的結(jié)合能力(P<0.05),分別降低了40%、80%;而微波處理一定程度上提高了核桃蛋白的IgG結(jié)合能力。這說(shuō)明濕熱和高溫高壓處理顯著降低了核桃蛋白的IgG結(jié)合能力,提示這兩種處理方式能夠有效降低核桃蛋白抗原性,這與利用核桃過(guò)敏患者血清研究的結(jié)果一致。
3 討 論
核桃是蛋糕和餅干等烘焙產(chǎn)品重要的添加原料,同時(shí)也是一類主要的堅(jiān)果過(guò)敏源[20],無(wú)意添加或者加工過(guò)程中的交叉污染可能會(huì)危及核桃過(guò)敏者的健康甚至生命[21]。熱處理是一種常用的蛋白改性手段,也是食品加工過(guò)程中常規(guī)的工藝流程,能夠影響食物蛋白的溶解度和結(jié)構(gòu)等理化性質(zhì),既而可能影響其致敏性。
本研究選取常用的幾種熱處理方式,探究了不同方式對(duì)核桃蛋白致敏性的影響。首先檢測(cè)了不同熱處理后核桃蛋白可提取質(zhì)量濃度的變化,隨后使用核桃過(guò)敏患者血清檢測(cè)不同方式對(duì)核桃IgE結(jié)合能力的變化,分析其對(duì)核桃蛋白抗原性的影響。但是,由于核桃過(guò)敏患者血清不易收集,本研究中只收集到了6 名核桃患者的血清,且其血清中IgE水平較低,樣本的數(shù)量及IgE水平可能會(huì)限制核桃蛋白抗原性變化檢測(cè)的準(zhǔn)確性;因此,本研究制備了Jug r 1多克隆抗體以研究其IgG結(jié)合能力,進(jìn)一步分析不同熱處理方式對(duì)核桃蛋白抗原性的影響。
干熱和濕熱是熱處理中常用的兩種方式。有研究顯示,花生中的過(guò)敏原Ara h1和Ara h2的致敏性在經(jīng)過(guò)烘烤后會(huì)增加,但是經(jīng)過(guò)水煮后顯著降低[14,22]。本研究發(fā)現(xiàn),干熱處理對(duì)核桃蛋白的IgE結(jié)合能力、IgG結(jié)合能力都沒(méi)有顯著影響,而濕熱處理顯著降低了核桃蛋白的IgE和IgG結(jié)合能力,提示相比于干熱處理,濕熱處理能更顯著地降低核桃蛋白抗原性。這可能是由于兩種加熱方法的升溫和熱處理模式不同,水分含量也不一樣,導(dǎo)致蛋白質(zhì)分子發(fā)生某些化學(xué)反應(yīng)(疏水、共價(jià))的速率不同,從而影響了其抗原性。干熱處理通過(guò)脫水干燥使蛋白質(zhì)氧化、變性、炭化,相比于干熱處理,濕熱處理穿透性更強(qiáng),更易于傳遞熱量,與水的直接接觸也更易破壞保持蛋白質(zhì)穩(wěn)定性的氫鍵等結(jié)構(gòu)[23-24]。因此,濕熱處理更易使蛋白質(zhì)變性并發(fā)生凝固,破壞蛋白化學(xué)結(jié)構(gòu),從而破壞過(guò)敏原的表位,降低蛋白致敏性。
高溫高壓處理是一種熱處理與非熱處理相結(jié)合的方式。高壓處理通過(guò)影響蛋白分子的非共價(jià)相互作用(氫鍵、離子鍵和疏水鍵)從而影響其二級(jí)和三級(jí)結(jié)構(gòu)[25-27]。本研究發(fā)現(xiàn),高溫高壓處理在降低核桃蛋白質(zhì)量濃度和抗原性上均具有最顯著的效果,這提示高溫高壓處理能夠有效降低核桃蛋白致敏性。推測(cè)高溫高壓處理嚴(yán)重破壞了核桃中過(guò)敏原的原有結(jié)構(gòu)和抗原表位,從而顯著降低了核桃過(guò)敏原的IgE、IgG結(jié)合能力,有效降低核桃蛋白抗原性。
此外,在本研究中還采用了微波加熱的處理方式,發(fā)現(xiàn)和干熱、濕熱、高溫高壓這3 種熱處理方式相比,微波加熱處理不但沒(méi)有降低核桃蛋白的可提取質(zhì)量濃度,反而在一定程度上使其增加,這可能是因?yàn)槲⒉ㄗ饔每墒购颂冶砝锿瑫r(shí)吸收微波能量,溫度升高,內(nèi)部水分迅速汽化并向外遷移,形成無(wú)數(shù)條微小孔道,使樣品結(jié)構(gòu)蓬松,增加其溶解度。此外,本研究還發(fā)現(xiàn),微波處理略微提高了核桃蛋白的IgE、IgG結(jié)合能力,這可能是由于微波加熱的處理方式可以使蛋白的某些折疊結(jié)構(gòu)被不同程度的打開(kāi),但由于加熱均勻,其表面溫度不高,不足以產(chǎn)生足夠的美拉德反應(yīng),因此會(huì)暴露或者形成更多的抗原表位,從而有利于抗體的結(jié)合,提高了核桃蛋白的抗原性。有研究指出,一些加工處理方式使蛋白形成新的穩(wěn)定結(jié)構(gòu)后,分子表面某些局部區(qū)域會(huì)形成新的抗原決定簇[28],這可能也是本研究中微波加熱后核桃蛋白抗原性增強(qiáng)的原因。
值得注意是,在利用Western blot方法探究不同熱處理對(duì)核桃蛋白IgE結(jié)合能力的影響時(shí),只在10~17 kDa以及20~30 kDa兩處發(fā)現(xiàn)結(jié)合條帶,尚未發(fā)現(xiàn)其他的結(jié)合條帶。這提示本研究中收集的核桃過(guò)敏患者血清只能夠識(shí)別這兩種核桃蛋白。目前,核桃過(guò)敏原蛋白已被鑒定的有Jug r 1、Jug r 2、Jug r 3、Jug r 4,本研究中第一個(gè)結(jié)合條帶根據(jù)分子質(zhì)量可以推測(cè)為Jug r 1,而第二個(gè)結(jié)合條帶電泳遷移規(guī)律與已知的4 種核桃致敏原蛋白均不相符。說(shuō)明本研究收集的核桃過(guò)敏患者血清只識(shí)別出了Jug r 1,并未識(shí)別出Jug r 2、Jug r 3、Jug r 4,這可能與收集的核桃患者血清相關(guān)。一方面可能由于本研究收集的血清樣本數(shù)量有限;另一方面,可能是由于在我國(guó)其他3 種核桃過(guò)敏原不是引起核桃過(guò)敏的主要過(guò)敏原。大量研究發(fā)現(xiàn),食物過(guò)敏具有地區(qū)和人群差異性[29-31],本研究結(jié)果進(jìn)一步提示核桃過(guò)敏具有地區(qū)差異性,不同地區(qū)引起核桃過(guò)敏的過(guò)敏原可能不一樣。而本研究中發(fā)現(xiàn)的20~30 kDa處的結(jié)合條帶,推測(cè)是一種并未被鑒定的核桃過(guò)敏原,在核桃過(guò)敏中可能發(fā)揮重要作用,但這仍需要進(jìn)一步研究;同時(shí),由于本研究中采用的幾種熱處理方式均不能夠影響其抗原性,提示其結(jié)構(gòu)相對(duì)穩(wěn)定,具有較好的耐熱性。
綜上,濕熱和高溫高壓這兩種熱處理方式不僅能夠顯著降低核桃蛋白質(zhì)量濃度,同時(shí)還能顯著降低核桃蛋白抗原性,這提示濕熱和高溫高壓這兩種熱處理方式能夠有效降低核桃蛋白致敏性,其中高溫高壓處理的效果最為顯著。本研究的結(jié)果為尋找降低核桃蛋白致敏性的加工方式提供了參考,同時(shí)也為其他堅(jiān)果類食品降低致敏性的加工方法提供借鑒。

