活性炭微觀結構對玉米朊脫色效果的影響
史嘉辰,韓及華,李運通,孫 俊,陳中偉,徐 斌
(江蘇大學食品與生物工程學院,江蘇 鎮江 212013)
玉米朊是玉米的主要儲藏蛋白,占籽粒總量的39%左右,胚乳的47%左右[1],具有良好的耐水耐油性、阻氧性、可成膜性、生物相容性,被視為理想的鮮食保鮮以及糖果和藥片的包壁材料。目前,商業玉米朊的制備常采用有機溶劑浸提法,該方法在獲得玉米朊的同時會使玉米黃粉中的色素(β-胡蘿卜素、葉黃素和玉米黃素等)和異味物質溶出,導致玉米朊呈現黃色,影響包壁時的透明度和色澤,限制其在食品和醫藥領域的應用[2-3]。因此,對玉米朊的脫色處理十分必要。
活性炭具有優良的吸附特性,被廣泛應用于對有機化合物、重金屬以及色素的吸附[4-5]。采用活性炭作為吸附劑對玉米朊進行脫色純化研究,已有幾十年的歷史[6-7]。在國外,以美國農業部Sessa等[8-11]為代表的科研團隊的研究最為全面,并且取得了不錯的效果;在國內,對活性炭脫色玉米朊的研究主要集中在兩方面:其一是對國內來源不同的活性炭進行篩選;其二是通過單因素試驗優化脫色工藝[12-14]。然而,對國產活性炭和國外活性炭脫色效果的對比研究依然存在空缺。此外,現有文獻報道的玉米朊活性炭脫色技術研究大多以商業玉米朊的復溶溶液為主,對玉米朊萃取液的研究甚少。
為此,本研究以活性炭脫色玉米朊溶液后的色素含量和玉米朊損失率為脫色效果評價標準,通過靜態吸附實驗,對比了玉米朊復溶溶液和萃取液在活性炭脫色效果方面的差異。采用國外研究常用的Darco活性炭ACD[8]和國產活性炭ACP為吸附劑[12],對比了兩種活性炭脫色玉米朊的效果。并通過掃描電子顯微鏡分析、表面化學基團分析、比表面積及孔徑分析和粒徑分析等手段對這兩種活性炭進行結構表征,從微觀角度揭示活性炭脫色差異的內在原因,以期為玉米朊的活性炭脫色處理提供理論參考和工藝指導。
1 材料與方法
1.1 材料與試劑
玉米朊、玉米朊萃取液 高郵市日星藥用輔料有限公司;Darco活性炭(ACD) 西格瑪奧德里奇(上海)貿易有限公司;國產活性炭(ACP,以木屑為原料,采用磷酸法生產得到) 廣州韓研活性炭有限公司;β-胡蘿卜素標準品 TCI(上海)有限公司;其他試劑均為化學純。
1.2 儀器與設備
S-4800型掃描電子顯微鏡 日本日立建機株式會社;NOVA 3000e比表面積孔徑分析儀 美國Quantachrome公司;UV-9600紫外-可見分光光度計 北京瑞利分析儀器公司;BR4i型高速冷凍離心機 法國Jouan公司;SHZ-88A型往復式水浴恒溫振蕩器 太倉市實驗設備廠;CJJ-931六聯磁力加熱攪拌器 金壇市環宇科學儀器;Nicolet-iS5型傅里葉變換紅外光譜儀 美國Thermo公司;電子分析天平 德國賽多利斯公司;Zetasizer Nano-ZS90激光粒徑儀 英國馬爾文儀器公司。
1.3 方法
1.3.1 脫色效果評價方法
1.3.1.1 色素吸附率測定
選擇β-胡蘿卜素為基準,量化玉米朊中的色素含量[12]。選擇體積分數90%乙醇溶液為溶劑,配制質量濃度為1~6 μg/mL的β-胡蘿卜素標準液,測定各質量濃度標準溶液的A448nm。以β-胡蘿卜素標準液質量濃度為橫坐標,吸光度為縱坐標繪制標準曲線。得到β-胡蘿卜素的標準曲線方程為y=0.137 6x-0.007 5(R2=0.999),β-胡蘿卜素質量濃度在1.0~6.0 μg/mL之間呈良好的線性關系。
1.3.1.2 玉米朊損失率測定
據Sessa等[11]報道,玉米朊在280 nm波長處有最大吸收峰。采用分光光度法測定玉米朊損失率。準確稱取0.400 0 g玉米朊溶于體積分數90%乙醇溶液中,定容至100 mL,配制成4 mg/mL玉米朊標準儲備液。以上述溶液為母液,稀釋成質量濃度為0~1.60 mg/mL玉米朊標準液。以體積分數90%乙醇溶液為參比,測定各質量濃度標準液的A280nm。以玉米朊標準液質量濃度為橫坐標,吸光度為縱坐標繪制標準曲線。得到玉米朊的標準曲線方程為y=0.949 1x+0.009 9(R2=0.999 4),質量濃度在0~1.6 mg/mL之間呈良好的線性關系。
1.3.2 活性炭的靜態吸附實驗
1.3.2.1 活性炭對玉米朊復溶液的吸附
以體積分數90%乙醇溶液配制足量質量濃度為40 mg/mL的玉米朊復溶溶液。準確量取玉米朊復溶溶液30 mL,分別加入到編號為1和2的100 mL錐形瓶中。分別向1號和2號錐形瓶中加入0.4 g的ACD和ACP。35 ℃、100 r/min振蕩吸附120 min。吸附完成后9 000 r/min離心20 min,分離活性炭。測定上清液的A448nm和A280nm,分別代入β-胡蘿卜素的標準曲線方程和玉米朊的標準曲線方程,計算得到脫色后色素質量濃度ρ1/(mg/mL)和玉米朊質量濃度ρZ1/(mg/mL)。在不添加活性炭的條件下,測得玉米朊復溶溶液的色素質量濃度ρ0/(mg/mL)和玉米朊質量濃度ρZ0/(mg/mL)。色素吸附率和玉米朊損失率分別根據公式(1)、(2)計算。
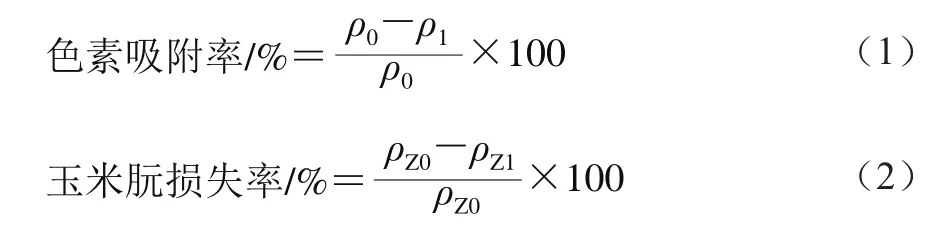
1.3.2.2 活性炭對玉米朊萃取液的吸附
玉米朊萃取液是指采用體積分數90%乙醇溶液對玉米黃粉進行提取,使其中的玉米蛋白溶出,再經固-液分離得到的上層玉米蛋白提取液。取一定量的玉米朊萃取液在4 000 r/min下離心,準確量取上層清液(玉米朊萃取液質量濃度約100 mg/mL)2 mL至100 mL容量瓶中,用體積分數90%乙醇溶液定容。以體積分數90%乙醇溶液為參比,測玉米朊萃取液的A280nm,根據玉米朊的標準曲線方程,計算得到玉米朊萃取液的質量濃度。
采用體積分數90%乙醇溶液稀釋已知質量濃度的玉米朊萃取液至40 mg/mL,準確量取30 mL分別加入到編號為1和2的100 mL錐形瓶中。分別向1號和2號錐形瓶中加入0.4 g ACD和ACP,在35 ℃和100 r/min的振蕩頻率下,振蕩吸附120 min。吸附完成后9 000 r/min離心20 min,分離活性炭,測定上清液的A448nm和A280nm。分別代入β-胡蘿卜素的標準曲線方程和玉米朊的標準曲線方程,計算得到脫色后色素質量濃度ρ1和玉米朊質量濃度ρZ1。在不添加活性炭的條件下,測得玉米朊萃取液的色素質量濃度ρ0和玉米朊質量濃度ρZ0。分別代入公式(1)和(2)中,計算得到色素吸附率和玉米朊損失率。
1.3.3 活性炭的結構表征
1.3.3.1 掃描電子顯微鏡分析
通過對活性炭的表面形態結構進行觀察,可以從理論上分析活性炭吸附性能的差異[15]。將兩種活性炭樣品用導電雙面膠分別固定在樣品臺上,并吹去未固定的粉末樣品。測試前對樣品進行真空離子濺射噴金鍍膜處理。測試條件:S-4800型熱場發射電子顯微鏡掃描,加速電壓為15 kV,放大倍數為100 倍和500 倍,獲得相應的掃描電子顯微鏡圖,并對兩種活性炭掃描電子顯微鏡圖進行比較。
1.3.3.2 比表面積和孔隙結構分析
參考Noonpui等[16]的方法,采用氮氣物理吸附-脫附法測定。實驗采用NOVA 3000e比表面積孔徑分析儀測定,稱取足量樣品置于樣品管中,測試前將樣品在90 ℃下脫氣2 h后,升溫至150 ℃繼續脫氣12 h轉入分析站,然后以氮氣為吸附質,在液氮溫度(-196 ℃)下進行吸附。比表面積及孔徑分布均由NOVA 3000e比表面積孔徑分析儀自帶的分析軟件進行分析處理。
1.3.3.3 碘吸附值和亞甲基藍吸附值的測定
ACD和ACP的碘吸附值按GB/T 12496.8—2015《木質活性炭試驗方法 碘吸附值的測定》進行測定。ACD和ACP的亞甲基藍吸附值按GB/T 12496.10—1999《木質活性炭試驗方法 亞甲基藍吸附值的測定》進行測定。
1.3.3.4 傅里葉變換紅外光譜分析
傅里葉變換紅外表征采用Nicolet-iS5型傅里葉變換紅外光譜儀進行檢測,主要檢測步驟按參考文獻[17]進行:取ACP和ACD各1 mg置于研缽中,向研缽中添加0.10 g溴化鉀,使樣品與溴化鉀充分研磨混勻,然后用壓片機將混合物壓成薄片,在400~4 000 cm-1波數范圍內掃描64 次,分辨率1.9 cm-1。
1.3.3.5 粒徑分析
分別稱取1.0 mg左右的ACP和ACD分散至50 mL去離子水中,采用超聲波處理樣品至形成穩定的懸浮液。采用Zetasizer Nano-ZS90激光粒徑儀分別對兩種活性炭進行濕法粒徑分析,測定兩種活性炭的中值粒徑(D50)和多分散性指數(polydispersity index,PDI),對兩種活性炭的粒徑分布和平均粒徑進行表征。
1.4 數據統計分析
采用SPSS 17.0軟件進行數據分析,Duncan法進行顯著性分析,用95%置信水平(P<0.05)來說明數據的差異性。每組實驗重復3 次,結果取3 次實驗的平均值。
2 結果與分析
2.1 活性炭的靜態吸附效果分析
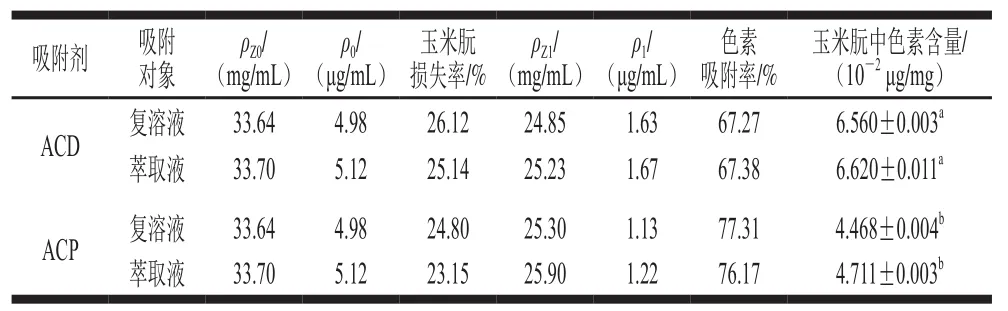
表1 活性炭對玉米朊的靜態吸附效果Table1 Static adsorption efficiency of pigment in zein by ACD and ACP
如表1所示,經ACP脫色后的色素吸附率和玉米朊的損失率分別為77.31%和24.80%,而ACD的色素吸附率和玉米朊損失率分別為67.27%和26.12%。由此可知,ACP的脫色效果要優于ACD。
以ACD為吸附劑,玉米朊復溶溶液和萃取液為吸附對象時,經活性炭脫色后,兩種吸附對象玉米朊中的色素含量分別為6.560×10-2μg/mg和6.620×10-2μg/mg,無顯著性差異(P>0.05)。因此,玉米朊生產企業可對玉米朊萃取液直接進行脫色處理。
2.2 活性炭的結構表征
2.2.1 掃描電子顯微鏡分析

圖1 ACD(A)和ACP(B)的掃描電子顯微鏡圖Fig. 1 Scanning electron microscopic images of ACD (A) and ACP (B)
由圖1A可以看出ACD顆粒塊狀較多,顆粒大小比較集中;ACP顆粒桿狀較多,這可能增加脫色后活性炭分離的難度。由圖1A2、B2可以看出ACD和ACP表面均含有豐富的孔結構。ACP結構向活性炭內部延伸,表面呈現蜂巢狀,屬中空結構;ACD顆粒表面有褶皺和凹陷現象,但孔結構不明顯。這些現象可能表明ACP比表面積更大,吸附能力更強。通過掃描電子顯微鏡圖可大致了解兩種活性炭的表面形貌及孔數量的多少,但無法辨別出活性炭的中孔和微孔。
2.2.2 孔隙結構分析
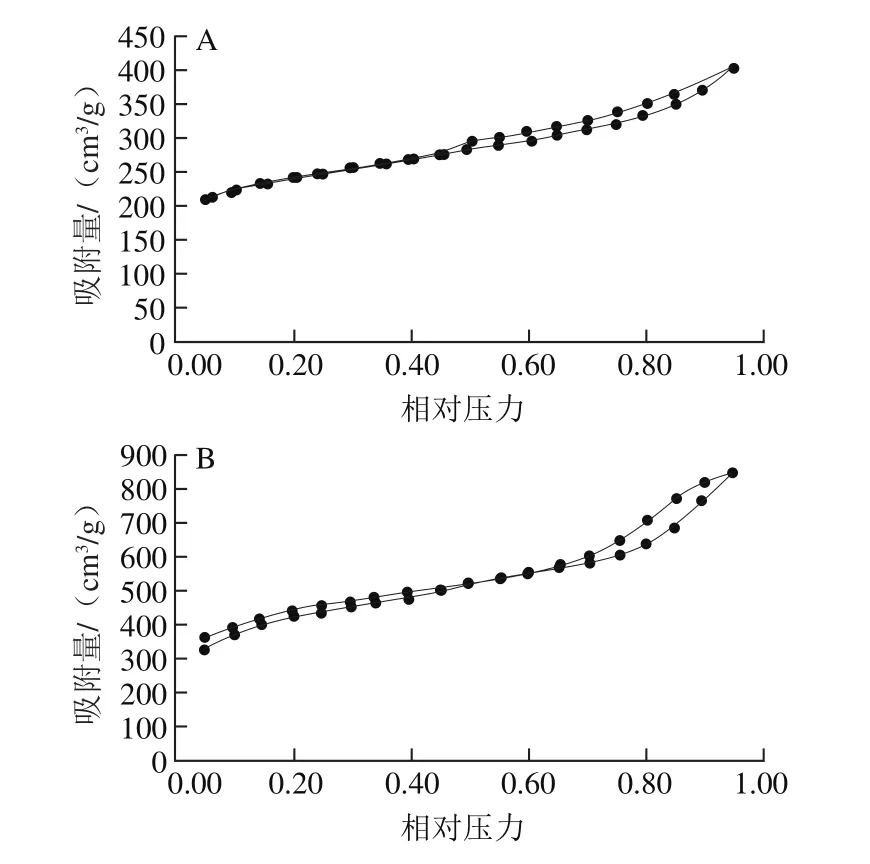
圖2 ACD(A)和ACP(B)吸附-脫附的氮氣等溫線Fig. 2 Adsorption/desorption isotherms of ACD (A) and ACP (B)
如圖2所示,ACD和ACP對氮氣的吸/脫附等溫線呈閉環形,高壓范圍內出現明顯的滯后環。說明ACD和ACP對氮氣的吸/脫附等溫線屬于Ⅱ型等溫線,且兩種活性炭中存在大量的中孔結構[18-20],因此,ACD和ACP的孔結構為微孔和中孔混合結構。

表 2 ACD和ACP的BET比表面積和孔結構參數Table2 BET specific area and pore structure parameters of ACD and ACP
由表2可知,ACP具有較高的總比表面積(大于1 400 m2/g)和總孔容積(大于1.3 cm3/g),微孔和中孔容積占總容積總量30%和70%左右,微孔表面積占總表面積的一半以上,表明ACP的微孔和中孔結構發達,因此具有較強的吸附性能。ACD的比表面積僅為ACP的1/2左右,但脫色效果僅略遜于ACP,說明活性炭表面積大小和孔隙的分布情況不能單一的用來判定活性炭對玉米朊的脫色效果。活性炭吸附效果可能還與其他因素相關,如活性炭表面化學基團等。
2.2.3 活性炭的碘吸附值和亞甲基藍吸附值
活性炭的碘吸附值與亞甲基藍吸附值在一定程度上反映了活性炭孔隙的發達程度。活性炭中孔徑在1.0~1.5 nm之間的孔隙較發達時,碘吸附值較大;而活性炭中孔徑在1.5~2.8 nm之間的孔隙較多時,亞甲基藍吸附值較大[21]。
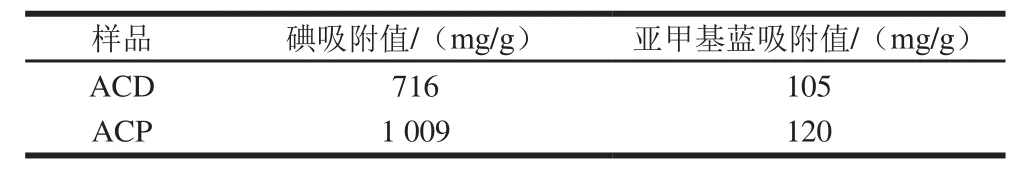
表3 ACD和ACP的碘吸附值及亞甲基藍吸附值Table3 Iodine adsorption values and methylene blue adsorption values of ACD and ACP
由表3可知,ACP碘吸附值和亞甲基藍吸附值分別為1 009 mg/g和120 mg/g,均大于ACD。由此說明與ACD相比,ACP在孔徑為1.0~2.8 nm范圍內的微孔更多,分析結果與兩種活性炭對氮氣的吸附-脫附結果一致。
2.2.4 傅里葉變換紅外光譜分析
活性炭的表面化學性質決定了其化學吸附特性,表面的化學官能團、雜原子和化合物的不同,會導致活性炭對不同的吸附質產生明顯的吸附差別[22-24]。活性炭表面官能團主要為含氧官能團和含氮官能團。其中,含氧官能團對活性炭吸附效果的影響最大。研究結果表明,含氧官能團的數量和種類極大地影響了活性炭的吸附性質,并對其表面電荷和骨架電子密度產生影響,進而影響其使用性能[25-26]。
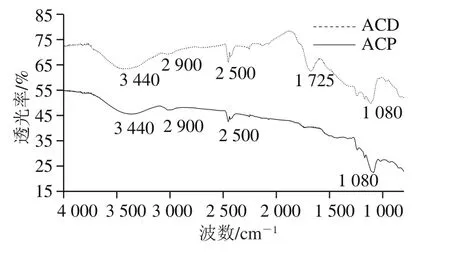
圖3 ACD和ACP的傅里葉變換紅外光譜圖Fig. 3 Fourier transform infrared spectra of ACD and ACP
如圖3所示,ACD和ACP在3 440、2 900、2 500 cm-1和1 080 cm-1處均有紅外吸收峰,尤其是ACD在1 725 cm-1附近有明顯的吸收峰。波長3 440 cm-1處的吸收峰主要是由于羥基(-OH)或者氫鍵的伸縮振動引起[27];活性炭表面甲基(-CH3)和亞甲基(-CH2-)的伸縮振動導致ACD和ACP在2 900 cm-1波長處產生了吸收峰[28];1 080 cm-1處的強吸收峰主要由CH2-O-CH2中的C-O伸縮振動引起。ACD在1 725 cm-1附近有明顯的吸收峰,這一特征吸收峰屬于羧酸基團及內酯基團中C=O的特征伸縮振動峰[29-30],說明ACD表面含有較多的羧酸和內酯類官能團,這些官能團可能與色素分子中的-OH結合,增強活性炭對色素分子的吸附能力。這就是在ACD的比表面積僅為ACP二分之一的情況下,對玉米朊的脫色效果卻僅略遜于ACP的原因。
2.2.5 粒徑分析
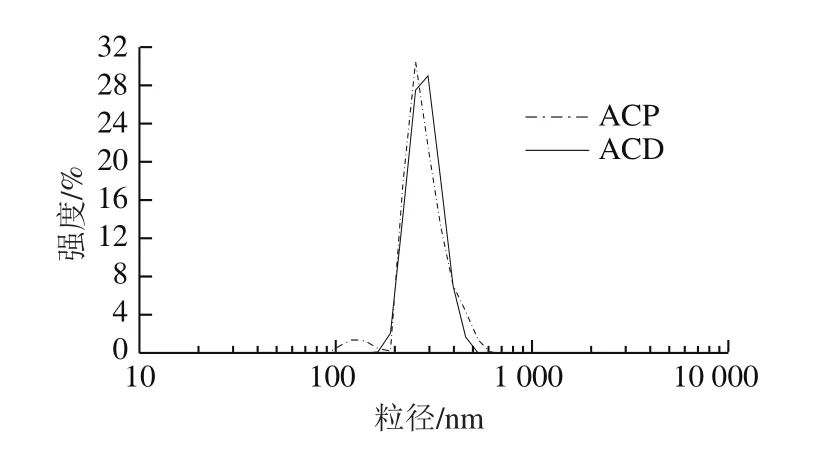
圖4 ACP和ACD粒徑分布強度Fig. 4 Size distribution by intensity of ACP and ACD
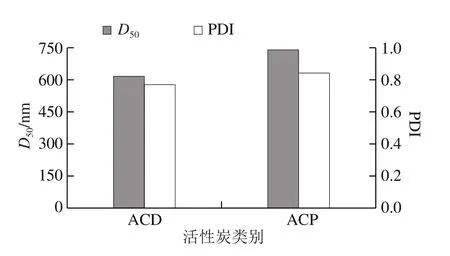
圖5 ACP和ACD的D50和PDI比較Fig. 5 Histogram of D50 and PDI for ACD and ACP
由圖4可知,ACD的粒徑主要集中分布在300 nm左右。而ACP的粒徑分布出現兩個峰,其中絕大部分分布在250 nm左右,少部分分布在150 nm左右。說明ACD比ACP粒徑分布更加集中。從圖5中可看出,ACD的粒徑分布更為集中,與圖4結論一致。
由于工業生產中活性炭和玉米朊溶液主要靠壓濾的方法實現固-液分離,ACP中少量粒徑150 nm左右的顆粒會隨溶液通過濾餅,對玉米朊產品造成不良影響。若通過反復過濾去除小顆粒活性炭,會導致溶劑乙醇大量蒸發,溶質玉米朊形成凝膠,脫色后玉米朊損失率明顯上升。因此,從脫色玉米朊溶液后進行固-液分離操作的角度考慮,ACP粒徑分布不集中與2.2.1節所述ACP含有大量桿狀結構,都會增加后固-液分離的難度和成本,進而對最終的脫色效果造成不利影響。
3 結 論
本研究分別采用商業玉米朊的乙醇復溶溶液和玉米朊的乙醇萃取溶液作為活性炭脫色對象,對比發現活性炭對兩種溶液的脫色效果無顯著性差異。因此,建議生產企業可以直接對玉米朊萃取液進行脫色處理,以降低生產成本。
對比ACP和ACD兩種活性炭的脫色效果,結果表明ACP對色素吸附率略高于ACD,同時玉米朊損失率更低。對兩種活性炭的結構表征發現,ACP的比表面積大于ACD,因此ACP對玉米朊的脫色效果優于ACD。但是,ACD的吸附能力僅略遜于ACP,由此可推測活性炭脫色玉米朊的效果不僅受活性炭比表面積大小的影響,還與活性炭表面化學基團密切相關。通過傅里葉變換紅外光譜分析發現,ACD含有較多的羧酸和內酯類官能團,可有效增強其化學吸附效果,進而提升總體吸附效果。此外,通過對ACD和ACP的粒徑分析,表明ACD粒徑分布相對集中,有利于脫色后的固-液分離。綜上所述,在色素脫除率和玉米朊失率相當的情況下,ACD更適合用于黃色玉米朊的脫色處理。

