益生菌劑調整腸道疾病人群菌群結構豐度水平的研究
臧凱麗,江 巖,孫 勇,閆亞麗,,陳慶森,趙林森,趙 培,崔文靜,馬新穎
(1.天津商業大學生物技術與食品科學學院,天津市食品生物技術重點實驗室,天津 300134;2.北京食品科學研究院,中國肉類食品綜合研究中心,北京 100068;3.河北一然生物科技有限公司,河北 石家莊 050800)
腸道既是人體的消化場所又是人體最大的免疫器官,富集著龐大而復雜的微生物群落,約有800余種7 000多株的細菌,在亞種或菌株水平上表現出極大的多樣性[1]。腸道微生物對人類健康有著重要的影響,能夠幫助宿主代謝,為腸道上皮細胞提供營養,增強免疫功能,抵抗外來微生物的入侵[2]。正常狀態下,腸道微生物與宿主間存在著復雜而微妙的動態平衡,微生物從宿主汲取生長所需的養分,宿主則借助微生物來降解一些自身不能分解利用的物質[3]。腸道微生物與宿主之間的平衡一旦被打破,就會造成腸道菌群結構紊亂,腸道微生物就會從能量吸收、內毒素血癥、短鏈脂肪酸、膽堿、膽汁酸代謝和腦腸軸等多種途徑影響宿主的健康[4]。腸道菌群之所以被稱為人類的“第二指紋”,是由于每個個體都有自己獨特的腸道微生物組,其組成和功能通常會隨著宿主的基因、飲食及環境等因素的變化而改變[5]。早在20世紀90年代初,Metchnikoff就提出了著名的“梅氏假說”,發現保加利亞人長壽的秘訣在于其長期飲用發酵乳[6]。近些年來,由于益生菌能夠直接或者間接地調整宿主腸道微生物的組成、增加有益菌的比例,激活宿主內源性微生物或者免疫系統的活性,被廣泛用于預防和治療許多腸道疾病,尤其針對腹瀉、便秘及腸易激綜合征等病癥。目前研究較多的益生菌主要包括乳酸桿菌、乳酸鏈球菌、糞鏈球菌、芽孢桿菌、雙歧桿菌和酵母菌等。Chen等[7]研究發現,酪酸梭菌、糞鏈球菌、芽孢桿菌三聯劑Bio-Three具有提高治療腹瀉療效,縮短病程等效果;Heo等[8]研究發現,地衣芽孢桿菌(Bacillus licheniformis)能夠通過抑制相關病原菌生長,安全有效地治療各種腹瀉和腸道內異常發酵。Guandalini等[9]通過對受試人群每天服用混合8 種凍干菌劑的研究發現,混合凍干菌劑顯著地改善了腸易激綜合征的病癥;丁圣等[10]通過對小鼠模型的研究發現,乳酸桿菌和低聚果糖對腸道內的腸桿菌、腸球菌等有害菌有抑制作用,對雙歧桿菌等腸道有益菌具有增殖作用。雖然益生菌劑的相關研究頗多,但大多以其作用機制為出發點研究其對腸道微生物多樣性以及菌群結構的調節作用,關于具體菌群豐度的調節作用的報道較少。
隨著該領域研究的深入,宏基因組學測序技術已經從傳統的Sanger雙脫氧鏈終止法測序技術發展到第二代高通量測序,目前基于16S rRNA基因可變區高通量測序的技術應用較多的有Roche454、Illumina的HiSeq及MiSeq、Life的Ion Torrent高通量測序技術[11],這些技術為解析腸道菌群豐度的變化與人類健康的關系做出了貢獻。
鑒于前人對益生元、益生菌及合生元等益生特性的研究[12],本研究采用對便秘、腹瀉等腸道疾病有明顯調節作用的菊粉、水蘇糖、植物乳桿菌、嗜酸乳桿菌、干酪乳桿菌、兩歧雙歧桿菌等成分復合制備而成的益生菌劑對不同健康狀態的受試人群加以干預,從調整菌群結構豐度水平、提高菌群多樣性和改善腸道微生物與宿主平衡的角度出發,分析益生菌劑對腸道相關疾病的作用,為以腸道微生物為靶點的腸道疾病的預防提供理論依據,并提供新的思路。
1 材料與方法
1.1 材料與試劑
益生菌劑:抗性糊精(15%~20%,質量分數,下同)、菊粉(10%~15%)、水蘇糖(5%~10%)、麥芽糊精(10%~15%)、植物乳桿菌LP45(Lactobacillus plantarum)、嗜酸乳桿菌La28(Lactobacillus acidophilus)、干酪乳桿菌YMC1069(Lactobacillus casei)、兩歧雙歧桿菌TMC3115(Bifidobacterium bifidum),活菌數比例為1∶1∶1∶1,活菌數2×1010CFU/g,由河北一然生物科技有限公司提供。
Ion Xpress? Barcode Adapters Kit、Ion PGM?Template OT2 200 Kit、Ion PGM? Sequencing 200 Kit v2、Ion Plus Fragment Library Kit、Ion Library TaqMan?Quantitation Kit、Pfu DNA聚合酶 美國Thermo Scientific公司;Qubit?dsDNA HS Assay Kit 美國Invitrogen公司;High Sensitivity DNA Kit 美國Agilent公司;QIAamp Fast DNA Stool Mini Kit 德國QIAGEN公司;MiniBEST Agarose Gel DNA Extraction Kit 寶生物工程(大連)有限公司。
1.2 儀器與設備
3K18高速冷凍離心機 美國Sigma公司;DYY-2C電泳儀 北京六一儀器廠;508-U001 Ion Torrent測序平臺、2.0 Qubit熒光定量儀 美國Invitrogen公司;Ion One TouchTM2INS(模板制備系統)、Ion One Touch?ES(模板富集系統)、磁力架 美國Thermo Scientific公司;2100生化分析儀 美國Agilent公司;GeneAmp 7900聚合酶鏈式反應儀 美國ABI公司;II-3 Biowave DNA紫外-可見分光光度計 英國柏諾公司。
1.3 方法
1.3.1 受試人群健康特征描述
受試人群年齡為18~35 歲。健康、便秘、腹瀉志愿者的臨床癥狀確定:通過對受試者的詢問及其自身表述,按照臨床醫學給定的便秘、腹瀉以及健康個體的臨床癥狀確定;要求志愿者在開始實驗的兩個星期內未發生任何疾病;實驗期間無使用抗生素等藥物或接受治療的情況,同時不限制受試人群每日飲食內容及時間;另外,還要求受試者3 個月內未參與其他實驗研究。
1.3.2 受試人群的分組及樣品采集
本實驗從38 名志愿受試人群中[13],深度挖掘益生菌劑對不同疾病個體腸道菌群多樣性以及豐度水平的變化,故在已有樣本的條件下,選擇男性5 名,女性12 名。受試人群保持飲食及睡眠正常且無限制,每日服用益生菌劑,早晚各一次,2 g/次(活菌數約2×1010CFU/g);干預期間記錄飲酒、服藥等特殊情況。服用益生菌劑前統一采集糞便1 次,干預期間每周采集2 次,共6 周,停止服用2 周后,采集2 次,并將其統一放置于液氮罐中保存,共采集糞便樣品180 個。用QIAamp Fast DNA Stool Mini Kit提取糞便細菌基因組DNA,用1%瓊脂糖凝膠電泳檢測后,又根據細菌基因組完整性以及濃度等判斷,約有104 個樣本符合要求,保存備用。最后選擇健康(1男2女)、便秘(2女)、腹瀉(1男2女)、排便不規(1男)、腸易激綜合征(1男)、腹脹(1女)等不同生理狀態11 人共69 個樣品進行高通量測序,按健康狀況將樣品依次分為健康對照組(CT)、便秘組(CO)、腹瀉組(DI)及其他組(OT)共4 組。
1.3.3 腸道菌群16S rRNA V3區的高通量測序
首先,進行糞便中微生物總DNA的提取,然后對腸道菌群16S rRNA V3區進行聚合酶鏈式反應擴增,通過Ion Torrent PGM進行測序[13]。
1.3.4 測序數據生物信息學和多變量統計學分析
首先,用FastQC將原始數據進行質控,并利用NGStool kits過濾掉低質量序列。將質控得到的高質量序列根據樣品Barcode和引物進行數據的正、反方向分選,進入微生物生態學定量研究(quantitative insights into microbial ecology,QIIME)后再次進行質控以及去除嵌合體,利用usearch方法在97%的相似水平下劃分分類操作單元(operational taxonomic units,OTU);選取每個OTU中豐度最高的序列為代表序列,再參照樣品的信息,生成以序列數代表的每個樣本中每個OTU豐度的OTU Table。然后,以OTU Table為基礎按照進行物種分類,生成系統發育樹,并對樣品各水平相對豐度進行劃分;依據OTU Table數據進行每個文庫多樣性分析,并利用R軟件(Version 3.4.2)繪制稀釋曲線、Rank-Abundance曲線、Chao1指數箱線圖以及Shannon指數箱線圖。最后,為了減少因某些樣本中含有豐度極高的OTU而造成的樣本間距離分布異常和測序時帶來的偏差,研究中對所有樣本中的OTU豐度進行轉化,利用轉換后的數據即樣品中各進化水平相對豐度百分比用Stamp軟件尋找差異OTU,并用R軟件(Version 3.4.2)繪制后續的熱圖、堆砌條圖以及實現降維的主成分分析(principal component analysis,PCA)。
2 結果與分析
2.1 益生菌劑對腸道微生物多樣性的影響分析
2.1.1 多樣性指數分析

圖1 樣品多樣性指數分析Fig. 1 Analysis of microbial diversity index
由圖1a可知,隨著樣品測序深度的增加,觀測物種指數曲線趨于平緩,說明當前測序深度足以發現各樣本生境中的大部分物種。此外,從圖1b中反映物種豐富度及均勻度的Rank-Abundance曲線可以看出,隨著OTU等級的增加,曲線愈加平坦并且在橫軸的跨度也越來越大,說明樣品中物種的均勻度和相對豐度都達到了很高的水平。
2.1.2 益生菌劑干預下的腸道菌群多樣性的變化

圖2 益生菌劑干預下腸道菌群α多樣性的變化Fig. 2 Changes in α diversity of intestinal flora with the intervention of probiotics
圖2 a、b分別反映受試人群腸道菌群物種豐富度和微生物多樣性,與CT組相比,3 組不同健康狀態的受試人群腸道菌群的物種豐富度在益生菌劑干預后都有不同程度的增加,并且都向CT組靠近,說明益生菌劑干預對不同健康狀態人群腸道菌群的多樣性具有一定影響。
2.2 益生菌劑對腸道菌群整體結構的影響
以97%的相似水平通過usearch劃分OTU進化水平,在門水平上選取樣品中最大豐度排名前十的物種劃分為10 個菌門,結果如圖3所示。

圖3 益生菌制劑對腸道菌群門水平上相對豐度的影響Fig. 3 Effect of probiotics on relative abundance of dominant phyla
圖3顯示所有OTU被劃分為10 個門,其中擬桿菌門(Bacteroidetes)、硬壁菌門(Firmicutes)、變形菌門(Proteobacteria)、放線菌門(Actinobacteria)為各組受試人群腸道菌群的優勢菌門,占總序列數的99.81%,其中Bacteroidetes的含量最豐富,約占總序列數的80.30%,其次是Firmicutes,約占總序列數的13.14%,而Proteobacteria和Actinobacteria的占比分別為4.14%、1.98%。其余的如藍細菌門(Cyanobacteria)、梭桿菌門(Fusobacteria)、互養菌門(Synergistetes)、TM7、疣微菌門(Verrucomicrobia)及無壁菌門(Tenericutes)在各樣品中所占比例不足0.1%,另外,還有約0.01%左右的細菌(Unclassified)無法確定具體分類地位。
從圖3可以看出,不同健康狀況的受試人群腸道菌群結構中門水平相對豐度的差異較明顯,從便秘組看,受試人群腸道菌群結構中Bacteroidetes、Firmicutes、Proteobacteria這3 種優勢菌門有一個共同特點:在干預4 周后的菌群相對豐度分別為80.07%、12.48%、7.27%,與健康對照組(79.32%、13.75%、6.63%)最為接近,不同的是,Bacteroidetes的相對豐度隨著益生菌劑的干預逐漸降低,由最初的84.27%降到44.78%;Firmicutes相對豐度在益生菌劑干預階段雖略有波動,但是總體呈上升趨勢;Proteobacteria相對豐度隨益生菌劑干預時間的延長呈先降低后升高起伏波動狀態。此外,Cyanobacteria和Fusobacteria的相對豐度與健康對照組(0.08%、0.005%)具有一定差異,但是,在益生菌劑干預第4周均從零上升到0.001 7%,不過在益生菌劑停止干預后又恢復到了干預前的狀態。對于腹瀉組受試人群來說,益生菌劑對Bacteroidetes、Firmicutes和Proteobacteria有積極的調整作用,除Proteobacteria在干預4 周后由最初的3.08%調整到6.87%,與對照組(6.63%)最為接近外,其余兩種均在干預停止后保持與對照組接近的84.17%、8.06%狀態,同時,Fusobacteria在停止干預后異常升高至0.39%,遠超對照組(0.005%)。就其他健康狀況的受試人群來說,Bacteroidetes和Firmicutes在干預第4周分別調整到80.05%、14.65%,Proteobacteria和Actinobacteria在干預3周前分別由1.12%、0.03%升至4.94%、0.29%,與對照組(6.63%、0.21%)最為接近,但是,在停止干預后,Firmicutes、Proteobacteria及Actinobacteria并沒有保持不變而是呈現降低的趨勢。
此外,對排名前20的各個菌科在益生菌劑干預下的各個樣品中相對豐度進行比較發現,Firmicutes的毛螺菌科(Lachnospiraceae)、瘤胃球菌科(Ruminococcaceae)、韋榮球菌科(Veillonellaceae)、梭菌科(Clostridiaceae),Bacteroidetes的普雷沃氏菌科(Prevotellaceae)、理研菌科(Rikenellaceae)、擬桿菌科(Bacteroidaceae)、紫單胞菌科(Porphyromonadaceae),Proteobacteria的腸桿菌科(Enterobacteriaceae)、產堿桿菌科(Alcaligenaceae)、弧菌科(Desulfovibrionaceae),以及Actinobacteria的雙歧桿菌科(Bifidobacteriaceae)在科的水平上相對豐度占優勢地位。

圖4 益生菌制劑對腸道菌群科水平上相對豐度的影響Fig. 4 Effect of probiotics on relative abundance of dominant families
從圖4中可以看出,受試人群在益生菌劑的干預下,便秘組的Prevotellaceae、Lachnospiraceae、Alcaligenaceae、紅蝽菌科(Coriobacteriaceae)及S24-7相對豐度在干預第4周后分別由0.23%、4.43%、2.58%、0.005%、0.03%增加至46.47%、6.50%、3.45%、0.1%、0.8%,停止干預后又降至22.01%、5.09%、3.28%、0.06%、0.29%;Bacteroidaceae、Desulfovibrionaceae和Rikenellaceae相對豐度分別由76.97%、0.085%、1.85%降至20.65%、0.023%、0.72%,停止干預后又升至50.75%、0.11%、0.83%。其中,Alcaligenaceae、Rikenellaceae、Coriobacteriaceae在向對照組(4.22%、0.58%、0.088%)靠近。腹瀉組中,受試人群中Lachnospiraceae、Alcaligenaceae、Bifidobacteriaceae、Clostridiaceae、Coriobacteriaceae、Erysipelotrichaceae的菌群相對豐度從開始干預到第4周分別由1.87%、1.73%、0.12%、0.15%、0.05%、0.07%增至4.39%、4.46%、8.65%、0.55%、0.18%、0.23%;而Veillonellaceae經益生菌劑干預后由3.06%降至2.16%。其中,Lachnospiraceae、Alcaligenaceae、Erysipelotrichaceae、Veillonellaceae向對照組(5.49%、4.22%、0.24%、2.20%)狀態調整,并且,Lachnospiraceae在干預停止后不會恢復至干預前的狀態,仍保持在4.70%左右。就其他組受試患者菌群結構而言,在益生菌劑的作用下,除Veillonellaceae有下降的趨勢外,Erysipelotrichaceae、Bifidobacteriaceae、Rikenellaceae、Odoribacteraceae、Desulfovibrionaceae、Coriobacteriaceae、S24-7都呈現增長的趨勢,其中,Enterobacteriaceae、Bifidobacteriaceae、Rikenellaceae、Odoribacteraceae、Desulfovibrionaceae分別從干預前的0.19%、0.003 3%、0.32%、0.23%、0.17%提升至1.50%、0.19%、0.59%、0.38%、0.20%,接近于對照組相對豐度(1.49%、0.12%、0.58%、0.44%、0.28%)。
2.3 關鍵菌屬的鑒定
根據上述腸道微生物整體結構的分析發現,各疾病狀態受試人群的腸道微生物多樣性與對照組具有一定程度的差異,益生菌劑的干預使得其菌群結構的組成發生了改變,為了尋找益生菌劑干預前后造成腸道微生物多樣性差異的關鍵菌屬,進一步在屬水平上進行Welch’s t-test檢驗顯著性差異,進而進行Stamp分析,發現3 組受試人群的腸道微生物經益生菌劑干預后在屬水平均有顯著不同,結果如圖5所示。

圖5 腸道菌群中關鍵菌屬的變化Fig. 5 Change of key bacterial genus in intestinal flora
從圖5中可以看出,3 組受試人群在益生菌劑干預下共有20 個關鍵菌屬存在顯著差異(P<0.05),其中,便秘組有5 個,包括擬桿菌屬(Bacteroides)、柯林斯菌屬(Collinsella)、巨單胞菌屬(Megamonas)、Odoribacter、普氏菌屬(Prevotella);腹瀉組有柔嫩梭菌屬(Faecalibacterium)、不動桿菌屬(Acinetobacter)、布勞特氏菌屬(Blautia)、梭菌屬(Clostridium)、小類桿菌屬(Dialister)、埃格特菌屬(Eggerthella)、顆粒鏈菌屬(Granulicatella)、乳桿菌屬(Lactobacillus)、草酸桿菌屬(Oxalobacter)、Pyramidobacter等10 個,其他組有5 個,即Adlercreutzia、Collinsella、克雷白氏桿菌屬(Klebsiella)、Parabacteroides和薩特氏菌屬(Sutterella)。
2.4 關鍵菌屬對腸道菌群整體結構的影響
為了探究關鍵菌屬對腸道菌群整體結構的影響,通過Stamp分析尋找到20 個關鍵菌屬,基于20 個關鍵菌屬進行PCA分析,結果如圖6所示。

圖6 PCA分析Fig. 6 PCA analysis
圖6 顯示,3 組不同健康狀態樣品均與健康對照組呈現交疊的狀態,各組樣品并不能完全分開,說明相較其他因素,益生菌劑對腸道菌群結構的調節作用較為明顯。并且,3 組樣品在X軸上的距離比較長。隨著益生菌劑干預時間的延長,便秘組關鍵菌屬由最初接近健康對照組逐漸沿著PC1(貢獻率91.26%)、PC2(貢獻率7.14%)拉開距離,在PC2方向尤為明顯,但是距離健康對照組越來越遠;腹瀉組菌屬則在益生菌劑干預第5周直至停止干預后沿PC1逐漸向對照組接近;其他組菌屬在益生菌劑干預期間向健康對照組靠近,在停止干預后并沒有繼續保持這種狀態。在PCA圖中,各組樣品隨著益生菌劑干預的時長呈現調整狀態,正是這種差異顯著的狀態,從另一層面上說明這20 個菌屬可能是造成疾病組與健康對照組受試人群腸道菌群結構差異的關鍵菌屬。
2.5 關鍵菌屬菌群相對豐度的變化
將Welch’s t-test檢驗出的存在顯著差異的20 種菌進行了相對豐度柱狀圖的繪制,如圖7顯示,在益生菌劑的干預下,便秘組Bacteroides、Prevotella、Parabacteroides的變化明顯且迅速,在干預第1周開始分別由最初的76.98%、0.23%、3.69%調整至22.18%、35.13%、18.7%,Megamonas由最初的0.005%逐漸向健康對照組(0.91%)調整,在第3周時達到1.06%,與對照組最為接近,Collinsella也在干預第3周開始出現;腹瀉組Lactobacillus和Clostridium從無到有,并且,Clostridium在第1周就達到了0.06%,與健康對照組的相對豐度相同,Lactobacillus在第4周時達到0.006 7%,與健康對照組(0.007 5%)最為接近;此外,益生菌劑具有升高Blautia降低Dialister和Faecalibacterium的作用,其中,Blautia由最初的0.003 3%升至0.05%,并且,干預停止后并沒有恢復至干預前的狀態;就其他組而言,益生菌劑對5 種關鍵菌屬具有升高的作用,Adlercreutzia在干預第1周從無到有,升高了0.005%,Collinsella、Klebsiella、Parabacteroides和Sutterella從干預開始至停止干預一直處于升高的趨勢。

圖7 益生菌制劑對腸道菌群屬水平上相對豐度的影響Fig. 7 Effect of probiotics on relative abundance of dominant genus
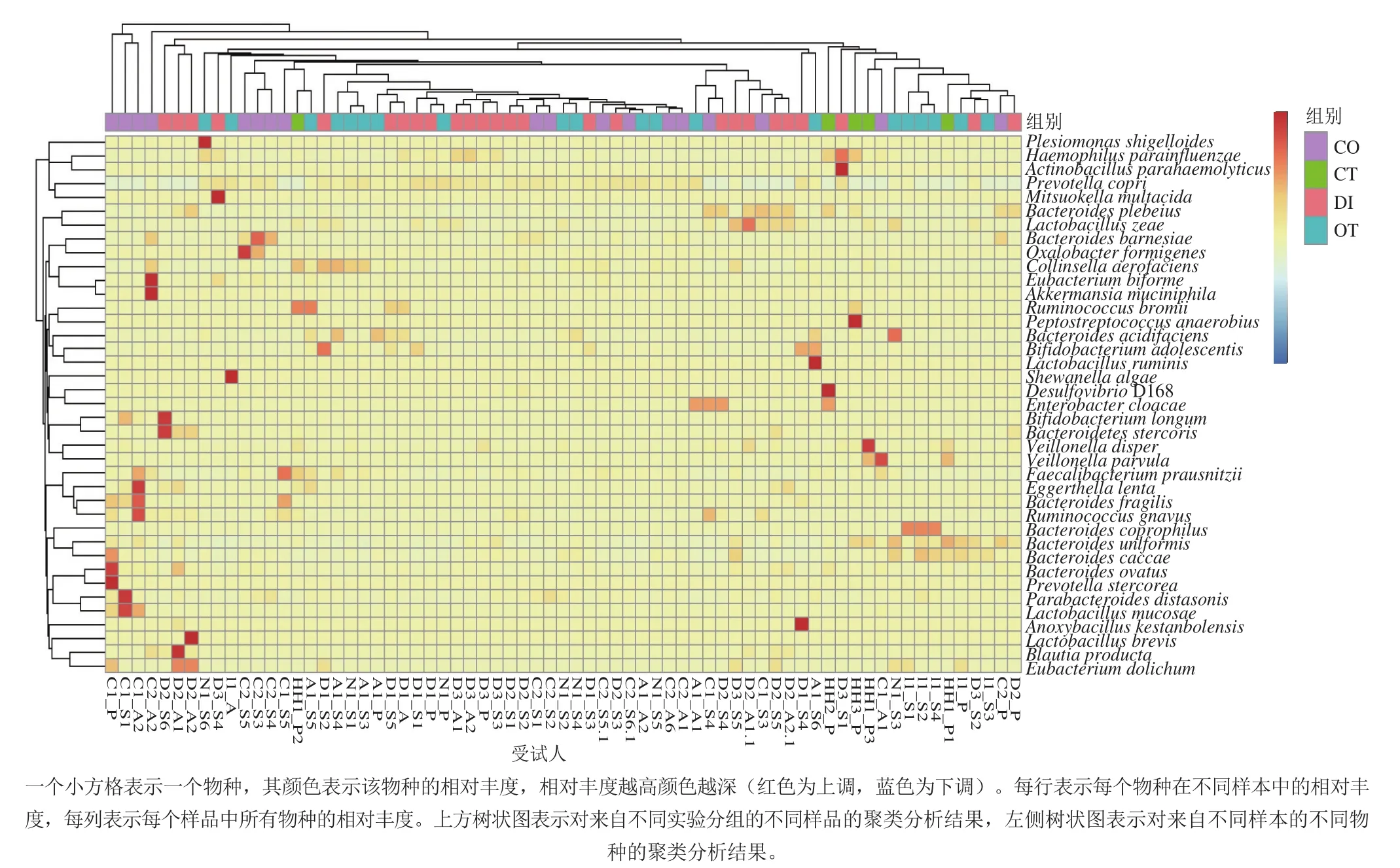
圖8 物種相對豐度聚類熱圖Fig. 8 Species abundance from clustering heatmap
2.6 益生菌劑對關鍵物種的影響
為探究益生菌劑對腸道微生物種水平的影響,對其相對豐度進行聚類,得相對豐度聚類熱圖,圖8展示了物種間的相似性和相對豐度以及樣本間的相似性。
從圖8可以看出,受試樣品多以Bacteroides為核心菌屬,說明腸型之說的存在。經益生菌劑干預,便秘組受試人群腸道中,玉米乳桿菌(Lactobacillus zeae)在干預第3周相對豐度達到最高(0.02%),超過健康對照組(0.01%)。Akkermansia muciniphila和兩形真桿菌(Eubacterium biforme)在干預停止后的第2周相對豐度最高(0.42%、0.02%),脆弱擬桿菌(Bacteroides fragilis)、柔嫩梭菌(Faecalibacterium prausnitzii)的相對豐度在第7周(16.17%、1.95%)及干預停止的第2周(11.6%、2.99%)較高,活潑瘤胃球菌(Ruminococcus gnavus)在干預第4周及干預停止的第2周相對豐度升高,由最初的0.02%增至0.04%、0.08%;此外,卵形擬桿菌(Bacteroides ovatus)和Prevotella stercorea在干預前相對豐度最高,這說明益生菌劑具有降低二者相對豐度的作用。在腹瀉組受試人群腸道菌群中,長雙歧桿菌(Bifidobacterium longum)和糞便擬桿菌(Bacteroides stercoris)在干預第6周(9.09%、0.33%)相對豐度最高,Actinobacillus parahaemolyticus和副流感嗜血桿菌(Haemophilus parainfluenzae)在干預第1周(0.12%、0.07%)時相對豐度增加明顯,Anoxybacillus kestanbolensis的相對豐度由最初不存在到第4周(0.07%)最高,短乳桿菌(Lactobacillus brevis)、Blautia producta及細長真桿菌(Eubacterium dolichum)都由最初不存在到停止干預后相對豐度達到最高(0.01%、0.03%、0.09%)。對于其他組,腹脹受試患者(A1_S6)的瘤胃乳酸桿菌(Lactobacillus ruminis)在益生菌劑干預第6周時相對豐度(0.12%)最高;腸易激綜合征患者(I1_S1、I1_S2、I1_S4)及排便不規律患者(N1_S6)的Bacteroides coprophilus在第1~6周時開始出現。
3 討 論
由于腸道微生物可以吸收宿主自身難以消化吸收的成分及分泌到腸腔中的物質,所以腸道微生物的組成會隨機體攝入的食物成分的改變而變化。也就是說,膳食結構是影響腸道菌群結構和功能最為重要的因素,不當的飲食會擾亂腸道微生物和宿主之間的穩態平衡,造成腸道菌群失調進而誘發多種腸道疾病,益生菌劑作為一種常見食品被用于調節腸道菌群結構可有效地預防甚至是治療相關疾病[14]。
本實驗通過對受試人群糞便樣本的測序和解析發現,益生菌劑對便秘、腹瀉和其他癥狀受試人群腸道菌群多樣性及物種相對豐度均有積極的調整作用,都使之向健康狀態靠近。在門水平上,各組受試人群腸道菌群以Bacteroidetes、Firmicutes、Proteobacteria、Actinobacteria為優勢菌門,與前人研究中這4 種優勢菌門達90%以上的結論[15]一致,造成腸道微生物門水平多樣性較低的原因有兩個,一方面源于宿主對胃腸道微生物組成及其功能的選擇性壓力,另一方面可能是與地球漫長的歷史相比,人類進化史相對較短而造成的[16]。但是,腸道微生物的相對豐度在益生菌劑干預期間乃至干預停止后起到了調整作用,符合Murphy等[17]得出的“改變飲食可以影響腸道微生物的結構”的結論。其中,便秘組受試人群中Bacteroidetes、Firmicutes、Proteobacteria這3 種優勢菌門在益生菌劑干預第4周時達到與對照組最接近的狀態,這說明益生菌劑能夠在較短的時間影響腸道菌群的結構。并且,在整個干預階段,Bacteroidetes的相對豐度隨著益生菌劑的干預由最初的84.27%降到44.78%;Firmicutes雖略有波動,但是總體呈上升趨勢;Proteobacteria相對豐度隨益生菌劑干預時間的延長呈先降低后升高的起伏波動狀態。這提示益生菌劑能夠降低便秘人群中起促炎作用的Bacteroidetes,升高Firmicutes的相對豐度。Cyanobacteria和Fusobacteria在益生菌劑的干預下達到了從零到0.001 7%的狀態;但是,益生菌劑停止干預后又恢復到了干預前的狀態,這也有力地支持了服用益生菌制品對腸道菌群結構以及對宿主健康狀況的作用存在短期功效的事實。同樣,益生菌劑對腹瀉組受試人群的Bacteroidetes、Firmicutes和Proteobacteria表現積極的調整作用,除Proteobacteria在干預4 周后與健康對照組(6.87%)最為接近外,其余兩種均在干預停止后保持在84.17%、8.06%,與健康對照組接近。就其他健康狀況的受試人群來說,Bacteroidetes和Firmicutes在干預第4周以及Proteobacteria和Actinobacteria在干預3周前與對照組最為接近,說明益生菌劑具有調整其他組健康狀況人群的Bacteroidetes和Firmicutes、提高Proteobacteria和Actinobacteria相對豐度的作用。但是,在停止干預后,Firmicutes、Proteobacteria及Actinobacteria并沒有保持不變而是呈現降低的狀態。以上都體現了益生菌劑一方面補充腸道的正常菌群或促進有益菌的增殖,另一方面拮抗病原菌[18]。在短期內腸道菌群相對豐度相應改變也說明腸道微生物能夠對益生菌劑的介入迅速做出反應,這可能與各菌門的代謝產物(如短鏈脂肪酸)有關,腸道微生物在腸道內將多糖降解成單糖和短鏈脂肪酸,提高能量利用效率,而短鏈脂肪酸是結腸和小腸上皮細胞的主要供能物質,能夠較強地維護腸道形態及功能,并對腸道疾病具有一定的治療作用,也是研究益生菌劑對腸道微生物影響的重要指標[19]。有報道指出,Bacteroidetes以生成乙酸和丙酸為主,而Firmicutes以生成丁酸為主[20]。Bacteroidetes首先將丙酮酸氧化成乙酰輔酶A,然后經磷酸乙酰轉移酶、乙酸激酶生成乙酸[21];此外,Bacteroidetes生成丙酮酸還可通過丙烯酸途徑形成丙酸[22]。Firmicutes首先將丙酮酸轉化成乙酰輔酶A,然后通過丁酰輔酶A的生成等一系列途徑生成丁酸[23]。乙酸和丙酸可抑制腫瘤壞死因子-α的釋放,對結腸炎有良好的治療效果;丁酸能有效抑制結腸腫瘤細胞增殖、誘導腫瘤細胞分化的凋亡、影響原癌基因的表達,從而預防和治療結腸癌[24-26]。但是,停止干預后部分腸道微生物向干預前狀態恢復的現象與Carmody等[27]提出的“腸道菌群存在一種記憶效應”之說有關,即在飲食(如益生菌劑)干預后,它的組成和代謝狀況除了依賴于當前的飲食,也少部分依賴于它之前的飲食,正如Zhang Chenhong等[28]的研究結果,這并不意味著無論如何破壞菌群結構都能使之得到恢復。
其次,就科水平而言,3 組受試人群中這些優勢菌科的相對豐度均有調整,但是,在干預第4周時部分菌科相對豐度調整較好。便秘組Alcaligenaceae、Rikenellaceae、Coriobacteriaceae由最初的2.58%、1.85%、0.005%分別調整至3.45%、0.72%、0.1%,接近于健康對照組(4.22%、0.58%、0.088%);腹瀉組Lachnospiraceae、Alcaligenaceae、Erysipelotrichaceae及Veillonellaceae由最初的1.87%、1.73%、0.07%、3.06%分別調整至4.39%、4.46%、0.23%、2.16%,接近于健康對照組(5.49%、4.22%、0.24%、2.20%);并且,Lachnospiraceae在停止干預后仍保持在4.70%左右;其他組Enterobacteriaceae、Bifidobacteriaceae、Rikenellaceae、Odoribacteraceae、Desulfovibrionaceae分別從干預前的0.19%、0.0033%、0.32%、0.23%、0.17%提升至1.50%、0.19%、0.59%、0.38%、0.20%,接近于健康對照組相對豐度(1.49%、0.12%、0.58%、0.44%、0.28%)。以上結果提示益生菌劑能夠通過提高便秘組受試人群的Alcaligenaceae和Coriobacteriaceae并降低Rikenellaceae,提高腹瀉組的Lachnospiraceae、Alcaligenaceae和Erysipelotrichaceae并降低Veillonellaceae,提高其他組Enterobacteriaceae、Bifidobacteriaceae、Rikenellaceae、Odoribacteraceae、Desulfovibrionaceae來改善病理狀態人群腸道菌群相對豐度,這可能與菌科本身所產生的代謝產物功能相關,Enterobacteriaceae、Lachnospiraceae、Veillonellaceae、Clostridiaceae以及Bifidobacteriaceae這幾個菌科與短鏈脂肪酸的產生相關,尤其是Lachnospiraceae中的Blautia、Coprococcus、Lachnospira以及Roseburia都能參與到將碳水化合物分解為短鏈脂肪酸的代謝過程中,特別是Roseburia、Blautia以及Lachnospira主要參與丁酸鹽的產生,丁酸鹽不僅是上皮細胞的能量來源,可以通過組蛋白的高度乙酰化和抑制核因子-κB信號通路來作為腸黏膜促炎細胞因子表達的抑制劑,還可以促進黏蛋白和抗菌肽的產生來增強腸屏障功能,通過直接提高緊密結合蛋白的表達來增強腸上皮細胞的完整性,影響細胞的功能和結腸的健康,具有抗癌和抗炎的潛在功能,這些菌的減少往往會引起丁酸鹽的減少,Enterobacteriaceae可能與炎癥和胰島素抵抗有關,梭菌(Clostridium)可利用多種氨基酸,相應生成多種有機酸,通過丙烯酸途徑由丙氨酸產生丁酸,也可在蘇氨酸脫水酶和酮酸脫氫酶的參與下由蘇氨酸產生丙酸[29-30]。此外,益生菌劑停止干預后各菌群相對豐度又逐漸向干預前恢復,這再次說明益生菌劑具有短期調整腸道菌群的效力。
然后,對屬水平進行Welch’s t-test檢驗及Stamp分析發現有20 個存在顯著差異的菌屬,經PCA鑒定,它們也是造成不同健康狀況組與健康對照組間存在顯著差異的關鍵菌屬,提示益生菌劑干預能夠引起20 個關鍵菌屬發生顯著變化。便秘組樣品隨著益生菌劑干預時間的延長距離健康對照組越來越遠;腹瀉組在益生菌劑干預時直至停止干預后都逐漸向健康對照組接近;其他組樣品在益生菌劑干預期間也表現向健康對照組靠近的趨勢,但是在停止干預后并沒有繼續保持這種狀態,這提示益生菌劑對腹瀉組的調整效果優于其他兩組。此外,研究結果顯示,在益生菌劑的干預下,便秘組Prevotella、Megamonas、Collinsella,腹瀉組Faecalibacterium、Acinetobacter、Blautia、Clostridium、Dialister、Eggerthella、Granulicatella、Lactobacillus、Oxalobacter、Pyramidobacter以及其他組Adlercreutzia、Collinsella、Klebsiella、Parabacteroides和Sutterella相對豐度提高,同時,便秘組Bacteroides和Odoribacter相對豐度降低,這20 個關鍵菌屬中大部分是對腸道健康有益的菌屬,但是也有病原菌,其中,Bacteroides、Faecalibacterium、Blautia是短鏈脂肪酸的產生菌屬,Faecalibacterium與抗炎相關,Collinsella與促炎作用相關,Parabacteroides和Klesbsiella是能夠引起腹腔內膜感染、腹瀉等病癥的相關致病菌,Blautia可將腸道中氣體轉化成乙酸,使氣體得以清除[31]。這提示益生菌劑能夠通過調節關鍵菌屬豐度比例來調整腸道微生物菌群結構,可能與菌屬本身及其代謝產物的抗炎、促炎作用具有密切的聯系,同時也說明菌群的多樣性與受試人群本身病理狀態有很大的相關性。
本研究對受試人群種水平的變化進行了探究發現,檢測出的腸道菌群大多屬于擬桿菌型,這與Arumugam等[32]提出的腸型之說相符;Wang Tingting等[33]采用454焦磷酸測序技術對腸道菌群16S rRNA V3分析也確定健康人群腸道中富集了普通擬桿菌和單形擬桿菌。便秘組Akkermansia muciniphila、Eubacterium biforme在第2周,Bacteroides fragilis、Faecalibacterium prausnitzii在第5周至停止,Ruminococcus gnavus在第4周及停止干預后的第2周均在益生菌劑的干預下出現,且含量分別高達0.42%、0.02%、16.17%、2.99%、0.08%,Bacteroides ovatus和Prevotella stercorea則隨干預時長降低。其中,Akkermansia muciniphila被認為是健康人體腸道中最豐富的黏液溶解細菌,其數目和乙酸鹽、丁酸鹽含量之間存在很強的相關性,在降解黏蛋白的同時會釋放乙酸、丁酸等短鏈脂肪酸,腸道中低水平的Akkermansia muciniphila可能導致黏膜層的變薄,從而導致腸道屏障功能減弱,使腸道內的毒素更容易侵入人體[34-35]。Bacteroides fragilis是人體結腸中的一個優勢菌,它通過產生獨特的莢膜多糖A改變其表面抗原性,當其含量過低時會引起腸道炎癥[36]。Faecalibacterium prausnitzii是腸道共生菌,是硬壁菌門的主要成員,能通過產丁酸鹽為腸道提供能量并發揮抗炎作用[37]。Bacteroides ovatus能夠降解人體不能代謝的植物多糖,為宿主提供來自食物的10%~15%的能量[38]。腹瀉組的Bifidobacterium longum、Bacteroides stercoris在第6周(9.09%、0.33%)、Actinobacillus parahaemolyticus在第1周(0.12%)、Anoxybacillus kestanbolensis在第4周(0.07%)、Lactobacillus brevis、Blautia producta及Eubacterium dolichum在停止干預后(0.01%、0.03%、0.09%)均出現。對于其他組而言,在益生菌劑干預下,腹脹受試患者(A1_S6)的瘤胃乳酸桿菌(Lactobacillus ruminis)在益生菌劑干預第6周(0.12%)、腸易激綜合征患者(I1_S1、I1_S2、I1_S4)及排便不規律患者(N1_S6)的Bacteroides coprophilus在第1~6周時開始出現,這提示益生菌劑具有短期調控菌群多樣性及相對豐度的作用,并且通過菌群的代謝產物的有益作用達到益生功能。由于這些菌種含量過低不易檢測,再加上益生菌劑對于單個菌種的持續作用并不明顯,再次印證了益生菌劑干預下種水平的不顯著變化可能與受試人群的病理狀態有關。此外,對一些機制不明的菌有待進一步研究。
4 結 論
本研究通過對不同健康狀況受試人群施于益生菌劑的干預,采集糞便,利用Ion Torrent PGM測序技術和多變量統計學方法分析得知,益生菌劑對受試人群腸道微生物多樣性均有不同程度的調整作用。益生菌劑能夠降低便秘人群Bacteroidetes、Rikenellaceae,升高Firmicutes、Alcaligenaceae、Coriobacteriaceae的相對豐度,提高腹瀉人群Proteobacteria、Alcaligenaceae、Lachnospiraceae、Erysipelotrichaceae并降低Veillonellaceae,提高健康狀況人群Proteobacteria、Actinobacteria、Enterobacteriaceae、Bifidobacteriaceae、Rikenellaceae、Odoribacteraceae、Desulfovibrionaceae,使其相對豐度向健康人群靠近。并且,益生菌劑在屬水平上對腹瀉組的調整效果優于其他兩組。重要的是,Akkermansia muciniphila、Bacteroides fragilis及Faecalibacterium prausnitzii等的相對豐度有不同程度的提高,這些菌的出現將對維護宿主健康具有價值。因此本研究認為,益生菌劑能起到改變腸道微生物多樣性的功效,可以通過調整關鍵菌群間的豐度比例起到抑制腸道有害微生物生長、促進部分有益菌的增殖并維持腸道菌群結構穩態的作用,進一步明確了利用益生菌劑調節和恢復便秘、腹瀉人群腸道健康具有科學價值。

