大鼠背根神經節細胞中TRPV1與cAMP/PKA通路調控機制研究
高 峰,盧偉龍,王華林,吳媛媛,王 斌,李 敏
(陜西中醫藥大學藥學院,陜西 西安 712000)
瞬時受體電位通道(transient receptor potential canonical,TRP)是一類重要的陽離子通道。辣椒素受體(transient receptor potential vanilloid 1,TRPV1)是TRP家族通道蛋白之一,為熱敏感蛋白,可被高于42℃的溫度、炎癥、疼痛、辣椒素等體內多種因素激活[1-2],主要存在于中樞神經系統及末梢神經系統上。TRPV1目前在疼痛、炎癥、中醫寒熱病證、中藥寒熱藥性等方面有重要意義[3-4]。TRPV1蛋白后期的磷酸化對其功能的發揮至關重要,有研究表明,cAMP/PKA通路可促進TRPV1的磷酸化,使其激活[5-6]。另有研究發現,TRPV1活化后,促進cAMP含量升高[3],兩者之間的調控作用尚不明確。課題組前期研究表明,體內cAMP/PKA信號通路的磷酸化水平與TRPV1的蛋白表達有一定相關性[7]。因此,本研究通過體外細胞實驗,分別應用兩者的激動劑和抑制劑干預,進一步探討TRPV1與cAMP/PKA信號通路之間的調控作用。
1 材料
1.1實驗動物新生大鼠購自第四軍醫大學實驗動物中心,動物合格證號:SCXK(軍)2012-0007。
1.2試劑胎牛血清(fetal bovine serum,FBS)、DMEM/F12培養基購自Hyclone;TRIzol(貨號15596-026)購自無錫菩禾;逆轉錄試劑盒(貨號#K1622)購自Thermo公司;cAMP/PKA信號通路激動劑8-Br-cAMP(貨號ab141449)、抑制劑H-89(貨號ab143787)、TRPV1激動劑辣椒素capsaicin(貨號ab140100)、抑制劑i RTX(貨號ab146031),均購自Abcam公司。
1.3儀器Thermo Scientific 8000細胞培養箱(美國賽默飛世爾公司);XDS-1A光學顯微鏡(上海精密儀器儀表有限公司);DMI3000B倒置拍照顯微鏡、TCS SP5 II共聚焦顯微鏡(德國Leica公司);ABI-7500 Real-time檢測儀(ABI公司);Mini protean 3 cell電泳儀(美國Bio-Rad公司);ChemiScope一體式化學發光成像儀(上海勤翔科學儀器有限公司)。
2 方法
2.1大鼠背根神經節(dorsalrootganglion,DRG)細胞的分離與鑒定參考文獻[8],新生大鼠注射15%水合氯醛處死,放入低溫的DMEM不完全培養液,大鼠死后,快速分離脊髓,摘取DRG并剪碎,放入含膠原酶的DMEM/F12培養基中60~90 min。再置于含0.125%胰蛋白酶的磷酸緩沖鹽 (phosphate buffer saline,PBS)溶液中15 min。用含10% FBS的DMEM/F12培養基終止消化,獲取的細胞接種于神經細胞完全培養基中,d 2換液繼續培養。細胞傳代24 h,4%多聚甲醛固定,加入神經元特異性烯醇化酶(neuron-specific enolase,NSE),室溫封閉15 min。加入對應二抗,37℃孵育1 h,洗滌,Hoechst 33258染液,室溫避光孵育30 min。細胞于熒光顯微鏡下觀察,隨機計數10個視野中細胞總數和β-tubulin Ⅲ的染色陽性細胞數,計算百分比,表示細胞純度。
2.2MTT法檢測8-Br-cAMP、H-89、capsaicin、iRTX對大鼠DRG細胞的影響大鼠DRG細胞生長至對數生長期,以5×107·L-1濃度接種至24孔細胞培養板,37℃、5% CO2培養24 h。分為正常對照組、8-Br-cAMP組(200、100、50、25、12.5、6.25 μmol·L-1)、H-89組(160、80、40、20、10、5 μmol·L-1)、capsaicin組(80、40、20、10、5、2.5 μmol·L-1)、i RTX組(16、8、4、2、1、0.5 μmol·L-1),分別加入含藥的無血清培養基,每孔加100 μL,設4個復孔,培養48 h,每孔加MTT溶液 20 μL,孵育4 h,終止培養,小心吸棄孔內培養上清液。每孔加150 μL DMSO,微量振蕩器振蕩10 min,使結晶物充分溶解,選擇570 nm波長,酶標儀測定各孔光吸收值。
2.38-Br-cAMP、H-89、capsaicin、iRTX對大鼠DRG細胞TRPV1、p-PKA作用研究大鼠DRG細胞以5×107·L-1濃度,接種于12孔板,分正常對照組(control)、8-Br-cAMP 50 μmol·L-1組、H-89 20 μmol·L-1組、capsaicin 25 μmol·L-1組、i RTX 2 μmol·L-1組,每組設4 個復孔,重復3次,培養48 h 后收集細胞,檢測TRPV1、p-PKA基因、蛋白表達。
2.48-Br-cAMP、H-89、capsaicin、iRTX對大鼠DRG細胞TRPV1、p-PKAmRNA表達的影響定量PCR檢測TRPV1、p-PKA mRNA,所需的引物序列見Tab 1。①RNA的抽提;②逆轉錄cDNA:逆轉錄反應體系的配制;將試劑盒從-80℃冰箱取出,復溶,將5×逆轉錄buffer、dNTPs、 oligo(d T) 10 000 r·min-1,數秒。將經過稀釋后的RNA樣本進行定量PCR檢測。mRNA表達的數據采用儀器自帶軟件ABI Prism 7500 SDS Software分析。PCR擴增后,實時熒光定量PCR儀自動分析結果,根據陰性對照調整閾值和基線以確定各標本的Ct值,并根據熔解曲線確定該Ct值是否有效。將結果導出,采用2-△△CT法分析目的基因在對照組和各濃度組之間的表達差異,計算公式如下:△Ct= Ct目的基因-Ct內參,再求得對照組△Ct的平均值,記為△Ct對照平均,用各組的△Ct分別減去△Ct對照平均,求得△△Ct值,即△△Ct=△Ct樣本-△Ct對照平均,再計算各組2-△△CT值,即為各組中基因的相對表達量。

Tab 1 Required primer sequence
2.58-Br-cAMP、H-89、capsaicin、iRTX對大鼠DRG細胞TRPV1、p-PKA蛋白表達的影響收集細胞,每組分別加入500 μL的RIPA裂解液,并加入適量的PMSF,置冰上裂解2 h;4℃、12 000 r·min-1離心10 min;移上清于新的EP管中,進行蛋白質定量后貯存于-20℃冰箱。蛋白定量后,SDS-PAGE電泳、轉膜。膜用5%脫脂奶粉室溫封閉1 h。抗體加入封閉液中稀釋到所需濃度,4℃孵育過夜。TBST洗滌3次,每次10 min。加入相應二抗,與膜37℃孵育1 h。用TBST洗滌3次,每次10 min。顯色,一體式化學發光儀拍攝照片。蛋白表達水平用目的條帶積分吸光度值(integrated absorbance,IA) 與內參 β-actin條帶的 IA 比值表示。

3 結果
3.1DRG神經元形態學特征Fig 1相差顯微鏡觀察,可見DRG細胞神經元胞體有一定透亮度和折光性,突起分支十分茂密,可見少量神經膠質細胞及細胞碎片,少量非神經元細胞核。DRG神經元純度結果顯示,DRG神經元β-tubulin Ⅲ陽性細胞比例達到81%,細胞分離培養效果良好。
3.28-Br-cAMP、H-89、capsaicin、iRTX對大鼠DRG細胞的影響由Tab 2可知,與正常對照組比較,8-Br-cAMP 200 μmol·L-1、H-89 160 μmol·L-1、capsaicin 200 μmol·L-1、i RTX 16、8 μmol·L-1使細胞增殖明顯降低(P<0.05,P<0.01),故選擇8-Br-cAMP 50 μmol·L-1、H-89 20 μmol·L-1、capsaicin 25 μmol·L-1、i RTX 2 μmol·L-1對細胞沒有損害的濃度作為后續實驗濃度。
3.38-Br-cAMP、H-89、capsaicin、iRTX對TRPV1、p-PKAmRNA表達的影響Tab 3結果顯示,與正常對照組比較,8-Br-cAMP、capsaicin可明顯促進TRPV1 mRNA的表達(P<0.01),i RTX可明顯降低TRPV1 mRNA表達(P<0.01),H-89對TRPV1 mRNA表達的影響不明顯;8-Br-cAMP可促進p-PKA mRNA的表達,H-89可降低p-PKA mRNA表達(P<0.05);capsaicin、i RTX對p-PKA mRNA表達的影響不明顯。

Fig 1 Dorsal root ganglion cells of rats(scale bar=50 μm)

Tab 2 Cell proliferation rate in each
*P<0.05,**P<0.01vscontrol

Tab 3 Expression of TRPV1 and p-PKA mRNA
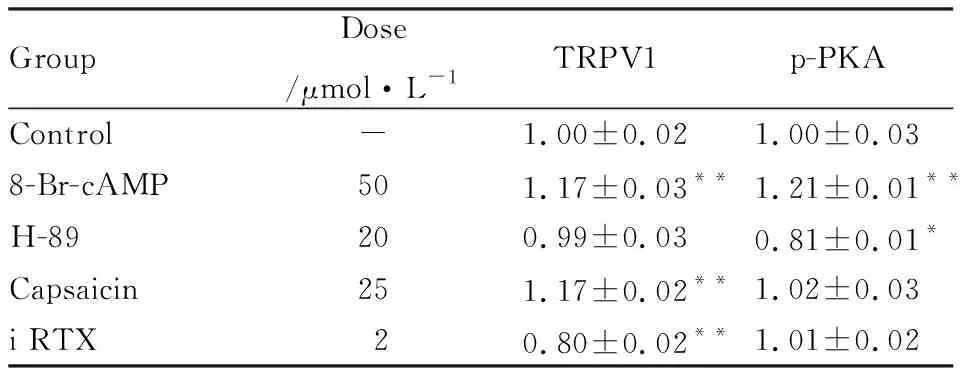
GroupDose/μmol·L-1TRPV1p-PKAControl-1.00±0.021.00±0.038-Br-cAMP501.17±0.03**1.21±0.01**H-89200.99±0.030.81±0.01*Capsaicin251.17±0.02**1.02±0.03i RTX20.80±0.02**1.01±0.02
*P<0.05,**P<0.01vscontrol
3.48-Br-cAMP、H-89、capsaicin、iRTX對p-PKA、TRPV1蛋白表達的影響與正常對照組比較,8-Br-cAMP、capsaicin可明顯促進TRPV1蛋白的表達(P<0.01),i RTX可明顯降低TRPV1蛋白表達(P<0.05),H-89對TRPV1蛋白表達的影響不明顯;8-Br-cAMP可促進p-PKA蛋白的表達,H-89可降低p-PKA蛋白表達,差異均有統計學意義(P<0.05);capsaicin、i RTX對p-PKA蛋白表達的影響不明顯(Fig 2)。
4 討論
TRP是一類重要的陽離子通道,在TRP通道中,感受溫度變化及參與體溫調節的有多個家族和通道蛋白,其中熱敏感通道蛋白TRPV1分布廣泛,是具有多功能的細胞感受器。TRPV1可被體內外多種物理化學因素激活,如傷害性熱刺激、低pH值(酸性環境)、炎癥、疼痛、辣椒素等。在疼痛的感知與調節、體溫感知與調節、炎癥的發生及中醫寒熱病證、中藥寒熱藥性等方面研究中,TRPV1起著重要作用[7]。因此,探討TRPV1體內的調控機制,有非常重要的意義。在TRPV1的活化中,磷酸化起著重要作用。Schnizler等[9]證實,PKA磷酸化作用增敏TRPV1通道由A激酶錨定蛋白AKAP150 所介導。Bhave等[10]在轉染TRPV1的cos7細胞中,給予辣椒素連續刺激后,產生急性脫敏現象;用8-Br-cAMP溫育cos7細胞后,再給予辣椒素刺激,無急性脫敏現象;將PKA抑制劑與8-Br-cAMP一起溫育cos7細胞,辣椒素刺激后,脫敏現象重新出現。還有研究表明,TRPV1的增強可促進cAMP的含量。可見cAMP/PKA信號通路引發的細胞磷酸化與TRPV1活化之間關系密切,TRPV1生理病理功能與cAMP/PKA通路的調控相關聯。課題組前期研究表明,辛熱藥提高虛寒機體TRPV1活性同時,可上調機體cAMP/PKA信號通路。本實驗從體外進一步探討體內cAMP/PKA信號通路與TRPV1的調控關系,對TRPV1相關病癥的研究有重要作用。

Fig 2 Expression of p-PKA, TRPV1 in different groups
1: Control;2: 8-Br-cAMP(50 μmol·L-1);3: H-89(20 μmol·L-1);4: Capsaicin(25 μmol·L-1);5: i RTX(2 μmol·L-1).*P<0.05,**P<0.01vscontrol.
實驗中采取膠原酶、胰酶消化分離DRG細胞的方法較為成熟,分離出的細胞形態較為完整,活性較強,純度較高。應用cAMP/PKA通路激動劑8-Br-cAMP、抑制劑H-89和TRPV1的激動劑辣椒素、抑制劑i RTX進行干預。實驗結果表明,8-Br-cAMP 和H-89可明顯上調或降低p-PKA基因、蛋白表達;capsaicin、i RTX可明顯上調或降低TRPV1基因、蛋白表達;capsaicin、i RTX對p-PKA基因、蛋白的表達無明顯影響,8-Br-cAMP可促進TRPV1的基因、蛋白的表達,H-89則對TRPV1的基因、蛋白的表達無明顯影響。可見,TRPV1的激活或抑制對cAMP/PKA信號通路無明顯影響,而cAMP/PKA信號通路激活可活化TRPV1,cAMP/PKA信號通路抑制時,對TRPV1基因、蛋白表達影響不大,可能除了cAMP-PKA信號通路可調控TRPV1的表達外,還存在其他信號通路對TRPV1也有一定調控作用,具體的調控機制還需在后期進一步深入研究。
(致謝:本實驗在陜西中醫藥大學醫學實驗中心完成,感謝參與完成實驗的課題組成員。)

