實驗室克侖特羅殘留檢測方法比對
(北京市朝陽區動物疫病預防控制中心,北京 100018)
2006年9月17日,上海連續發生“瘦肉精”食物中毒事故,波及全市9個區、300多人。
2011年3月15日“雙匯瘦肉精”事件曝光至23日18時,查獲含“瘦肉精”飼料若干批次。
“瘦肉精”是一類動物用藥,而不是一種特定的物質,是指能夠促進瘦肉生長的飼料添加劑,有數種藥物被稱為瘦肉精,例如鹽酸克侖特羅、萊克多巴胺、沙丁胺醇等能夠實現這種功能的物質,又叫作β-興奮劑的藥物,將瘦肉精添加于飼料中,可以增加動物的瘦肉量、抑制肥肉生長、減少飼料使用、使肉品提早上市、降低成本,但在組織和內臟中殘留量很大。
我中心實驗室肩負著讓全區老百姓吃上“放心肉”的重要責任,作為“菜籃子工程”的第一道安全防線,我們有必要努力追求工作的質量與效率,自從2009年開展了克侖特羅的實驗室初篩檢測,經過比對與篩選,2012年復認證時最終選定了北京維德維康生物技術有限公司生產的克侖特羅快速檢測卡(Ⅱ型)和萊克多巴胺酶聯免疫試劑盒(三合一)。并于2013年底購置一臺液相色譜串聯質譜儀(島津20A+AB的API5000),積極學習與開展,在2015年6月通過實驗室計量認證成功擴項,使我實驗室實現了克侖特羅藥物殘留檢測從初篩到定性確證的整套流程。日常監測中時有出現的陽性樣品,使我統計了檢測數據進行比對,并自己設計了實驗計劃,對目前可以開展的三項不同的檢測手段進行準確性和可信度比較,從我實驗室角度分析了幾種檢測手段臨床使用的可行性和適用性,以及給出的檢測結果的臨床參考意義。
1 檢測方法詳解
1.1 膠體金免疫層析法
1.1.1 原理
利用競爭法膠體金免疫層析技術,檢測卡含有被事先固定于硝酸纖維素膜測試區(T)的抗原和控制區(C)的Ⅱ抗,以及固定于結合墊上的金標抗體。檢測液中的Clen與金標墊上的金標抗體結合形成復合物,若Clen在檢測液中濃度低于靈敏度值,未結合的金標抗體流到T區時,被固定在膜上的Clen-BSA偶聯物結合,逐漸凝集成一條可見的T線;若Clen濃度高于靈敏度值,金標抗體全部形成復合物,不會再與T線處Clen-BSA偶聯物結合形成可見T線。未固定的復合物流過T區被C區的二抗捕獲并形成可見的C線。C線出現則表明免疫層析發生,即試紙有效。
以我實驗室使用的北京維德維康生物技術有限公司生產的克侖特羅快速檢測卡(Ⅱ型)為例。
1.1.2 檢測步驟
(1)使用前將試劑板和待檢樣本溶液恢復至室溫。
(2)取5g勻漿去脂肉樣于50mL離心管中,放入沸水中加熱10min,用微量移液器或滴管取出管中液體移至干凈離心管中,冷卻至室溫(注意:樣品溫度應控制在20±5℃!)。
(3)取出檢測卡,平放于桌面,使用本產品自帶的滴管,吸取離心管中的上清液加3~4滴于樣品孔中。
(4)加樣后3~5min,觀察顯色區,判斷結果,其他時間判斷無效。
結果判讀:陽性(+):僅質控區(C)出現一條紫紅色條帶。在測試區(T)內無紫紅色條帶出現。
陰性(-):兩條紫紅色條帶出現。一條位于測試區(T)內,另一條位于質控區(C)內。
無效:質控區(C)未出現紫紅色條帶,無論測試區(T)內有無紫紅色條帶出現,都提示測試失敗或試紙已失效。
1.2 酶聯免疫吸附法(ELISA)
1.2.1 原理
利用免疫學抗原抗體特異性結合和酶的高效催化作用,通過化學方法將植物辣根過氧化物酶(HRP)與克侖特羅(CL)結合,形成酶偶聯克侖特羅。將固相載體上已包被的抗體與特異性的抗克侖特羅抗體結合,然后加入待測克侖特羅和酶偶聯克侖特羅,它們競爭性與克侖特羅抗體結合,洗滌后加底物,根據有色物的變化計量待測克侖特羅量。若待測克侖特羅多,則被結合的酶偶聯克侖特羅少,有色物量就少。用目測法或比色法測定樣品中的克侖特羅含量,比色的最佳波長為450 nm,參比波長應大于600 nm。
以我實驗室使用的北京維德維康生物技術有限公司生產的萊克多巴胺酶聯免疫試劑盒(三合一)為例。
1.2.2 檢測步驟
(1)試劑
①組織稀釋液:稱取1g三氯乙酸,加入100ml去離子水充分溶解。
②1M氫氧化鈉溶液:稱取4g氫氧化鈉加入去離子水溶解并定容至100ml。
③0.5M氫氧化鈉溶液:稱取2g氫氧化鈉加入去離子水溶解并定容至100ml。
④0.1M鹽酸溶液:量取0.86ml濃鹽酸并用去離子水定容至100ml。
⑤洗滌工作液:用去離子水按1份濃縮洗滌液+19份去離子水稀釋。
(2)樣品前處理
①準確稱取2±0.01g勻質后的樣品于50ml離心管中;
②加入3mL洗滌工作液,再加3ml組織稀釋液,高速渦旋1min;
③離心機4000g以上離心5min;
④取1ml中間層清液于新的離心管中(注意:避免取到上、下層固體,否則影響檢測結果!);
⑤加入40μl0.5M氫氧化鈉溶液,渦旋10s混勻;
⑥離心機4000g以上離心5min;
⑦取20μl樣液進行檢測。
(3)檢測
將所需的酶標板條插入酶標板架上,并記錄下各標準品和樣品的位置;
將40μl各標準品工作液分別加入對應的標準品孔中;
先將20μl樣品稀釋液加入樣品孔中,再加入20μl待測樣品液;
配制酶標記物工作液:按1份酶標記物濃縮液+10份酶標記物稀釋液的體積比混合,輕柔混勻。室溫(25±2℃)平衡20~30min(注意:操作中應嚴格控制該步驟時間,即工作液平衡20~30min后立即使用!!);
在每孔中加入60μl酶標記物工作液;
蓋好蓋板膜,輕輕振蕩10s,充分混勻,室溫(25±2℃)避光反應30min;
揭開蓋板膜,倒掉板孔中液體,每孔加入260μl洗滌工作液,充分洗滌4次,每次浸泡15~30s;
倒掉板孔中液體,將酶標板倒置于吸水紙上,拍干;
立即在每孔中加入100μl底物A、B混合液(注意:底物A液、底物B液按體積1:1混合,混合液在5min內使用,避免使用金屬盛裝、攪拌試劑!);
蓋好蓋板膜,輕輕振蕩酶標板10s,充分混勻,室溫(25±2℃)避光反應15~20min;
揭開蓋板膜,板孔中加入50μL終止液,輕輕振蕩酶標板10s,充分混勻;
用酶標儀在雙波長450nm、630nm下檢測吸光度,在5min內讀取檢測數據。
1.3 液相色譜-質譜/質譜法(HPLC-MS/MS)
1.3.1 外標法
原理:
試樣中的殘留藥物經酶解,用高氯酸調pH值后高速離心沉淀蛋白,上清液調pH值后分別用乙酸乙酯和叔丁基甲醚提取,再用MCX固相萃取柱凈化,液相色譜-串聯質譜法測定。
以我實驗室認證的《農業部1025號公告-18-2008動物源性食品中β-受體激動劑殘留檢測液相色譜-串聯質譜法》為例。該檢測方法為外標法。
本標準適用于豬肝、豬肉、牛奶和雞蛋中克侖特羅、萊克多巴胺、沙丁胺醇、特布他林等9種β-受體激動劑單個或混合物殘留量的檢測。
1.3.2 檢測步驟
(1)樣品的制備:
取適量新鮮或冷凍的豬肉,絞碎并勻質,儲存于-20℃以下備用。
(2)制備試料:
取勻質的供試料品作為供試試料;
取勻質的空白樣品作為空白試料;
取勻質的空白樣品,添加適宜濃度的標準工作液作為空白添加試料。
(3)酶解:
準確稱取勻漿樣品2.00g于50mL離心管內,加入0.2mol/L乙酸銨溶液(pH=5.2)8.0ml,再加入β-鹽酸葡萄糖醛苷酶40μl,渦旋混勻,于37℃避光恒溫振蕩16h。
(4)提取:
酶解后放置至室溫,渦旋混勻,10000r/min離心10min,轉移上清液于另一50ml離心管中,加入高氯酸溶液5mL,渦旋混勻,用高氯酸調pH至1.0±0.2,10000r/min離心10min,轉移上清液于另一50ml離心管中。用氫氧化鈉溶液調pH至9.5±0.2,加入乙酸乙酯15ml,渦旋混勻,振蕩10min,5000r/min離心5min,取上層有機相至另一離心管中,再在下層水相中加入叔丁基甲醚10mL,渦旋混勻振蕩10min,5000r/min離心5min,合并有機相,50℃平行蒸發至干,用甲酸水溶液5mL溶解,備用。
(5)凈化:
MCX固相萃取柱依次用甲醇、2%甲酸水各3mL活化,取備用液全部過柱,再依次用2%甲酸水、甲醇各3mL淋洗,抽干,用3%氨水甲醇2.5ml洗脫,在50℃下氮氣吹干,殘留物用甲醇+0.1%甲酸溶液(10+90,V/V)0.2ml溶解,渦旋混勻,樣液經0.2μm針孔過濾器過濾后供液相色譜-串聯質譜測定。
(6)液相色譜-串聯質譜條件:
色譜柱:BEH C18柱,50 mm×2.1mm(i.d.),粒度1.7μm。
流動相:A相:0.1%甲酸乙腈溶液;B相:0.1%甲酸水溶液。
梯度洗脫:0~2min,維持4%A;2-12min,4%A線性變化至60%A;12~12.1min,60%A線性變化至4%A;12.1~16min,維持4%A。
流速:0.3ml/min。
進樣量:10μl。
柱溫:30℃。
離子源:電噴霧ESI正離子。
掃描方式:多反應監測MRM。然后以30℃/min升至260℃,保持1min,再以20℃/min升至280℃,保持2min,直至樣品的組分全部流出。
監測離子對:克侖特羅m/z 277.1-202.8(定量離子)、277.1-258.9(定性離子);
(7)質譜分析:在上述工作條件下,通過儀器工作軟件繪制標準曲線,以色譜峰面積定量。
(8)液相色譜-串聯質譜確證:
取試料溶液和空白添加標準溶液,做單點或多點校準,外標法計算,即得。試料溶液及空白添加標準溶液中目標化合物的峰面積均應在儀器檢測的線性范圍之內。試料溶液中的離子相對豐度與空白添加標準溶液中的離子相對豐度相比,符合允許偏差范圍,方可確定為同一物質。

相對離子豐度 >50% >20-50% >10-20% ≤10%允許的相對誤差 ±20% ±25% ±30% ±50%
(9)準確度:本方法在0.25μg/kg~2μg/kg添加濃度范圍內,用空白添加校準校正,其回收率范圍為70%~120%。
(10)結果判定:
β-受體激動劑液相色譜-串聯質譜檢測法的方法檢出限為0.25μg/kg,定量限為0.5μg/kg,判定檢測結果大于0.5μg/kg時為陽性。
1.4 內標法
1.4.1 原理
試樣中的殘留藥物經酶解,用高氯酸調節pH值,沉淀蛋白后高速離心,上清液用異丙醇-乙酸乙酯提取,再用陽離子交換柱凈化,液相色譜-串聯質譜法測定,內標法定量。
以我實驗室使用的《GB/T 22286-2008動物源性食品中多種β-受體激動劑殘留量的測定液相色譜串聯質譜法》為例。該檢測方法為內標法。
本標準適用于豬肝和豬肉中克侖特羅、萊克多巴胺、沙丁胺醇、特布他林等11種β-受體激動劑殘留量的檢測。
1.4.2 檢測步驟
參照外標法檢測步驟,僅區別于外標法檢測步驟2.4提取之前添加100μl的10ng/ml的內標工作液于待測樣品中。
2 檢測結果比對
2.1 日常監測數據比對
從2015年8月至2017年3月,快速檢測卡初篩檢測2260份畜禽組織樣品,陽性檢出52份;ELISA試劑盒檢測1080份重合畜禽組織樣品(包含初篩52份可疑樣品),陽性檢出32份;液相色譜串聯質譜法檢測185份重合畜禽組織樣品(包含初篩52份可疑樣品),陽性檢出31份。

與確證結果不符快速檢測卡 160 9 16 6 ELISA試劑盒 80 3 22 0液相色譜串聯質譜法 22 3 —— ——2015年 樣品數量 陽性樣品 與確證結果相符與確證結果不符快速檢測卡 1500 39 119 12 ELISA試劑盒 800 28 130 1液相色譜串聯質譜法 131 27 —— ——2016年 樣品數量 陽性樣品 與確證結果相符
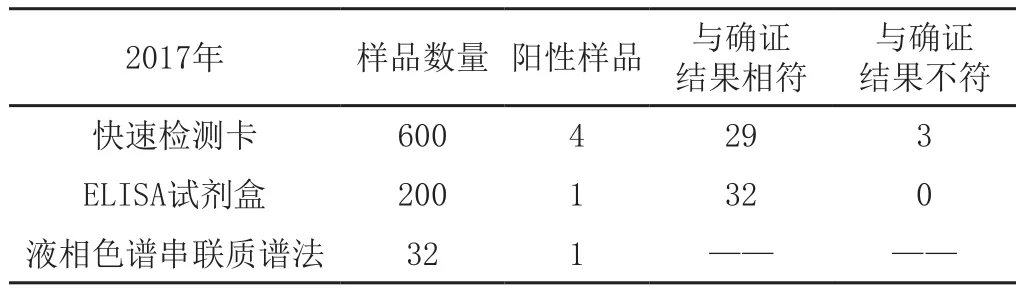
2017年 樣品數量 陽性樣品 與確證結果相符與確證結果不符快速檢測卡 600 4 29 3 ELISA試劑盒 200 1 32 0液相色譜串聯質譜法 32 1 —— ——
2.2 實驗設計數據比對
運用三種檢測手段,對1倍檢出限添加,2倍檢出限添加,5倍檢出限添加,10倍最高檢出限添加結果進行比對。
2.3 優化確證方法數據比對
3 數據比對結論
3.1 日常監測數據比對結論
經過三年對日常監測數據的統計分析,快速檢測卡初篩檢測陽性檢出率為2.3%,與定量確證結果符合率為59.6%;ELISA試劑盒檢測陽性檢出率為2.9%,與定量確證結果符合率為99.5%;快速檢測卡初篩與ELISA試劑盒檢測結果符合率為61.5%。據此可以看出,快速檢測卡的假陽性率比較高,基本不會疏漏陽性樣品,但操作簡單,日常監測中可以作為有效的初篩手段;ELISA試劑盒檢測準確率較高,經過方法認證后可以作為日常監測的主要檢測手段;液相色譜串聯質譜檢測法是目前我實驗室具有的最終確證手段,可以達到準確定量的目的,但檢測過程比較煩瑣,日常進行合理的質量控制,對可疑樣品進行確證即可。
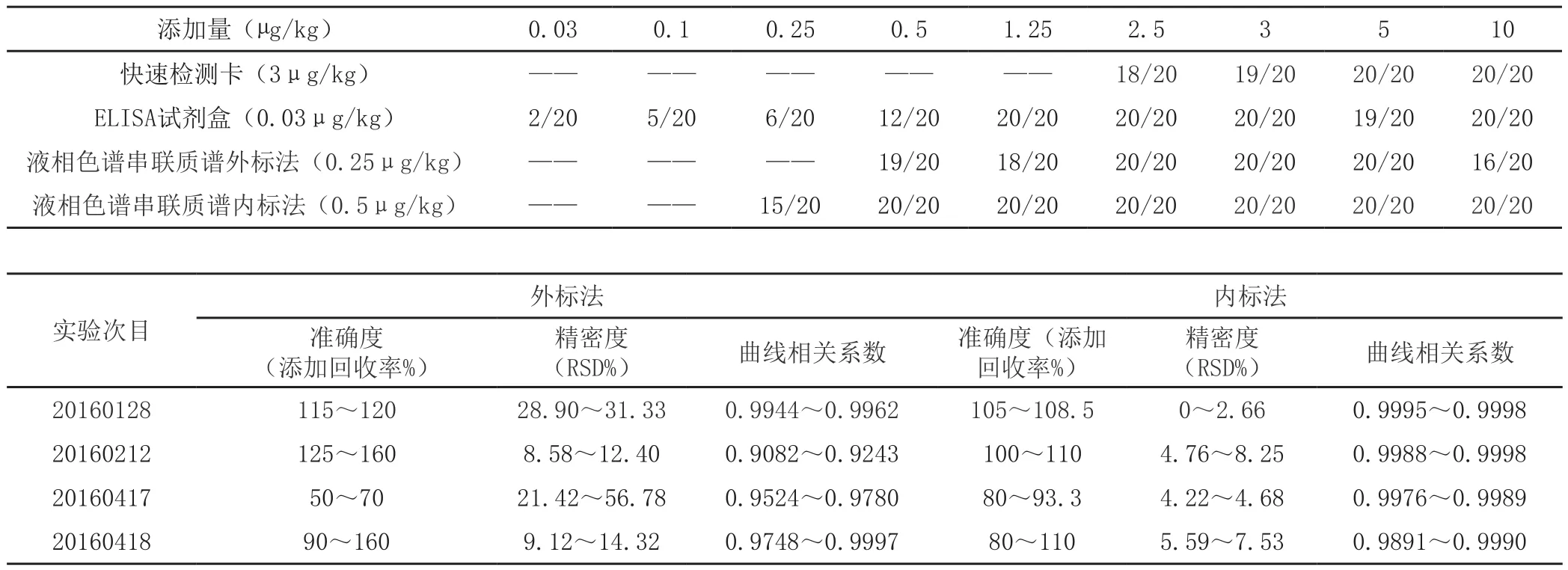
添加量(μg/kg) 0.03 0.1 0.25 0.5 1.25 2.5 3 5 10快速檢測卡(3μg/kg) —— —— —— —— —— 18/20 19/20 20/20 20/20 ELISA試劑盒(0.03μg/kg) 2/20 5/20 6/20 12/20 20/20 20/20 20/20 19/20 20/20液相色譜串聯質譜外標法(0.25μg/kg) —— —— —— 19/20 18/20 20/20 20/20 20/20 16/20液相色譜串聯質譜內標法(0.5μg/kg) —— —— 15/20 20/20 20/20 20/20 20/20 20/20 20/20外標法實驗次目內標法準確度(添加回收率%)(RSD%)曲線相關系數準確度(添加回收率%)精密度精密度(RSD%) 曲線相關系數20160128 115~120 28.90~31.33 0.9944~0.9962 105~108.5 0~2.66 0.9995~0.9998 20160212 125~160 8.58~12.40 0.9082~0.9243 100~110 4.76~8.25 0.9988~0.9998 20160417 50~70 21.42~56.78 0.9524~0.9780 80~93.3 4.22~4.68 0.9976~0.9989 20160418 90~160 9.12~14.32 0.9748~0.9997 80~110 5.59~7.53 0.9891~0.9990
3.2 實驗設計數據比對結論
經過對520份添加樣品進行4種不同方法,不同添加濃度區間進行比對。快速檢測卡初篩檢測符合率為98.3%,ELISA試劑盒檢測符合率為68.9%,液相色譜串聯質譜外標法檢測符合率為94.2%,液相色譜串聯質譜內標法檢測符合率為100%。據此可以看出,可能由于技術手段的原因,ELISA試劑盒檢測無法達到說明書推薦的檢出限,其余各種檢測方法在推薦檢測區間的檢測結果準確率非常高,臨床實踐運用中毋庸置疑。
3.3 優化確證方法數據比對結論
通過多次實驗結果準確度和精密度的比對,可以清楚地判斷β-受體激動劑的液相色譜-串聯質譜檢測的內標法優于外標法。內標法靈敏度高,定性準確,可以更有效地保證準確性的穩定性,精密度的一致性,同時保證校正曲線的相關系數達到實驗的要求,在一定程度上保證實驗有效,出具結果準確,因此,我們在臨床實驗中推薦將β-受體激動劑的液相色譜串聯質譜檢測外標法改進為內標法。
4 結語
通過實驗設計數據和日常監測數據綜合比對結果我們發現,ELISA試劑盒檢測我中心實驗室可操作檢出限需要提高到0.5μg/kg,說明日常監測出的可疑陽性樣品中克侖特羅殘留量一般高于該數值。而想真正達到較低的檢出限水平,目前我實驗室可操作的最好方法就是液相色譜串聯質譜檢測內標法。
目前,HPLC,GC/MS,CE方法對β-興奮劑的檢出限均在0.5μg/kg左右,并且檢測過程耗時長,必須由專業人員操作,所用儀器價格昂貴,不能進行現場檢測。而ELISA法檢出限可在0.03μg/kg,但也存在假陽性的問題,也不能現場檢測。如果能找到一種檢測耗時短、準確度高、靈敏度高、自動化水平高,無須專業人員操作的檢測方法將具有廣闊的應用前景[3]。

