復(fù)雜鉬礦加壓浸出動(dòng)力學(xué)研究
張邦勝,王 芳,劉貴清,蔣開(kāi)喜
(1.江蘇北礦金屬循環(huán)利用科技有限公司,江蘇 徐州 221005;2.北京礦冶科技集團(tuán)有限公司,北京 102600)
中國(guó)擁有豐富的鉬資源,約占世界儲(chǔ)量的39%。但多為低品位鉬精礦,可浮性差,伴生金屬多,如德興銅礦高錸鉬精礦、湖南張家界黑色巖系鎳鉬礦以及金鉬股份精選尾礦再選低品位鉬中礦等,這些鉬礦雜質(zhì)含量高,其伴生有價(jià)金屬價(jià)值大[1-3]。現(xiàn)有鉬精礦火法冶煉工藝,在焙燒過(guò)程中存在排放二氧化硫污染環(huán)境、伴生金屬經(jīng)濟(jì)回收不足等問(wèn)題,不適合處理低品位復(fù)雜鉬礦。冶煉難度大,成本高,環(huán)境污染嚴(yán)重,這已成為我國(guó)鉬礦冶煉加工的總體現(xiàn)狀。隨著國(guó)家對(duì)環(huán)保要求的日趨嚴(yán)格,濕法回收路線開(kāi)發(fā)低品位復(fù)雜鉬礦環(huán)保處理技術(shù)迫在眉睫。加壓浸出作為一種強(qiáng)化濕法浸出的冶金技術(shù),具有金屬回收率高、時(shí)間短、環(huán)境友好等優(yōu)點(diǎn),在處理低品位礦、多種類金屬礦、復(fù)雜礦等方面顯示出了良好的效果[4-5]。本文針對(duì)復(fù)雜鉬礦進(jìn)行加壓浸出研究,并對(duì)其過(guò)程動(dòng)力學(xué)機(jī)理進(jìn)行了較為系統(tǒng)的分析。
1 試驗(yàn)部分
1.1 化學(xué)成分分析
試驗(yàn)研究所用鉬礦為選礦尾礦,來(lái)源陜西金鉬股份公司,通過(guò)對(duì)礦樣的分析檢測(cè),其主要化學(xué)成分如表1所示。該鉬中礦鉬含量為30.16%,銅、鐵含量較高,分別為5.63%和11.63%,硫含量為35.40%。
1.2 加壓氧化浸出試驗(yàn)
對(duì)礦樣原料進(jìn)行加壓氧化浸出試驗(yàn),將礦料按一定液固比7 L/kg漿化后加入2 L的GSA型立式襯鈦加壓釜中,密封后開(kāi)動(dòng)攪拌并升溫至反應(yīng)溫度值,控制氧分壓在試驗(yàn)所需值600 kPa。到達(dá)設(shè)定反應(yīng)時(shí)間后,釜體冷卻系統(tǒng)通入冷卻水進(jìn)行冷卻,然后對(duì)浸出礦漿進(jìn)行液固分離,其中浸出渣烘干后及浸出液分別送樣分析。試驗(yàn)探索鉬的轉(zhuǎn)化率與反應(yīng)溫度、浸出時(shí)間之間關(guān)系。
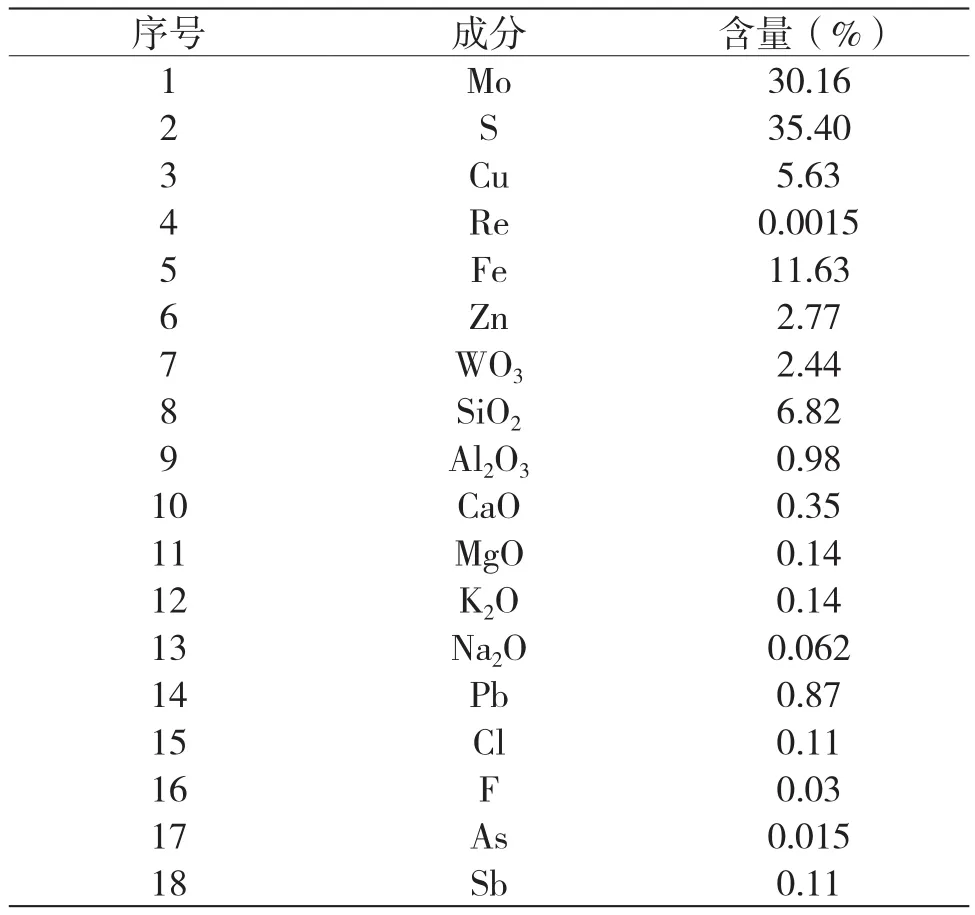
表1 鉬中礦主要成分分析結(jié)果
1.3 試驗(yàn)結(jié)果分析
在加壓浸出試驗(yàn)中,控制其他條件一定,改變溫度條件,結(jié)果發(fā)現(xiàn)鉬的轉(zhuǎn)化率隨著溫度的提升也相應(yīng)提高。同時(shí),各溫度下鉬的轉(zhuǎn)化率與反應(yīng)時(shí)間基本呈直線關(guān)系,相關(guān)性較好。通過(guò)對(duì)鉬轉(zhuǎn)化率和反應(yīng)時(shí)間(在一定浸出時(shí)間范圍內(nèi))進(jìn)行直線擬合,擬合直線方程詳情如表2所示。表中,浸出速率k值,即方程斜率,隨著溫度的升高而逐漸增加,表明提升反應(yīng)溫度有助于加快浸出,提高反應(yīng)速率。
2 加壓浸出動(dòng)力學(xué)研究
2.1 動(dòng)力學(xué)模型
礦物的浸出屬于液固反應(yīng),是濕法冶金中最為常見(jiàn)的反應(yīng)過(guò)程。礦物浸出過(guò)程一般有三種類型,第一種是生成產(chǎn)物可溶于水,固體顆粒的外形尺寸隨反應(yīng)的進(jìn)行逐漸減小直至完全消失,此類反應(yīng)可用“未反應(yīng)核收縮模型”描述;第二種是生成產(chǎn)物為固態(tài)并附著在未反應(yīng)核或未反應(yīng)礦物上,此類反應(yīng)與有固體產(chǎn)物層的氣-固相反應(yīng)類似,原則上可采用類似的動(dòng)力學(xué)模型進(jìn)行處理;第三種情況是固態(tài)反應(yīng)物分散嵌布在惰性脈石基體載體中(如礦塊的浸出),由于脈石基體一般都有孔隙和裂紋,因而液相反應(yīng)物可以通過(guò)這些孔隙和裂紋擴(kuò)散到脈石內(nèi)部,致使在礦石表面和內(nèi)部發(fā)生浸出反應(yīng)[6-7]。

表2 不同反應(yīng)溫度下鉬轉(zhuǎn)化率與時(shí)間對(duì)應(yīng)的直線關(guān)系
本文主要研究鉬精礦在酸性條件下的加壓氧化浸出,鉬精礦氧化產(chǎn)物主要是鉬酸和硫酸,所以該條件下鉬精礦的氧化浸出的動(dòng)力學(xué)屬于第二種類型,并可以用下面的化學(xué)反應(yīng)式進(jìn)行分析:
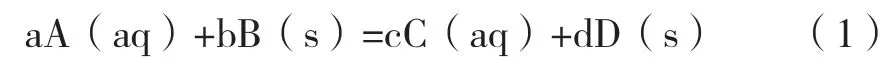
反應(yīng)的模型如圖1所示。
圖1 生成固態(tài)產(chǎn)物的反應(yīng)模型
反應(yīng)步驟包括:一是生成的液態(tài)反應(yīng)物或產(chǎn)物通過(guò)液體邊界層的外擴(kuò)散;二是液態(tài)反應(yīng)物或產(chǎn)物通過(guò)固態(tài)產(chǎn)物層內(nèi)擴(kuò)散;三是界面化學(xué)反應(yīng)。如果固體反應(yīng)物B為球體,界面化學(xué)反應(yīng)為一級(jí)不可逆反應(yīng),液態(tài)產(chǎn)物C的擴(kuò)散速率足夠快,則3個(gè)依次發(fā)生的動(dòng)力學(xué)方程分別如下。
液態(tài)反應(yīng)物A通過(guò)液體邊界層的擴(kuò)散速率為:

液態(tài)反應(yīng)物A通過(guò)固態(tài)產(chǎn)物層的擴(kuò)散速率為:

界面化學(xué)反應(yīng)速率為:

式中,nA為體系中反應(yīng)物A的摩爾數(shù);D1和DS分別為液態(tài)反應(yīng)物A通過(guò)液體邊界層和固體產(chǎn)物層的有效擴(kuò)散系數(shù);CA、CAS和C′AS分別為反應(yīng)物A在溶液主體、產(chǎn)物層表面和固體B表面的摩爾濃度;δ為液體邊界層厚度;kr為界面化學(xué)反應(yīng)速率常數(shù);r0為礦物顆粒的初始粒徑;r為礦物顆粒在時(shí)刻t的粒徑。
在準(zhǔn)穩(wěn)態(tài)情況下,上述三個(gè)步驟的速率應(yīng)該相等,從而可以導(dǎo)出反應(yīng)的綜合速率表達(dá)式:
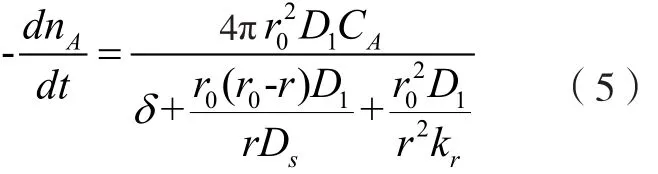

假設(shè)固體反應(yīng)物的摩爾密度為ρB(mol/cm3),轉(zhuǎn)化率或浸出率為x,則將其代入式(6)可得:
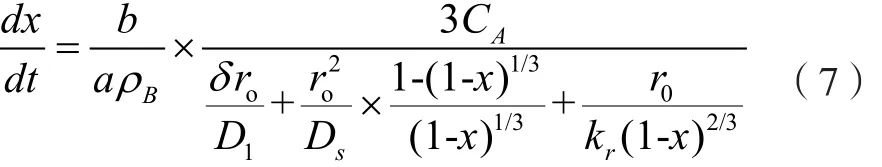
在液態(tài)反應(yīng)物A的濃度保持恒定的條件下,即CA≡CAO,將式(7)積分可得:

該方程即為浸出過(guò)程受邊界層擴(kuò)散、固態(tài)產(chǎn)物層擴(kuò)散和界面化學(xué)反應(yīng)混合控制時(shí)的速率方程。在實(shí)際浸出過(guò)程中,反應(yīng)的速率可能只受其中的某一步驟控制,此時(shí)可對(duì)速率方程式進(jìn)行簡(jiǎn)化,分別討論如下。

在液體邊界層擴(kuò)散控制的條件下,由于液體邊界層厚度δ與液體的流動(dòng)狀態(tài)有關(guān),故反應(yīng)速率受攪拌強(qiáng)度的影響較為顯著;浸出速率與反應(yīng)物濃度成正比;浸出速率受溫度的影響較小,反應(yīng)的表觀活化能一般為8~10 kJ/mol。


在界面化學(xué)反應(yīng)控制的條件下,浸出速率與攪拌強(qiáng)度無(wú)關(guān),浸出速率受溫度的影響較大,反應(yīng)的表觀活化能一般可達(dá)4~300 kJ/mol。
2.2 線性擬合分析
為明確浸出過(guò)程的動(dòng)力學(xué)控制因素,在動(dòng)力驗(yàn)試驗(yàn)中,先確定不同反應(yīng)溫度下浸出率與反應(yīng)時(shí)間的關(guān)系,然后采用各種控制模型對(duì)浸出反應(yīng)數(shù)據(jù)進(jìn)行線性擬合,選取合適的擬合模型。各擬合直線的斜率即相應(yīng)條件下的綜合速率常數(shù)k。綜合速率常數(shù)k與絕對(duì)溫度T的關(guān)系可以用阿侖尼烏斯(Arrhenius)公式表示:

其式中,k為反應(yīng)速率常數(shù);A為頻率因子;E為反應(yīng)活化能;R為氣體常數(shù)。將式(12)兩邊取對(duì)數(shù)可得:

將不同溫度下的lnk對(duì)作圖可得Arrhenius圖,圖中直線斜率為即可求出反應(yīng)的表觀活化能E的值,并以此判斷反應(yīng)控制步驟和提高反應(yīng)速率的方法。
在本文加壓浸出條件下,因攪拌在氣泡的作用下被強(qiáng)化,所以浸出速率可不受液體邊界層擴(kuò)散的控制。為明確鉬精礦在加壓氧化過(guò)程中的動(dòng)力學(xué)控制因素,對(duì)不同溫度條件下所得鉬轉(zhuǎn)化率x對(duì)應(yīng)浸出反應(yīng)時(shí)間t分別進(jìn)行 1-(1-x)1/3-t、1-2/3x-(1-x)2/3-t線性擬合,結(jié)果如圖2、圖3所示。所得回歸方程如表3和表4所示。
由表3和表4中數(shù)據(jù)可見(jiàn),1-(1-x)1/3-t具有良好的線性回歸關(guān)系,相關(guān)系數(shù)R2≥0.988 8,1-2/3x-(1-x)2/3與t之間則未呈現(xiàn)明顯的線性關(guān)系。由此可以認(rèn)為,對(duì)于鉬精礦加壓氧化而言,過(guò)程受界面化學(xué)反應(yīng)控制,動(dòng)力學(xué)方程遵循收縮核模型。
由表3中回歸方程可得鉬轉(zhuǎn)化速率常數(shù)k與反應(yīng)溫度T的關(guān)系,如表5所示,以lnk對(duì)-1000/T作圖,如圖4所示。

表3 不同溫度條件下1-(1-x)1/3-t關(guān)系

表4 不同溫度條件下1-2/3x-(1-x)2/3-t關(guān)系
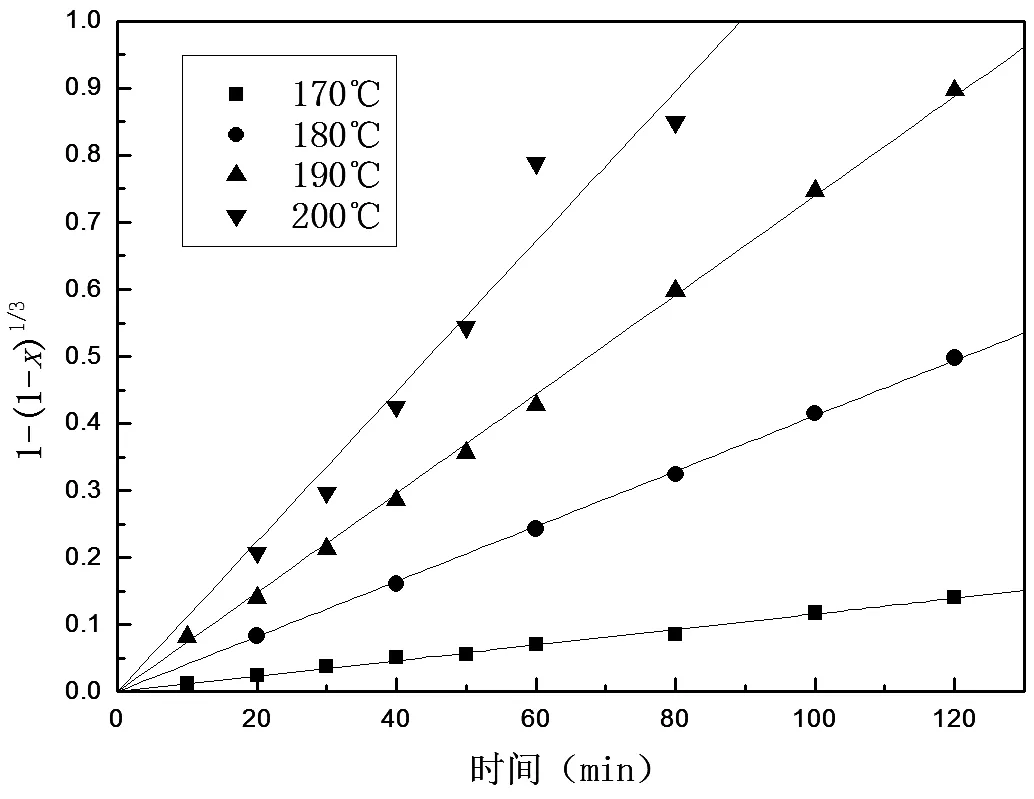
圖2 不同溫度條件下1-(1-x)1/3-t關(guān)系
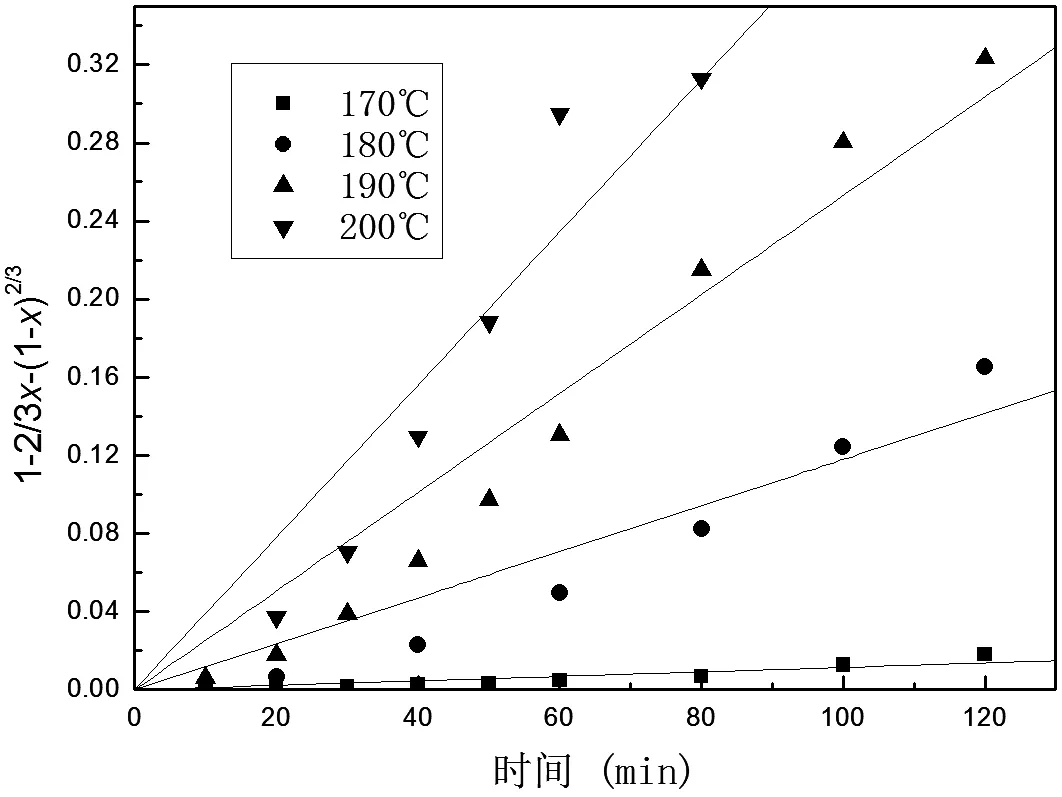
圖3 不同溫度條件下1-2/3x-(1-x)2/3-t關(guān)系

表5 鉬速率常數(shù)(k)與溫度(T)的關(guān)系
如圖4所示,lnk與-1000/T之間呈線性關(guān)系,所得直線斜率為13.50。根據(jù)Arrhenius公式,求解反應(yīng)的活化能:
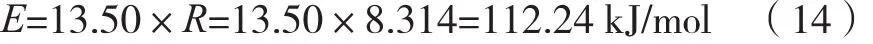
計(jì)算所得活化能值處于40~300 kJ/mol范圍內(nèi),可見(jiàn)浸出過(guò)程的確受界面化學(xué)反應(yīng)控制。
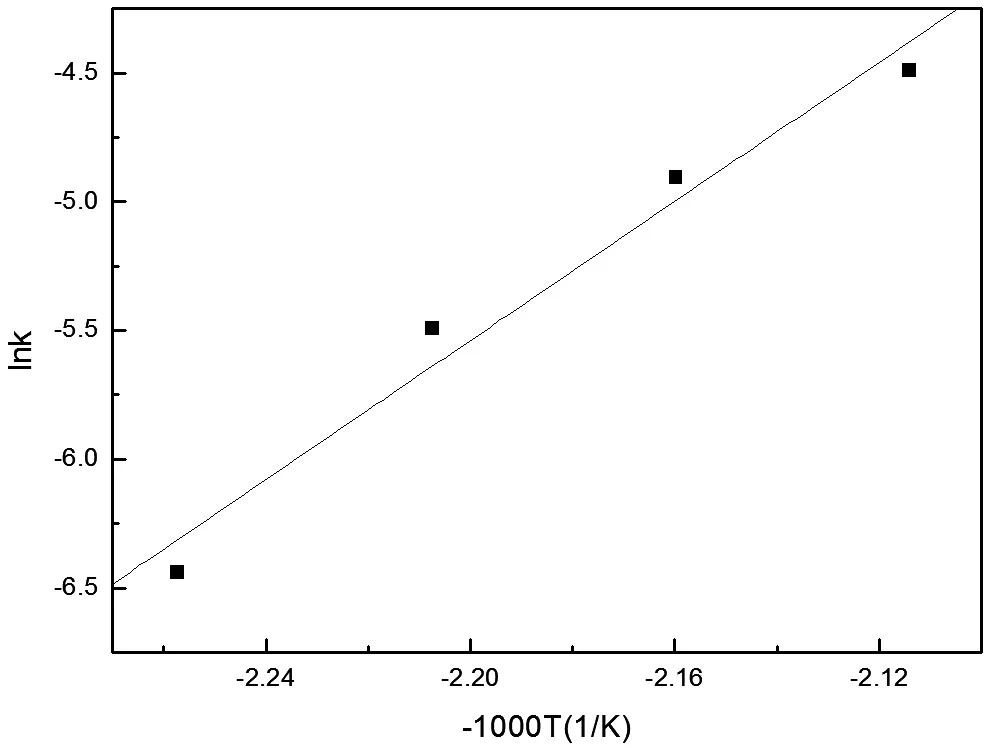
圖4 lnk與(-1000/T)之間的關(guān)系
3 結(jié)論
本文以陜西金堆城鉬中礦為研究對(duì)象,開(kāi)展了鉬中礦加壓氧化浸出速度變化規(guī)律的研究,建立了加壓浸出動(dòng)力學(xué)模型,揭示了加壓浸出過(guò)程的反應(yīng)機(jī)理。浸出動(dòng)力學(xué)研究表明,鉬中礦加壓氧化浸出速率1-(1-x)1/3與時(shí)間呈線性關(guān)系,浸出過(guò)程受界面化學(xué)反應(yīng)控制,反應(yīng)遵循收縮核模型。

