外周血內皮祖細胞及血清AngⅡ、Ang1-7與血管性癡呆的相關性研究*
陸冰 劉洲 林智君 陳煜森 陳秋萍
(廣東醫(yī)科大學附屬醫(yī)院老年醫(yī)學中心, 廣東 湛江524001)
目前亞洲高齡人群中血管性癡呆(Vascular dementia,VaD)的發(fā)病率高于老年性癡呆(Alzheimer's disease, AD)居第一位[1],成為老年患者癡呆的首發(fā)原因[2]。研究表明,血管內皮損傷所引起的腦缺血性損害是VaD形成的重要因素之一[3-4];因此,血管內皮功能在VaD發(fā)病機制中的作用開始引起學者關注。內皮祖細胞(Endothelium progenitor cells, EPCs)是一種來源于骨髓的前體細胞,具有修復血管內皮的能力,EPCs不足以代償血管內皮損傷及修復之間的失衡可致血管內皮功能失調[5]。本研究通過觀察VaD患者與同齡認知功能正常人群外周血EPCs數(shù)目的差異及比較血管內皮功能指標:血清血管緊張素(AngⅡ)及血管緊張素1-7(Ang1-7)的水平,為VaD的臨床防治提供依據(jù)。
1 對象與方法
1.1 一般資料 選取2015年~2017年于廣東醫(yī)科大學附屬醫(yī)院就診的患者100例。采用國際神經(jīng)科學研究會診斷標準和國內學者對VaD的診斷共識,將受試者分為兩組:VaD組(55例),認知正常組(45例)。患者自愿配合,取得醫(yī)學倫理委員會同意。VaD組納入標準:①有明確腦血管病史(經(jīng)過核磁影像檢查和診斷確認),發(fā)病3個月后逐漸出現(xiàn)認知功能障礙,此前無認知障礙史;②Hachinski缺血指數(shù)大于7分;③目前腦血管病穩(wěn)定,3個月內無新發(fā)卒中事件(頭顱CT/MRI證實)。受試者排除標準:①入組前3個月內新發(fā)腦卒中、外傷、顱腦手術;②腦血管病以外的因素所致的認知功能障礙;③意識障礙、嚴重的視聽力障礙、失語及不能配合進行神經(jīng)心理測試的患者;④患有嚴重器質性疾病;⑤服用其它可能影響認知功能的藥物;⑥目前服用影響EPCs水平的藥物(如他汀類、膽堿酯酶抑制劑等)
1.2 臨床資料 詳細獲取患者病史、年齡、文化程度、體重指數(shù)(BMI)、血壓、血脂、空腹血糖、頸動脈內膜厚度(IMT)等基本信息。采用全自動生化分析儀測定生化指標;采用頸動脈彩色多普勒超聲測定受試者雙側IMT,取平均值進行分析。
1.3 認知功能評定 應用簡易智能精神量表(MMSE)評定所有受試者的認知功能,MMSE最高得分為30分。認知障礙的判斷根據(jù)文化程度分為:文盲≤17分,初中<21分,高中<22分,大學≤23分。
1.4 流式細胞儀檢測外周血EPCs水平 受試者清晨空腹2ml靜脈血,置于EDTA管抗凝分離單個核細胞,加入膜抗體CD34+、CD133+單克隆抗體,以同型抗體作為對照,室溫避光放置5min。應用流式細胞儀設定單個核細胞門來檢測外周血EPCs水平。
1.5 ELIAS檢測血清AngⅡ、Ang1-7水平 靜脈血離心后取血漿,采用ELISA試劑盒檢查,酶標儀在波長450mm處測定各樣本的吸光度值,檢測血清中AngⅡ及Ang1-7的水平。

2 結果
2.1 兩組臨床資料比較 兩組受試者的年齡、性別、文化程度、BMI、血壓、血脂、空腹血糖、IMT比較差異均無統(tǒng)計學意義(P>0.05)。VaD組MMSE評分低于認知正常組,兩組間差異有統(tǒng)計學意義(P<0.05),見表1。

表1 兩組臨床基線資料的比較Table 1 Comparison of baseline clinical data between the two groups
注:與認知正常組比較,①P<0.05;TC:總膽固醇;LDL-C:低密度脂蛋白;TG:甘油三指;HDL-C:高密度脂蛋白;FPG:空腹血糖
2.2 兩組外周血EPCs水平及血管緊張素水平的比較 通過流式細胞儀標記,根據(jù)表面標記為CD34+/CD133+的細胞來確認EPCs數(shù)目(圖1)。VaD組外周血EPCs數(shù)目明顯低于認知正常組(P<0.05);VaD患者血清AngⅡ水平較認知正常組增加,Ang1-7水平較認知正常組減少,差異有統(tǒng)計學意義(P<0.05),見表2。
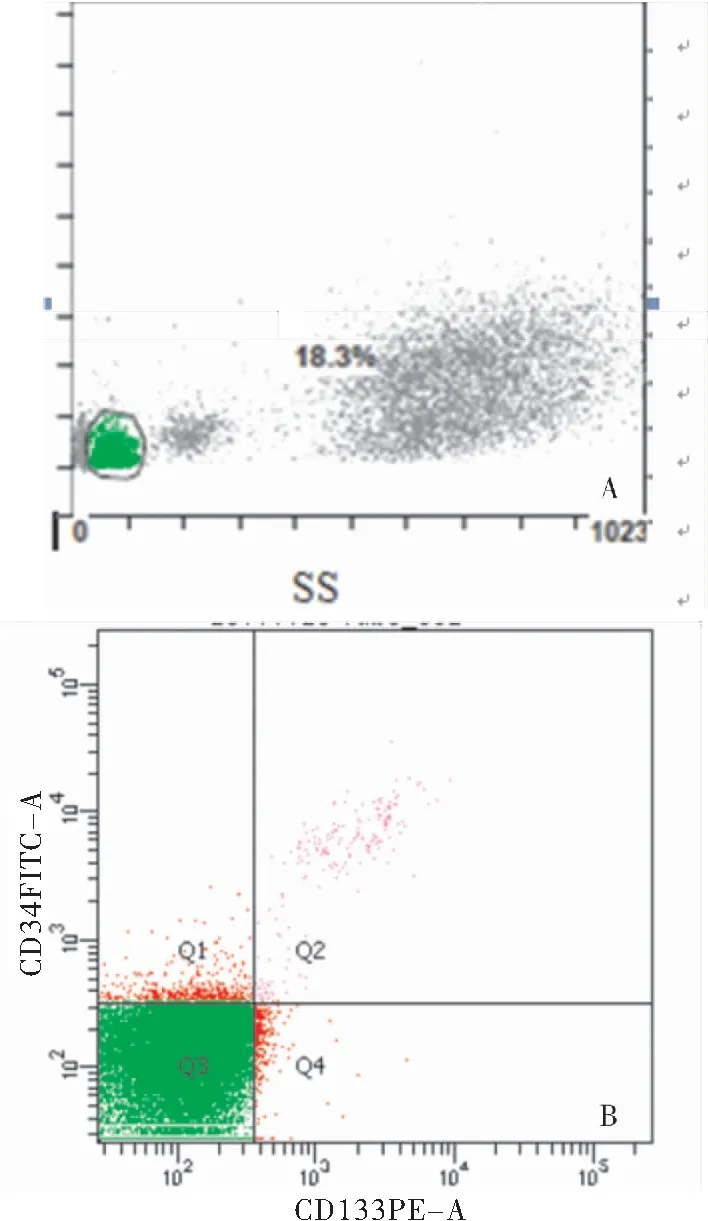
圖1 流式細胞儀標定測定外周循環(huán)EPCs水平
Figure1CirculatingEPCscontentsweredeterminedbyflowcytometry
注:A.綠色畫圈對淋巴細胞群設窗;B.Q2區(qū)域代表CD133+/CD34+雙陽性細胞

Table2ComparisonofEPCsnumbersandangiotensinlevelsbetweenthetwogroups
注:與認知正常組比較,①P<0.05
2.3 VaD組外周血EPCs數(shù)目與血管緊張素水平的相關性分析 VaD組外周血EPCs數(shù)目與血清AngⅡ含量呈負相關(r=-0.44,P<0.05);與血清Ang1-7含量呈正相關(r=0.51,P<0.05)。
2.4 VaD組MMSE評分與外周血EPCs數(shù)目、血管緊張素水平的相關性分析 VaD組MMSE評分與外周血EPCs數(shù)目呈正相關(r=0.679,P=0.000)。排除年齡、性別、體重指數(shù)、血壓、血糖、血脂、IMT的影響后,此關系仍存在(r=0.545,P=0.000);VaD組MMSE評分與血清Ang1-7水平呈正相關(r=0.461,P=0.007);與血清AngⅡ水平呈負相關(r=-0.359,P=0.004),見表3。
表3VaD組MMSE評分與循環(huán)EPCs數(shù)目及血管緊張素水平的相關性分析
Table3CorrelationanalysisbetweenMMSEscoreandthenumbersofcirculatingEPCs,angiotensinlevelsinVaDgroup

變量rPEPCs0.5450.000Ang1-70.4610.007 AngII-0.3590.004
3 討論
近年來,VaD發(fā)病機制的研究僅集中在神經(jīng)元方面,對缺血區(qū)域腦灌注及血管內皮的關注甚少。低灌注狀態(tài)下的腦細胞氧代謝受到抑制,繼而使主導認知的腦組織內部環(huán)路傳遞中斷是VaD重要的病理機制[6]。如何有效修復血管內皮為缺血區(qū)域提供良好的微循環(huán)是VaD認知功能得以改善的基礎及關鍵。EPCs是血管內皮細胞的前體細胞,在組織缺血的刺激下,骨髓源性EPCs被大量動員歸巢至缺血區(qū)域,通過修復損傷的血管內皮[7]及血管新生[8],建立側支循環(huán),以改善缺血局部血流灌注[9]。缺血是EPCs動員的一個明確的刺激因素,EPCs作為一種血管保護機制為缺血區(qū)域的血供提高有利環(huán)境[10]。動員外周血EPCs是改善VaD缺血損傷區(qū)域血流灌注及修復神經(jīng)功能的重要環(huán)節(jié),對主導學習記憶的海馬區(qū)域的意義重大。目前已有研究表明,EPCs-血管新生機制在改善大鼠局灶性缺血再灌注后認知功能障礙中發(fā)揮積極作用[11]。本研究顯示,VaD患者外周血EPCs數(shù)目較認知正常組明顯減少,且與MMSE評分呈正相關。推測外周血EPCs參與腦卒中后認知功能障礙的發(fā)生及進展,外周血EPCs的減少可能在VaD發(fā)病及發(fā)展中起著重要的作用。
目前已證實腎素-血管緊張素系統(tǒng)(RAS)廣泛分布于與認知功能密切聯(lián)系的區(qū)域,參與調節(jié)與認知相關的復雜功能,如感覺信息、學習記憶等。因此,RAS成為目前研究卒中后癡呆的候選因素之一。中樞AngⅡ可以抑制皮質中乙酰膽堿的釋放,影響腦高級神經(jīng)功能[12]。AngⅡ的受體AT1R不僅存在于腦組織,還分布于血管內皮細胞[13],參與體內神經(jīng)炎癥反應及氧化應激[14-15]。腦缺血病理狀態(tài)下,腦細胞氧化-還原穩(wěn)態(tài)失衡所引起的氧化應激是循環(huán)及腦內的RAS過度激活的重要機制[16],可引起AngⅡ顯著增加;AngⅡ作為RAS的重要效應因子,是RAS直接作用于血管床使血管收縮的血管活性肽。此外,高水平AngⅡ還可以通過抗衡凋亡調控因子Bcl-2的活性,誘導神經(jīng)細胞的凋亡,產(chǎn)生認知功能障礙。因此,有必要探討卒中后癡呆與血清中AngⅡ水平的相關性。本研究發(fā)現(xiàn),VaD患者血清AngⅡ水平較認知正常組顯著增高,且與MMSE評分呈負相關。可見,血清AngⅡ參與了卒中后認知功能障礙的發(fā)生,其表達水平與VaD的病情發(fā)展密切相關。AngⅡ通過抑制內皮細胞釋放一氧化氮(NO)及血管活性物質的表達[17],促進EPCs的衰老及減少EPCs向外周遷移,降低外周血中EPCs的數(shù)目,從而削弱EPCs的內皮修復能力[18]。本研究顯示,VaD患者循環(huán)血EPCs數(shù)目與血清AngⅡ水平呈負相關。可見,血清AngⅡ水平可直接影響著EPCs向外周血的動員。然而,腦缺血后機體內AngⅡ對EPCs動員的影響及對認知功能的作用機制仍需進一步研究。
ACE2-Ang1-7-mas是RAS系統(tǒng)另一個重要分支,Ang1-7是AngⅡ生物學效應的內源性據(jù)抗因子。Ang1-7既可抗衡AngⅡ介導的血管內皮細胞鈣超載而擴張血管,也可以直接作用于內皮細胞促進NO的釋放,通過NO內皮依賴機制產(chǎn)生舒血管作用改善腦血流量[19]。Ang1-7不僅通過增強內皮細胞在缺氧后氧化應激損傷過程中的抗氧化能力而發(fā)揮血管內皮保護作用[20],還可通過釋放的NO介導多種信號轉導途徑為促進EPCs的動員及血管內皮的修復提高有利的環(huán)境。由此可見,RAS成分主要通過調節(jié)腦灌注量而影響VaD的發(fā)病過程。本研究結果顯示,VaD的發(fā)病與Ang1-7表達有關,低水平Ang1-7的舒血管效應受抑制,腦灌注得不到充足改善而引起認知功能障礙。本研究顯示,VaD患者血清Ang1-7水平與MMSE評分呈正相關,提示了血清Ang1-7參與著認知功能的調節(jié),其表達水平與VaD的病情密切相關。慢性腦缺血的病理狀態(tài)下所引起的氧化應激可破壞EPCs正常結構及功能活性,導致血管內皮不可逆性損傷。我們試驗發(fā)現(xiàn),VaD患者EPCs數(shù)目與血清Ang1-7表達水平呈正相關,推測腦缺血后EPCs動員的調節(jié)可能與Ang1-7保護血管內皮的作用機制有關。后續(xù)工作我們將針對EPCs及RAS對認知功能的作用通路進一步的設計和研究,更好地了解VaD發(fā)病機制,為VaD的防治提供新思路。
4 結論
本研究結果顯示,VaD患者的認知功能與外周血EPCs數(shù)目及血清AngII、Ang1-7水平存在一定的相關性。

