培養基質量控制試驗適用性檢查方法研究
寧航忠

【摘要】目的:通過培養基適用性檢查實驗,證明培養基質量是否符合要求,確保微生物檢查結果的準確性和可靠性。方法:按照《中國藥典》2015年版相關要求,采用6種試驗菌株和對照培養基進行試驗。結果:被檢計數培養基上的菌落平均數與對照培養基上的菌落數平均數比值均在0.5~2范圍內,控制菌檢查培養基符合檢出要求。結論:培養基適用性檢查實驗結果符合規定,培養基質量符合要求。
【關鍵詞】 計數培養基 對照培養基 控制菌檢查培養基
培養基質量是影響微生物檢驗結果的重要環節,微生物限度檢查用培養基主要分為需氧菌、霉菌和酵母菌計數測定用培養基和控制菌檢查用培養基,《中國藥典》2015年版通則1105收載用于計數的培養基有:胰酪大豆胨瓊脂培養基、沙氏葡萄糖瓊脂培養基、R2A瓊脂培養基,用于控制菌大腸埃希菌檢查的培養基有:麥康凱瓊脂培養基、麥康凱液體培養基。適用性檢查是通過檢驗用培養基與對照培養基的比較,以陽性菌的生長狀態或特征來評價判斷檢驗用培養基是否符合檢驗要求。
1 儀器
超凈臺、生物安全柜、生化培養箱、立式滅菌器、恒溫電熱鼓風干燥箱、電子天平
2 培養基
(1)被檢培養基由廣東環凱生物科技有限公司提供
胰酪大豆胨瓊脂培養基批號為3105545、沙氏葡萄糖瓊脂培養基批號為3105440、R2A瓊脂培養基批號為3105266、麥康凱瓊脂培養基批號為3105291、麥康凱液體培養基批號為3105470
(2)對照培養基由中國食品藥品檢定研究所提供。
胰酪大豆胨瓊脂對照培養基批號為135025-201603、沙氏葡萄糖瓊脂對照培養基批號為135013-201502、R2A瓊脂對照培養基批號為135027-201401、麥康凱瓊脂對照培養基批號為135009-201503、麥康凱液體對照培養基批號為135030-201602
3 試驗菌株
試驗用菌株傳代次數不超過5代,由廣東環凱微生物科技有限公司提供冷凍干燥菌種,為0代。
金黃色葡萄球菌(CMCC(B)26003)實驗室編號:JP-3-20161016-1、銅綠假單胞菌(CMCC(B)10104)實驗室編號:TL-3-20161016-1、枯草芽孢桿菌(CMCC(B)63501)實驗室編號:KC-3-20161016-1、大腸埃希菌(CMCC(B)44102)實驗室編號:DC-3-20161016-1、白色念珠菌(CMCC(F)98001)實驗室編號:BN-3-20161022-1、黑曲霉(CMCC(F)98003)實驗室編號:HQ-3-20161028-1。
4 試驗與結果
4.1 菌液制備
(1)接種銅綠假單胞菌、金黃色葡萄球菌、枯草芽孢桿菌、大腸埃希菌的新鮮培養物至胰酪大豆胨液體培養基中,于30~35℃培養18~24小時。用PH7.0氯化鈉-蛋白胨緩沖液制成適宜濃度的菌懸液,備用。
(2)接種白色念珠菌的新鮮培養物至沙氏葡萄糖液體培養基中,于20~25℃培養48-72小時。用PH7.0氯化鈉-蛋白胨緩沖液制成適宜濃度的菌懸液,備用。
(3)接種黑曲霉菌的新鮮培養物至沙氏葡萄糖瓊脂培養基上,于20~25℃培養5~7天,或直到獲得豐富的孢子,加入3~5ml含0.05%(ml/ml)聚山梨脂80的PH7.0氯化鈉-蛋白胨緩沖液,將孢子洗脫。然后,用適宜方法吸出孢子懸液至無菌試管內,用含0.05%(ml/ml)聚山梨脂80的PH7.0氯化鈉-蛋白胨緩沖液制成制成適宜濃度的菌懸液,備用。
(4)、菌液制備后若在室溫下放置,應在2小時內使用;若保存在2~8℃,可在24小時內使用,黑曲霉孢子懸液可保存在2~8℃,在驗證過的貯存期內使用。
4.2 菌液計數
(1)、取銅綠假單胞菌、金黃色葡萄球菌、枯草芽孢桿菌、大腸埃希菌菌懸液各0.1ml,分別注入無菌平皿中,立即傾注胰酪大豆胨瓊脂培養基,每株試驗菌株平行制備2個平皿,輕輕搖勻凝固后,30~35℃培養不超過3天,觀察計數;
(2)、取白色念珠菌、黑曲霉菌的菌液各0.1ml,分別注入無菌平皿中,立即傾注沙氏葡萄糖瓊脂培養基,每株試驗菌株平行制備2個平皿,輕輕搖勻凝固后,20~25℃培養不超過5天,觀察計數。菌懸液計數結果如下:
銅綠假單胞菌:10-656CFU/ml、枯草芽孢桿菌:10-758CFU/ml、金黃色葡萄球菌:10-662CFU/ml、大腸埃希菌:10-750CFU/ml、白色念珠菌:10-544CFU/ml、黑曲霉菌:10-540CFU/ml。
4.3 培養基配制方法
按培養基使用說明配制胰酪大豆胨瓊脂培養基、沙氏葡萄糖瓊脂培養基、R2A瓊脂培養基、麥康凱瓊脂培養基、麥康凱液體培養基(被撿培養基和對照培養基),經驗證合格的滅菌程序進行滅菌后備用。
4.4 無菌性檢查
取已滅菌的被撿培養基和對照培養基:胰酪大豆胨瓊脂培養基、R2A瓊脂培養基、麥康凱瓊脂培養基各注2個平皿,于30℃~35℃培養3~5天;麥康凱液體培養基2瓶,于42℃~44℃培養不少于3天;沙氏葡萄糖瓊脂培養基注2個平皿,20℃~25℃培養5~7天。各培養基均應無菌落生長。
經過規定時間培養,上述被撿培養基和對照培養基均為陰性。證明各培養基在規定時間內均無菌落生長,符合規定。可用于檢查試驗。
4.5 計數培養基的適用性檢查
被檢計數培養基:胰酪大豆胨瓊脂培養基、沙氏葡萄糖瓊脂培養基、R2A瓊脂培養基。試驗菌株:銅綠假單胞菌、金黃色葡萄球菌、枯草芽孢桿菌、白色念珠菌、黑曲霉菌,接種量不大于100CFU。實驗操作如下:
(1)胰酪大豆胨瓊脂對照培養基:取10個無菌平皿,分別接種銅綠假單胞菌、金黃色葡萄球菌、枯草芽孢桿菌、白色念珠菌、黑曲霉菌菌懸液各2皿,傾注胰酪大豆胨瓊脂對照培養基,輕輕搖勻凝固后,于30~35℃培養,銅綠假單胞菌、金黃色葡萄球菌、枯草芽孢桿菌不超過3天,白色念珠菌、黑曲霉菌不超過5天,觀察計數;
(2)沙氏葡萄糖瓊脂對照培養基:取4個無菌平皿,分別接種取白色念珠菌、黑曲霉菌菌懸液各2皿,傾注沙氏葡萄糖瓊脂對照培養基,輕輕搖勻凝固后,于20~25℃培養不超過5天,觀察計數;
(3)R2A瓊脂對照培養基:取6個無菌平皿,分別接種取銅綠假單胞菌、金黃色葡萄球菌、枯草芽孢桿菌菌懸液各2皿,傾注R2A瓊脂對照培養基,輕輕搖勻凝固后,于30~35℃培養不超過3天,觀察計數;
(4)各培養基取1個無菌培養皿不接種菌作為空白對照;
(5)被檢培養基同法操作。
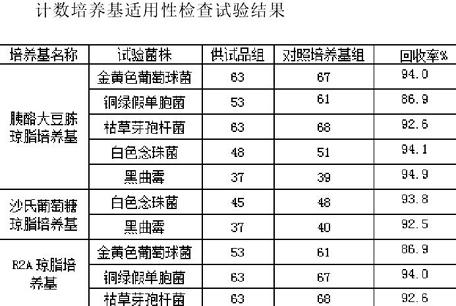
結果判斷:被檢固體培養基上的菌落平均數與對照培養基上的菌落平均數的比值應在0.5~2范圍內,且菌落形態大小應與對照培養基上菌落一致,則判斷該培養基的適用性檢查符合規定。試驗結果見下表。
計數培養基適用性檢查試驗結果
從上表檢驗結果可見,5種試驗菌株的回收率均在50~200%范圍內,并經觀察鑒定菌落形態大小與對照培養基上的菌落一致,說明上述培養基的適用性檢查符合規定。
4.6 控制菌檢查培養基的適用性檢查
被檢培養基:麥康凱液體培養基、麥康凱瓊脂培養基;試驗菌株:大腸埃希菌、金黃色葡萄球菌控制菌培養基適用性檢查項目及所用菌株見下表。
4.6.1 麥康凱液體培養基適用性檢查
a、促生長能力檢查:取100ml麥康凱液體對照培養基3瓶,2瓶接種大腸埃希菌菌懸液,接種量不大于100cfu,搖勻,另一瓶不接種菌作為空白對照,于42~44℃培養箱培養24~48h;被撿培養基同法操作。觀察培養基中試驗菌株的生長情況。培養基中的試驗菌應生長良好,空白對照應無菌生長。
檢驗結果:2瓶培養基內均出現渾濁,且渾濁相當,證明試驗菌生長良好,空白對照為陰性,試驗結果符合規定。
b、抑制能力檢查:取100ml麥康凱液體對照培養基3瓶,2瓶接種金黃色葡萄球菌菌懸液,接種量大少于100cfu,搖勻,另一瓶不接種菌作為空白對照,于42~44℃培養箱培養24~48h;被撿培養基同法操作。培養基中試驗菌株的生長情況。培養基中的試驗菌應不得生長,空白對照應無菌生長。
檢驗結果:2瓶培養基均未出見渾濁,證明試驗菌未生長,空白對照為陰性,試驗結果符合規定。說明麥康凱液體培養基適用性檢查符合規定。
4.6.2 麥康凱瓊脂培養基適用性檢查
促生長能力+指示特性檢查:將滅菌后的麥康凱瓊脂對照培養基,傾注平皿,30~35℃培養箱預培養后,備用,取3個無菌麥康凱瓊脂對照培養基平板,2個平板用涂布法接種大腸埃希菌菌懸液,接種量不大于100cfu,另一平板不接種菌作為空白對照,涂布均勻后。于30~35℃培養箱培養18~24h;被撿培養基同法操作。觀察培養基平板上試驗菌的生長情況。培養基平板上菌落應生長良好,被檢培養基菌落大小、形態特性、顏色、指示反應應與對照培養基上的菌落一致,空白對照平板應無菌落生長。
檢驗結果:被檢培養基平板上菌落與對照培養基平板上菌落均生長良好,且菌落大小、形態特征、顏色及指示反應一致,空白對照平板無菌落生長,試驗結果符合規定。說明麥康凱瓊脂培養基適用性檢查符合規定。
5 結論
5.1通過培養基適用性檢查試驗確定微生物實驗室所用培養基、制備程序、保存條件等是否滿足微生物限度檢查用要求,只有當培養基滿足培養基適用性的要求后,方可用于檢驗。根據適用性檢查試驗結果,上述培養基質量均符合規定,可用于微生物檢查試驗。
5.2培養基的質量控制試驗若不符合規定,應尋找不合格的原因,以防此問題重復出現,任何不符合要求的培養基均不能使用。
【參考文獻】
[1] 國家藥典委員會,《中國藥典》2015年
[2] 中國藥品生物鑒定所,《中國藥品檢驗標準操作規范》(2010年版)北京:中國醫藥科技出版社,2010
[3] 中國藥典委員會,《中國藥典分析檢測技術指南》北京:中國醫藥科技出版社,2017.6

