射波刀治療胰腺癌的治療計劃參數研究
郭學玲 劉永明 代智濤 于春山 孫永健 曹洋森 居小萍 張火俊
立體定向體部放射治療(stereotactic body radiation therapy, SBRT)是對胰腺癌的精準放射治療手段之一。其中射波刀(Cyber-Knife)作為目前先進的全身立體定向放射外科設備[1-3],已在全球范圍內約10萬多個腫瘤病例中得到應用[4]。臨床研究表明,射波刀對于治療局部進展期胰腺癌效果顯著,患者的局部病灶得到有效控制,疼痛快速緩解,生活狀態有明顯改善[5-7]。對比普通加速器治療[8]和伽馬刀治療[9],射波刀治療在對胰腺癌的臨床療效上具有明顯的統計學優勢,這不僅依賴于其先進的影像技術、靶區實時追蹤等手段,更取決于物理師對每1例患者的治療計劃方案設計的質量保證和質量控制。目前研究工作多集中在不同方法的劑量學方面的比較[8-11],或針對特定靶區計劃方案的設計[12],對臨床射波刀治療計劃的個性化方案制定研究較少,且對治療計劃方案的評估、質控等均未達成共識。本研究對射波刀治療胰腺癌的129份設計方案數據進行統計學分析,旨在為臨床安全、高質量的射波刀治療計劃提供參考。
資料與方法
一、臨床資料
回顧性分析2017年1月至12月期間上海長海醫院放射治療科收治的129例行射波刀治療的首程胰腺癌患者的臨床資料,男女性別比為75∶54,年齡39~90歲,中位年齡65歲。患者均拒絕手術或無手術適應證。從129例患者中提取出采用射波刀配套的MultiPlan@4.0.2放射治療計劃系統(treatment planning system, TPS,美國Accuray公司)設計的治療實施計劃方案參數,進行數據處理與分析。
二、射波刀治療
采用射波刀立體定向放射手術平臺G4系統及相應的MultiPlan@4.0.2的TPS。患者接受正式治療前,需首先制作真空墊體膜,再行CT定位。患者取仰臥位,以真空墊體模固定,雙手自然置于身體兩側。螺旋CT掃描定位分為平掃和增強兩期,平掃是在患者吸氣末屏氣時掃描,圖像為主圖像,界限為腫瘤上下界各外延15 cm;增強圖像為輔助圖像,是在患者注射碘造影劑后取呼氣末屏氣時掃描,界限為腫瘤上下界各外延5 cm。
三、治療計劃方案的基本參數說明
射波刀治療的個性化計劃方案的參數大致可分為靶區參數、危及器官(organ at risk, OAR)參數及機器參數三大類。
靶區參數包括腫瘤靶區的體積、總處方劑量、單次處方劑量、治療分次以及適形指數(conformal index,CI)、新適形指數(new conformal index, nCI)、均質指數(homogeneity index, HI)、靶區覆蓋率(coverage)等。其中,靶區體積、處方劑量、治療分次是由主治醫師依據不同患者的年齡、狀態、存活率、生存質量等多因素而給定的個性化方案。而CI、nCI、HI、coverage則是由物理師在計劃設計過程中不斷優化,用于評估計劃方案是否可行的指標。具體而言,CI是指處方等劑量線所包繞的所有組織體積與處方等劑量線包繞的腫瘤體積之比;HI為體積最大劑量與處方劑量之比,即歸一處方百分劑量的倒數,反映靶區體積內劑量的均勻度;而nCI=CI/coverage, 用以綜合評估靶區的適形度和覆蓋率,如75%的處方劑量線包繞的體積是95%,計算的CI=1.12,則可得nCI、HI依次為1.18、1.33。
OAR參數是針對腫瘤周圍正常器官而言,參考美國醫學物理學協會(AAPM)推薦的TG101報告[13]和Grimm等[14]的報道,對不同的腫瘤重點保護不同的正常組織,并限制相關OAR在一定體積下的耐受量以及最大點劑量的耐受量。對胰腺癌的OAR通常包括脊髓、十二指腸、空回腸、胃、肝、左右腎、食管等,它們的耐受限量值見表1。本研究在數據分析中還提取了各個OAR接受的最小劑量(Dmin)及最大劑量(Dmax)。
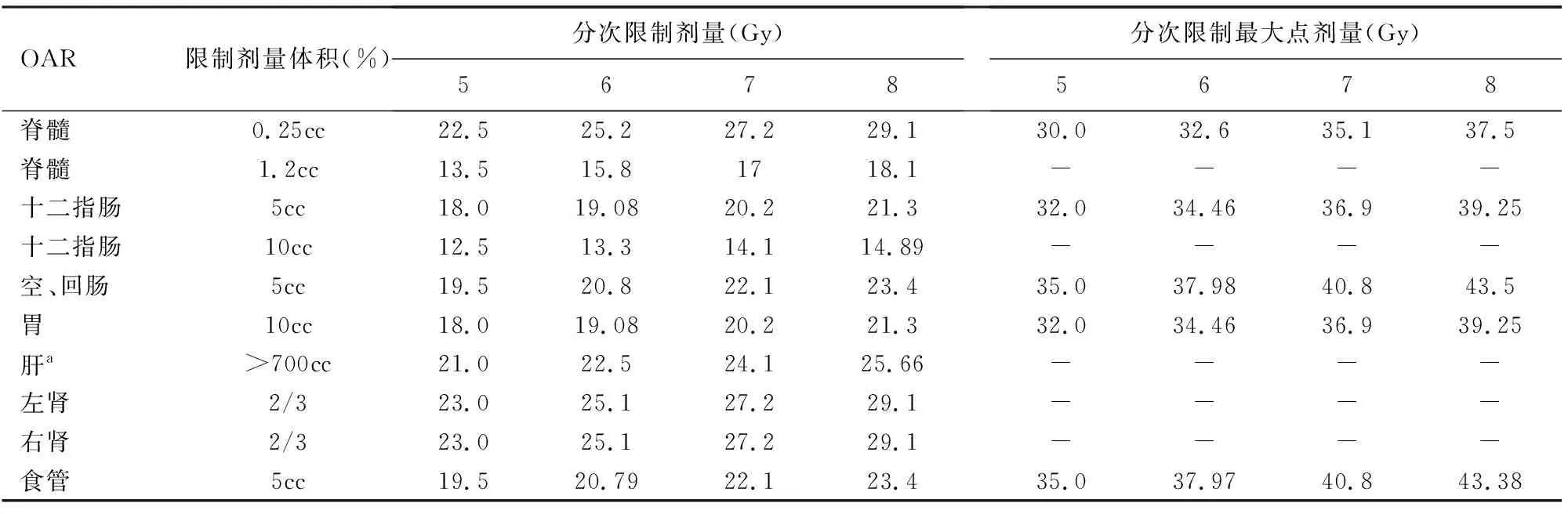
表1 胰腺癌危及器官的耐受量限值
注:cc表示cm3;-表示無約束;a:肝為并行器官,評估保護體積,即接受相應耐受劑量后,剩余的保護體積需>700 cc
機器參數與治療實施過程相關,包括準直器大小、治療計劃的節點數、射野數、總跳數及治療時間等。準直器大小的選擇是決定一個計劃過程順利與否的關鍵。射波刀G4系統配備了12個不同規格的準直器。節點數、射野數等參數則是在計劃設計過程中不斷優化,并與前面的靶區和OAR參數一起綜合權衡優化。
四、計劃設計過程中的關鍵技術
選擇脊柱追蹤或同步金屬標記物的追蹤方式對胰腺癌患者進行射波刀治療,根據前期臨床是否植入金屬標記物進行選擇。計劃中準直器的選擇在MultiPlan@4.0.2的TPS中提供了4種方案,包括Conformality(2或3 Collimators)、Homogeneity(2或3 Collimators)。通常優先選擇兩個準直器方案,再根據具體案例中的不同靶區體積大小、OAR位置關系、患者情況等選擇1~2個準直器。事實上對于胰腺癌病例,絕大多數情況下選擇1個恰當的準直器就可以設計出較為完美的治療計劃方案。針對靶區的優化可以選擇優化覆蓋率(optimize coverage, OCO)、優化最小劑量(optimize minimum dose, OMI)、優化均質指數(optimize homogeneity, HI)等;針對OAR的優化提供了優化最大劑量(optimize maximum dose, OMA)或優化平均劑量(optimize mean dose, OME)兩種選擇。TPS同時也提供8個以內的Auto Shell用于限制靶區的劑量梯度跌落以及控制OAR的受量。對胰腺癌患者而言,主要是空回腸、十二指腸、胃等正常組織需要得到較好的保護。計劃設計時可以先通過調整OAR的優化順序來實現重點優先優化的器官。TPS對Auto Shell提供了優化適形度(optimize conformality, OCI)的方法。
在預先設置好各種限制參數后進行初步劑量優化計算,并根據實際情況不斷調整優化參數。射波刀TPS提供了兩種劑量算法:射線追蹤劑量(ray-tracking)算法和Monte-Carlo劑量算法。本研究組前期的研究[10]結果顯示這兩種方法在劑量計算方面的差異無統計學意義,故本研究的129例病案全部采用射線追蹤劑量算法。基于MultiPlan@4.0.2計劃系統針對給定追蹤方法的默認設置時間和影像時間間隔計算得到計劃預估的每個分次的治療時間。
五、統計學處理
結 果
一、胰腺癌治療計劃的靶區參數
129例胰腺癌患者的靶區體積為3.355~238.93 cm3,平均(51.43±55.64)cm3,提示靶區體積的離散程度較高。總處方劑量為25~43 Gy,平均(34±3)Gy,單次劑量為(6±1)Gy。患者平均接受5~8次治療,靶區處方劑量平均為6 Gy×6次,最大處方劑量為8.5 Gy×5次,對應的生物等效劑量(biological equivalent dose, BED)和每次2 Gy的等效劑量(equivalent dose in 2 Gy per fraction,EQD2)分別為78.6 Gy和65.5 Gy。對于6 Gy×6次的平均處方劑量而言,BED和EQD2分別為58 Gy和48 Gy。
129例胰腺癌患者的CI為1.14±0.09,nCI為1.29±0.09,HI為1.42±0.04,靶區覆蓋率至少達80.3%,最大為95.6%, 平均為(90.0±4.6)%。
二、胰腺癌治療計劃的OAR參數
129例胰腺癌患者的計劃劑量與耐受量之差、計劃最大點劑量與耐受最大點劑量之差、對應的Dmin和Dmax以及均數見表2。計劃劑量較耐受量越低,即Dmin越小,表明OAR實際接受到的照射劑量越低。
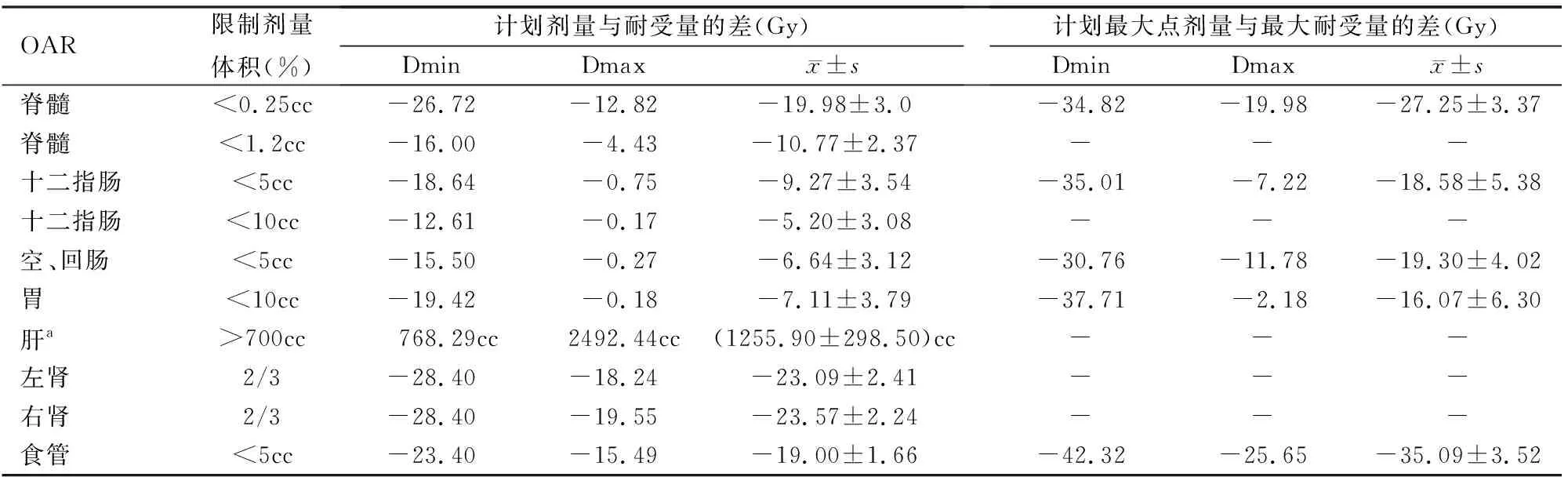
表2 129例胰腺癌治療計劃的危及器官限制劑量
注:cc表示cm3;-表示無約束;a:接受相應耐受劑量后,剩余的保護體積需>700 cc
三、胰腺癌治療計劃的機器參數
129例胰腺癌患者的治療計劃設計中選擇了7.5、10、12.5、15 、20、25、30、35、40 mm的準直器,其中選擇15 mm和20 mm準直器的最多,分別占27%和31%。僅有1例選擇7.5 mm的準直器,這是由于靶區體積較小。對于極大的靶區,且與OAR的距離很接近,可能需要選擇兩個準直器,如12.5 mm與25 mm、15 mm與35 mm的組合來完成設計。本研究中有6例方案選用了兩個準直器。
治療計劃的節點數為76±9、射野數為180±48、總跳數為7 061±2 801,治療時間為(42±8)min。
四、靶區體積、準直器大小與治療時間的關系
129例胰腺癌的靶區體積與單個準直器大小選擇及預計治療時間的關系見圖1。58%的腫瘤選擇直徑為20 mm和15 mm的準直器,預計治療時間平均為(42±8)min,但靶區體積越大不一定需要治療的時間越長。這與準直器大小的選擇、周圍危及器官的空間位置關系等因素有關,提示準直器的選擇對治療計劃方案的優化至關重要。
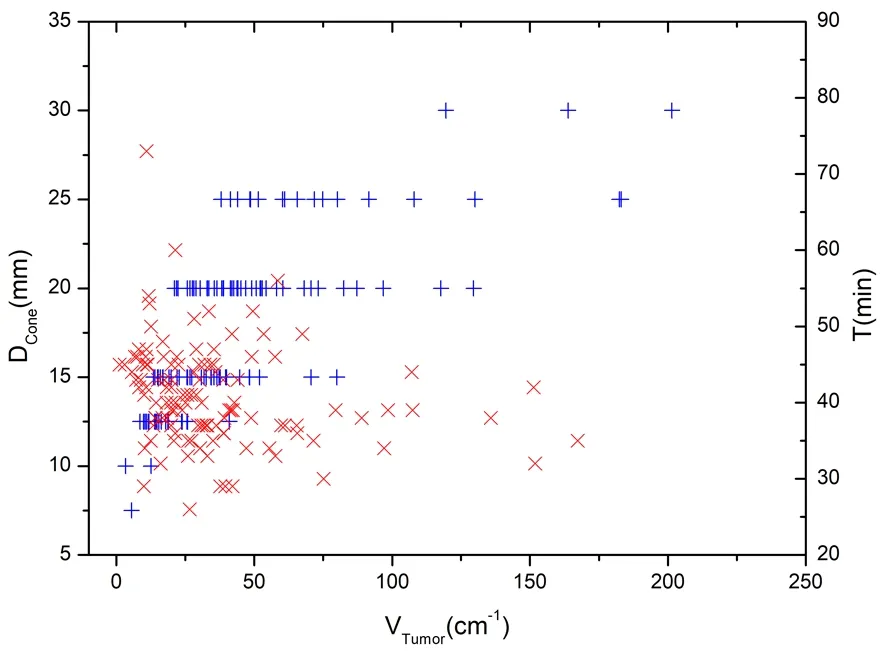
圖1 靶區體積與準直器大小(+)及預計治療時間(×)的關系圖
討 論
理論上認為,保證靶區體積接受足夠的劑量照射且保證靶區適形度,而正常危及器官的照射量越小越好,同時兼顧射野數、治療時間等機器參數,最終完美地實現多者的平衡,方能成為一個優秀的治療計劃方案。計劃方案中描述靶區適形指數的CI、nCI、HI以及靶區覆蓋率是用來綜合評估該方案質量的重要指標。處方等劑量線所包繞的所有組織體積與處方等劑量線包繞的腫瘤體積完全一致是最理想的,即CI為1,但實際CI值控制在1.2以內即可。本研究CI值為1.14±0.09,處方歸一百分劑量在70%左右,即HI值1.42±0.04,靶區覆蓋率在80.3%~95.6%,平均為(90.0±4.6%)%。所有計劃方案均實現了既保證靶區的的高度適形又滿足靶區的高覆蓋率。
根據TG101報告[13],對不同的危及器官規定了對給定體積內的耐受量、最大點劑量耐受量。本研究應用射波刀治療胰腺癌患者,在保護其正常組織方面有著獨特的優勢,即很好地避免了常規放療很難達到的胰腺腫瘤病灶周圍正常組織的損傷。但本研究的計劃方案中空回腸5 cc、十二指腸5 cc和10 cc、胃10 cc設計的計劃劑量分別由12%、40%、32%、24%的計劃降低到耐受量的50%以下,而左腎、右腎、脊髓、食管等其他正常組織幾乎所有的計劃劑量值都在耐受量的50%以下。理論上認為,計劃中的射線束越多,產生的內插誤差就越小,因為每個射束的誤差是隨機的,很多射束的作用耦合會平均正負誤差。但實際中須綜合考慮靶區覆蓋率、正常組織的保護及治療時間等多種因素。
本研究首次對行射波刀-SBRT治療胰腺癌的治療計劃方案參數進行較大樣本的研究。通過對所有參數進行分類,分析出相關參數的平均值與標準差,以及相關參數之間的關系。結果表明射波刀在治療胰腺癌上具有靶區適形度好、覆蓋率高、治療時間合理、能極好地保護胰腺病灶周圍正常組織等多重優勢。同時基于本課題組在臨床處方劑量的給定、節點等機器參數的范圍、正常危及器官的計劃劑量范圍等臨床經驗,可供同行評議及參考。對于靶區與危及器官的空間位置函數關系,以及對射線束、治療時間等的影響有待進一步深入研究。
(致謝:本工作特別感謝深圳市醫諾智能科技發展有限公司袁詩偉提供技術支持以及上海交通大學醫學院附屬瑞金醫院放療科賀曉東老師提供的寶貴建議)

