辛伐他汀PLGA緩釋微球對大鼠椎間盤退變的影響
陳 濤,奚菊群,劉忠軍,王靜成,馮新民,張 亮,*,楊建東*,黃澤楠,畢松超
(1.中南大學湘雅醫學院,長沙 410013; 2.揚州大學臨床醫學院,江蘇 揚州 225001;3.揚州大學醫學院藥學系,江蘇 揚州 225001; 4.北京大學第三醫院骨科,北京 100191)
腰痛已成為45歲以上人群功能受限的最主要原因,80%的成年人一生中受到不同程度的腰痛影響[1]。在美國,每年用于治療腰痛的花費高達1000億美元[2]。盡管腰痛的確切致病因素仍不明確,但研究發現至少40%的腰痛與椎間盤退變密切相關[3]。目前無論保守治療或手術治療均只能改善癥狀,無法實現改善椎間盤退變的本質。近年來,采用細胞生物學手段,通過促進細胞外基質合成或抑制其降解,以期從根本上延緩或逆轉椎間盤退變[4]。研究發現骨形態發生蛋白(bone morphogenetic protein,BMP)可以影響椎間盤細胞外基質的合成,上調BMP-2表達可以促進正常髓核細胞甚至是退變髓核細胞的細胞外基質II型膠原及蛋白多糖的表達,從而重建正常椎間盤的功能[5-6]。考慮到在脊柱融合手術中直接使用BMP的多種并發癥[7],因此直接將BMP用于椎間盤退變的治療存在一定風險。
他汀類藥物屬羥甲基戊二酰輔酶A(HMG -COA)還原酶抑制劑,臨床上廣泛用于高脂血癥的治療。研究發現,辛伐他汀可通過甲羥戊酸途徑上調髓核細胞中骨形態發生蛋白2(bone morphogenetic protein-2,BMP-2)得表達,從而促進II型膠原及蛋白多糖等細胞外基質表達[8]。鄒立學等[9]進一步研究發現小于0.4 μmol/L的較低濃度范圍內辛伐他汀對細胞活力無明顯影響。進一步將辛伐他汀植入大鼠退變椎間盤,治療2周后發現磁共振成像(magnetic resonance imaging, MRI)上椎間盤信號好轉,髓核細胞外基質合成增加,II型膠原及BMP-2 的mRNA表達增加[10]。然而辛伐他汀難溶于水,口服生物利用度低等缺點限制了其臨床應用。聚合物緩釋微球作為一種新型藥物載體,由天然或合成的高分子物質聚合而成,具有靶向給藥、提高藥物穩定性及控制藥物釋放等優勢。聚乳酸-羥基乙酸共聚物(poly(lactic-co-glycolic acid),PLGA)是一種常用的藥物緩釋系統,其負載的藥物已成功用于多種疾病動物模型的治療[11]。
因此,本研究通過在大鼠退變椎間盤內注入辛伐他汀-PLGA緩釋微球,通過影像學、組織學及分子生物學等評估對于椎間盤退變的影響。
1 材料和方法
1.1 實驗動物
清潔級雄性SD大鼠32只,3月齡,體重320~400 g,購自江蘇大學實驗動物中心[SCXK(蘇)2013-0011號],動物飼養及取材于揚州大學農學院動物實驗設施內進行[SYXK(蘇)2017-0044號],并通過揚州大學實驗動物福利倫理委員會的福利倫理審查。
1.2 主要試劑與儀器
辛伐他汀、PLGA(PLA: PGA=50:50,分子量=31000)、HEPES(美國Sigma公司);DMEM培養基(美國Gibco公司);二氯甲烷、聚乙烯醇、100%乙醇(國藥集團化學試劑北京有限公司);RT-PCR引物(上海吉凱生物);紫外可見光光度計(U-3900 Hitachi);掃描電鏡(S-4800II Hitachi);X線(MX-20,美國Faxitron公司);MRI(7.0T,Bruker Pharmascan公司)。
1.3 實驗方法
1.3.1 椎間盤退變動物模型的制備
采用本課題組既往的方法制備[12],1%戊巴比妥納溶液,以0.4 mL/kg經腹腔注射麻醉。達到麻醉效果后,用數字式鉬耗線攝像機拍攝大鼠尾椎正位片,定位Co6/7、Co7/8、Co8/9尾椎椎間隙(Co6/7、Co8/9作為穿刺組,Co7/8作為對照組)。大鼠俯臥位,消毒骶部及鼠尾,用21號注射針頭于背側中心經皮垂直穿刺入椎間隙約5 mm后,注射針頭旋轉360度,并停留30 s。術后再次消毒,并密切觀察至麻醉蘇醒,放回籠中自由活動。
1.3.2 辛伐他汀PLGA緩釋微球制備
將PLGA與辛伐他汀按質量比10∶3.3共同溶解于二氯甲烷中,形成均勻分散液;加入200 μL水,超聲混合;緩慢加入10 mL的5%聚乙烯醇水溶液中,超聲粉碎3 min,加入50 mL 0.3%聚乙烯醇水溶液中,攪拌過夜,除凈有機溶劑;冷凍干燥48 h,獲得辛伐他汀PLGA緩釋微球。
1.3.3 微球的包封率及載藥量測定
精確稱量5 mg 的微球,配成100 mL的乙醇溶液,以乙醇為空白對照,在238 nm處測定吸光度,根據標準曲線計算微球中辛伐他汀含量。根據以下公式計算包封率和載藥量:包封率=微球中的辛伐他汀總量/微球總量×100%,載藥量=實際載藥量/理論載藥量×100%。
1.3.4 緩釋微球形態觀察及微球的體外釋放
通過掃描電鏡觀察微球形狀、大小和表面形態。取干燥的辛伐他汀PLGA緩釋微球及空白微球粉末各0.005 g,用20 mL磷酸鹽緩沖液 (pH=7.4)分散,37℃水浴;分別于不同時間間隔取3 mL上清液,用新鮮磷酸鹽緩沖液3 mL補足原液;紫外可見光光度計檢測各試樣于238 nm處的吸收值,通過標準曲線方程求出各試液中辛伐他汀濃度,計算累積釋放量,確定載藥微球的辛伐他汀釋放曲線。
1.3.5 實驗分組及處理
在實驗動物造模完成2周后將模型動物尾椎Co6/7節段作為對照組,Co8/9作為實驗組,每組16只。對照組注入等量生理鹽水,實驗組注入辛伐他汀PLGA緩釋微球溶液2 μL,注射時采用生理鹽水將微球濃度調整到5 mg/mL,為防止PLGA微球溶液的弱酸性特征,故釆用DMEM培養基、HEPES及NaHCO3將溶液pH值調整到中性。使用31G針頭的微量注射器,手術方法同模型建立,注射后,在局部停留30 s,保證注射液不會溢出,同時每次注射后都更換新的無菌微量注射器。
1.3.6 X線觀察椎間隙高度
在注射前、注射后2周及4周時進行大鼠尾椎X線檢查,掃描參數為50 kV,100 mA,50 ms。根據X線計算椎間隙高度指數(disc height index, DHI)用以表示椎間隙高度[7],相對椎間隙高度指數(DHI%)=(穿刺后DHI/穿刺前DHI)×100%。
1.3.7 核磁共振成像(magnetic resonance imaging,MRI)檢查
在注射前、注射術后2周及4周時采用進行MRI檢查,掃描參數如下:序列重復時間/回波時間為3000/30 ms,層厚0.5 mm,間隔0 mm。根據矢狀位T2WI像Pfirrmann進行分級評分[13]。
1.3.8 組織學檢查
MRI掃描后采用注射戊巴比妥過量麻醉法處死,切取對照組及實驗組椎間盤(包含上下終板),4%多聚甲醛固定3 d,脫鈣處理,石蠟包埋后切片,進行蘇木素-伊紅(HE)染色,并按照Keorochana等[14]方法評分;甲苯胺藍染色按照Norcross等[15]方法進行評分。
1.3.9 RT-qPCR檢測
處死后的大鼠,切取對照組及實驗組椎間盤,將髓核剪成1 mm3左右小塊并研磨,采用Trizol法提取總RNA,按照qPCR試劑盒操作說明書進行BMP-2、低氧誘導因子1α(hypoxia inducible factor-1α,HIF-1α)、II型膠原及蛋白多糖mRNA表達檢測,同時將甘油醛-3-磷酸脫氫酶(GAPDH)作為內參照。RT-qPCR反應步驟:95℃ 20 s,95℃ 5 s,60℃ 20 s,重復40個循環,每次循環讀取Ct(cycle threshold)值,重復3組。所得各組Ct值用2-△△Ct表示計算各靶基因相對表達水平。各引物序列信息見(表1)。
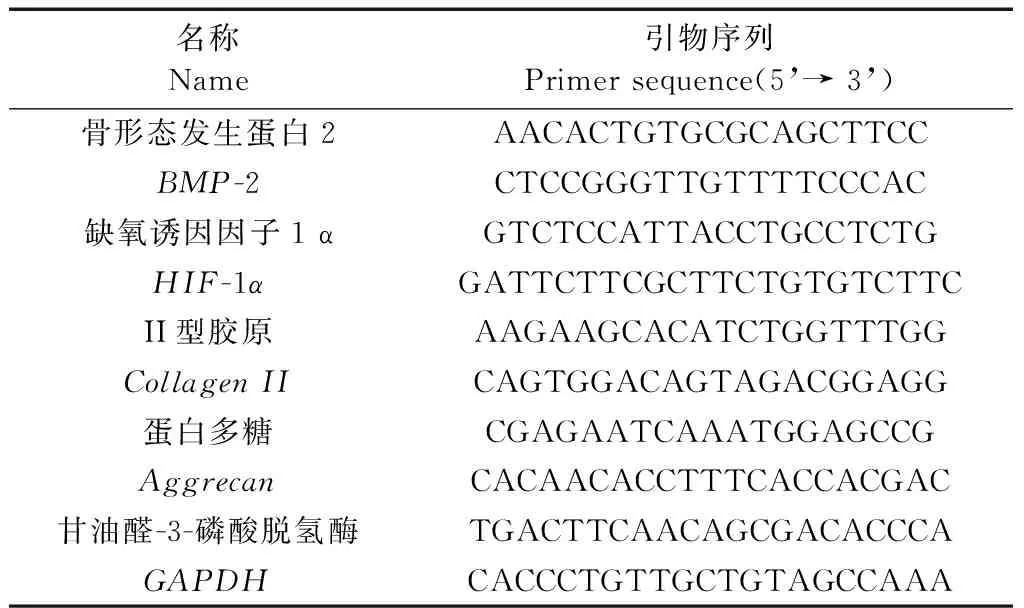
表1 引物序列Table.1 Primer sequences
1.4 統計學方法
2 結果
2.1 辛伐他汀PLGA緩釋微球的表征
圖1a可見辛伐他汀PLGA緩釋微球呈球形、形狀規則,分散性好且無聚集現象,表面光滑,分布均勻,平均粒徑為(1.52 ± 0.54)μm。微球載藥率為(23.3±1.3)%,包封率為(90.4±2.6)%。圖1b所示,微球包裹的辛伐他汀在最初24 h內存在藥物突釋現象,約占藥物總量的45%,而在隨后144 h內持續緩慢釋放辛伐他汀且釋放濃度較穩定,累計釋放超過81.2%。由此可見,本實驗制備的辛伐他汀PLGA緩釋微球能夠滿足緩釋要求。
2.2 相對椎間隙指數
圖2所示,對照組椎間隙高度進一步降低,與治療前相對椎間隙指數比較,2周及4周時差異均有顯著性(P< 0.05)。實驗組治療后椎間隙高度降低不明顯,與治療前相對椎間隙指數比較,差異無顯著性(P> 0.05);但4周時與對照組比較,差異有顯著性(P< 0.05)。
2.3 MRI評分
圖3所示,對照組椎間盤退變程度進一步加重,與治療前MRI評分比較,2周及4周時差異均有顯著性(P< 0.05)。實驗組治療后椎間盤退變程度有所減輕,與治療前MRI評分比較,4周時差異有顯著性(P< 0.05);與對照組同時間點比較,差異均有顯著性(P< 0.05)。
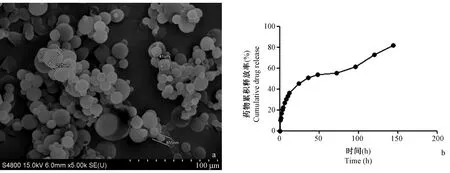
注:(a)辛伐他汀PLGA緩釋微球的掃描電鏡圖片;(b)微球藥物釋放曲線。圖1 辛伐他汀PLGA緩釋微球形態及藥物釋放曲線Note.(a)SEM image of simvastatin-loaded PLGA microspheres.(b)Cumulative drug release rate of microspheres.Figure.1 SEM image of simvastatin-loaded PLGA microspheres and cumulative drug release rate
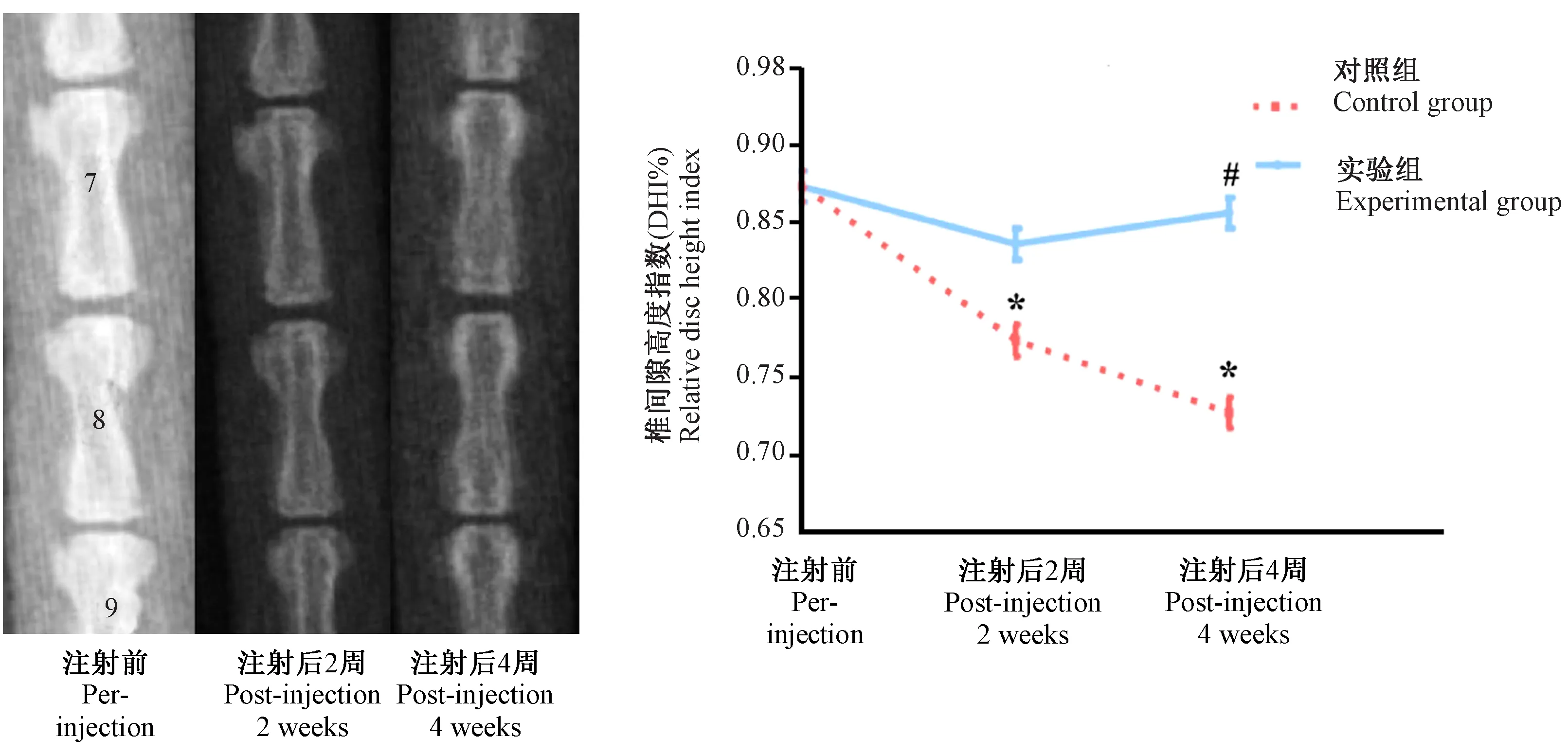
注:與同組注射前比較,*P< 0.05;與對照組比較,#P< 0.05。圖2 對照組及實驗組椎間隙高度及相對椎間隙高度指數Note.Compared with the pre-injection,*P< 0.05.Compared with the control group,#P< 0.05.Figure.2 The disc height and DHI% of the control group and experimental group
2.4 蘇木素-伊紅染色結果
圖4所示,對照組HE染色評分逐漸增加,4周時與治療前比較差異有顯著性(P< 0.05)。實驗組治療后HE染色評分逐漸降低,與治療前及對照組相同時間點比較,差異均有顯著性(P< 0.05)。
2.5 甲苯胺藍染色結果
圖5所示,對照組甲苯胺藍染色評分逐漸降低,4周時與治療前比較差異有顯著性(P< 0.05)。實驗組治療后甲苯胺藍染色評分逐漸增加,4周時與治療前比較差異有顯著性(P< 0.05);與對照組同時間點比較,差異均有顯著性(P< 0.05)。
2.6 RT-qPCR檢測結果
與對照組比較,實驗組中BMP-2、HIF-1α、II型膠原及蛋白多糖表達明顯增加,差異有顯著性(P< 0.05),但2周與4周時比較,差異無顯著性(P> 0.05)。(圖6)
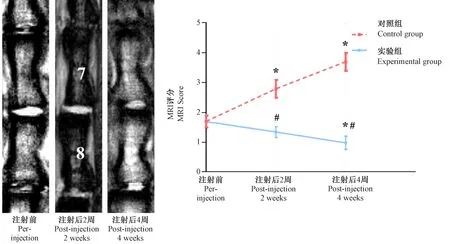
注:與同組注射前比較,*P< 0.05;與對照組比較,#P< 0.05。圖3 對照組及實驗組MRI影像及評分Note.Compared with the pre-injection,*P< 0.05.Compared with the control group,#P< 0.05.Figure.3 MRI images and scores of the control group and experimental group
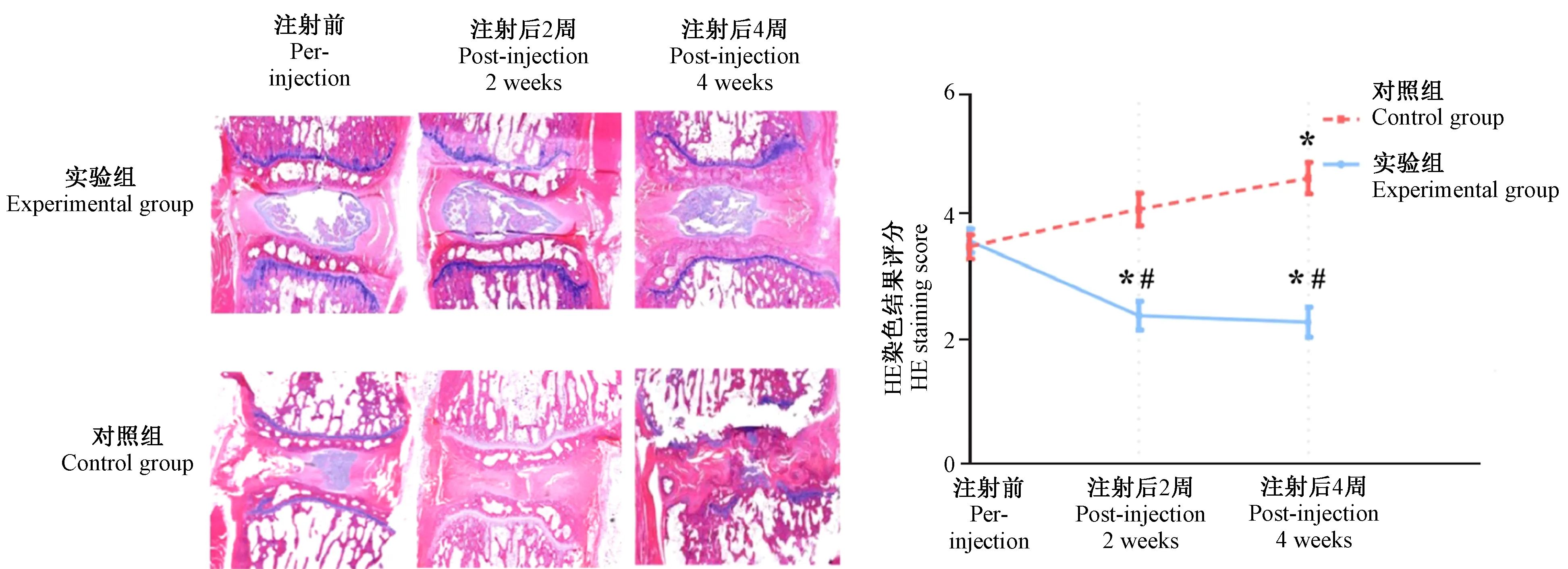
注:與同組注射前比較,*P< 0.05;與對照組比較,#P< 0.05。圖4 對照組及實驗組HE染色圖像及HE染色評分Note.Compared with the pre-injection,*P< 0.05.Compared with the control group,#P< 0.05.Figure.4 The HE staining images and scores of the control group and experimental group
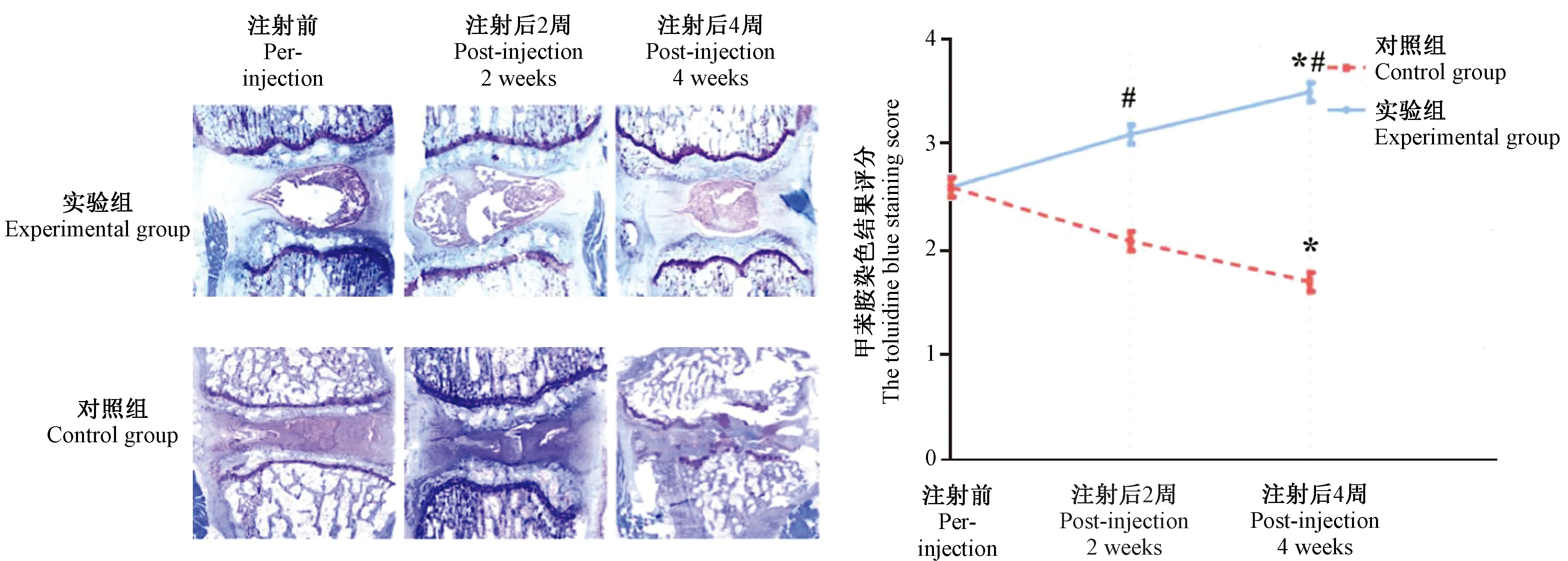
注:與同組注射前比較,*P< 0.05;與對照組比較,#P< 0.05。圖5 對照組及實驗組甲苯胺藍染色圖像及甲苯胺藍染色評分Note.Compared with the pre-injection,*P< 0.05.Compared with the control group,#P< 0.05.Figure.5 The toluidine blue staining images and scores of the control group and experimental group
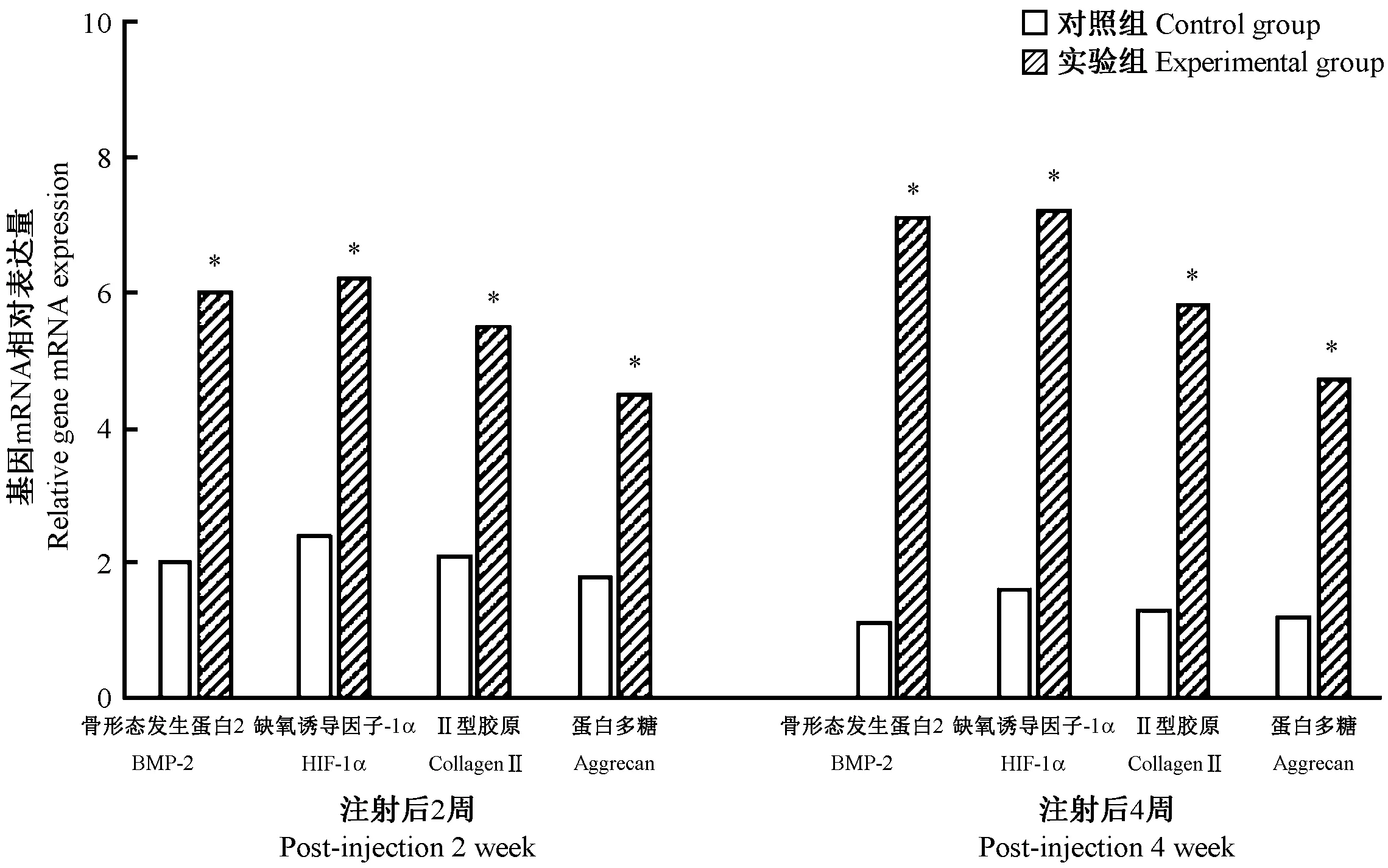
注:與同時間點對照組比較,*P< 0.05。圖6 對照組及實驗組的BMP-2、HIF-1α、Collagen II 和Aggrecan基因mRNA相對表達量比較Note.Compared with the control group,*P< 0.05.Figure.6 BMP-2, HIF-1α, collagen II, and aggrecan mRNA expression of the control group and experimental group
3 討論
研究表明,辛伐他汀可促進Π型膠原及聚集蛋白聚糖等椎間盤細胞細胞外基質的mRNA表達[8-9]。本課題組前期研究發現合適濃度的辛伐他汀可以促進椎間盤髓核內源性干細胞增殖及細胞外基質分泌,同時有助于誘導髓核干細胞向髓核細胞分化[16-17]。因此本研究通過建立椎間盤退變動物模型,研究椎間盤內局部注射PLGA辛伐他汀緩釋微球的治療效果,以期延緩甚至逆轉椎間盤退變進程。結果發現在椎間盤退變2周后注射PLGA辛伐他汀緩釋微球,MRI上椎間盤退變評分明顯改善,并且在注射后4 周時達到最佳;組織學評分在治療后逐漸好轉,且細胞外基質成分II型膠原及蛋白多糖mRNA表達逐漸增加,與文獻報道類似[10]。說明辛伐他汀PLGA緩釋微球可以有效改善椎間盤退變進程。
高分子材料PLGA因具有良好的生物降解性、相容性、無刺激性、無免疫原性及無毒等特點,已被廣泛用于藥物緩釋和被動靶向給藥系統,且已用于臨床[11]。因此本研究選擇PLGA作為緩釋材料負載辛伐他汀,以提高辛伐他汀使用效率。從PLGA辛伐他汀緩釋微球的體外釋放曲線可看出,緩釋微球包裹的辛伐他汀可以達到較穩定的緩釋效果,保證椎間盤內穩定的藥物濃度,為退變椎間盤提供可靠的再生環境。
對于辛伐他汀促進椎間盤退變修復的機制,目前研究認為辛伐他汀主要通過上調髓核細胞中BMP-2表達,從而促進髓核細胞外基質的表達[5,9-10]。而Hu等[18]研究發現他汀類藥物可使單層培養的已去分化的髓核細胞表型發生逆轉,從而促進II型膠原等細胞外基質表達。本課題組前期研究還發現適當濃度的辛伐他汀可在體外促進內源性髓核干細胞增殖和細胞外基質Ⅱ型膠原及蛋白多糖的分泌,其機制可能與HIF-1α信號通路有關[16, 19]。Liu等[20]研究發現HIF-1α可以通過NOTCH1信號途徑調節椎間盤髓核細胞中蛋白多糖及II型膠原表達,從而影響椎間盤退變進程。於紹龍等[21]研究還發現,HIF-1α基因可以增強轉染BMP-2基因的骨髓間充質干細胞的成骨分化能力,說明一定程度上HIF-1α可以促進BMP-2在目標細胞中發揮應有作用。結合本研究結果,注射辛伐他汀PLGA緩釋微球后椎間盤中HIF-1α及BMP-2表達均明顯增加,表明辛伐他汀可能通過HIF-1α及BMP-2途徑來促進髓核細胞外基質表達,以及促進髓核組織中殘留的髓核干細胞增殖等途徑,來實現修復重建退變椎間盤的目的,但具體作用機制及信號通路仍需進一步研究明確。
本研究仍存在一些不足,盡管細針穿刺纖維環制作的椎間盤退變動物模型在組織學與人類椎間盤退變進程相似,但兩者生理病理過程是否完全相同仍不可知,且因種屬不同,因此應用于臨床時應慎重。另外,本研究未比較不同濃度梯度的辛伐他汀PLGA緩釋微球的療效,無法得到最佳藥物濃度。
綜上所述,本實驗發現在局部注射辛伐他汀PLGA緩釋微球可以改善SD大鼠椎間盤退變程度,其機制可能與HIF-1α及BMP-2信號通路有關,這為辛伐他汀用于治療椎間盤退變性疾病提供了一定的理論依據。

