淺議分析化學配位滴定法的教學要點
2018-09-03 07:12:08趙景波
安徽化工
2018年4期
趙景波
(安徽工業職業技術學院,安徽 銅陵244000)
作為化學分析中的四大滴定之一的配位滴定,在測定溶液中金屬離子的含量時有著顯著的優點,表現為簡便快速,準確度高,應用范圍廣,但也有其局限性,即干擾離子多,選擇性差。本文從配位滴定的理論出發來闡述該滴定法,有待對高職分析化學配位滴定法的教學有所幫助。
1 配位滴定原理
配位滴定法是以配位反應為基礎的滴定方法。我們知道適用于滴定的化學反應必須滿足如下條件:①反應能定量完成;②反應速率快;③能用簡便的方法確定滴定終點。由于許多無機配合物不夠穩定,配位過程中有逐級配位的現象產生,而各級穩定常數相差又不大,導致滴定終點不明顯。自從1945年出現氨羧配位體之后[1],使配位滴定的應用得到了迅速發展,其中乙二胺四乙酸(簡稱EDTA)是配位滴定中應用最廣的配位劑。EDTA學名乙二胺四乙酸,是一種有機弱酸,分子式簡寫為H4Y,結構式如下:
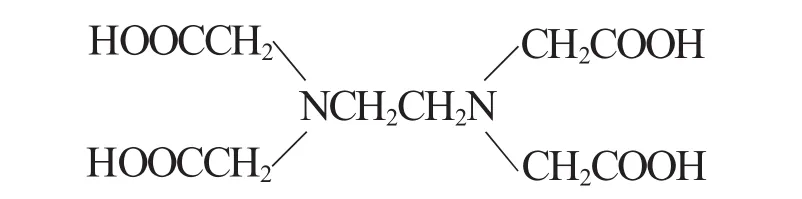
乙二胺四乙酸在水溶液中由于N原子上的孤電子對的極化作用,羥基上的氫原子轉移到氮原子上,使分子具有雙偶極離子結構:
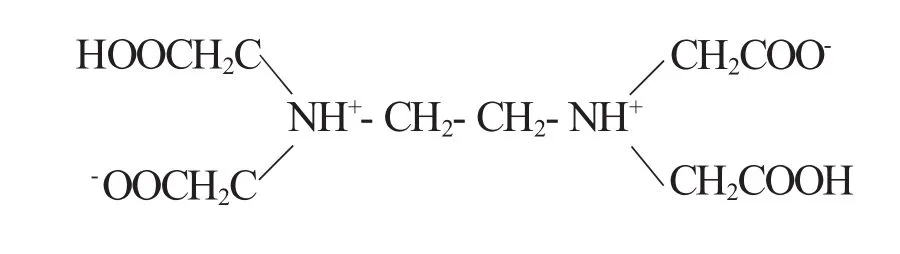
當H4Y溶解于水時,如果溶液的酸度很高,它的兩個羧基可再接受兩個質子(H+),形成H6Y2+,因此ETDA就相當于有機六元酸[2]。由于EDTA為有機弱酸,在水溶液中溶解度很小,實際應用中常用它的二鈉鹽Na2H2Y·H2O,它的溶解度大,適應于水溶液中的滴定,一般也簡稱為EDTA。EDTA分子中的兩個氮原子和四個羥基中的氧原子與絕大多數金屬離子都能形成五元環穩定的如下螯合物:
登錄APP查看全文

