殼聚糖修飾植物甾醇脂質體的制備及穩定性研究
程 銘 焦文佳 陶 冶 夏廉臣 王雪暉 王春維,2
(武漢輕工大學食品科學與工程學院1,武漢 430023) (國家糧食局糧油資源綜合開發工程技術研究中心2,武漢 430023)
植物甾醇和膽固醇同屬甾醇類,都是以環戊烷全氫菲為骨架的一種醇類化合物,在結構上極其相似,植物甾醇與膽固醇的不同之處在于其支鏈上的雙鍵和甲基[1]。植物甾醇較膽固醇支鏈更長,有更強的疏水性[2],可降低人體對膽固醇的吸收。膽固醇是脂質體等藥物輸送體系的重要組成部分,可嵌入磷脂雙分子層,調節磷脂膜的穩定性。隨著現代人健康生活意識的不斷提高,膽固醇的應用對于一些高血脂人群受到限制,為此學界開始植物甾醇取代膽固醇制備脂質體的研究。Marie等[3]發現植物甾醇可以降低大豆磷脂膜的通透性;楊貝貝[4]的研究也表明混合植物甾醇對脂質體形成、膜的穩定性、包埋力作用比膽固醇要大。且植物甾醇在人體內吸收率較低[5],過量攝入也不會對人體造成危害,已被證實是一種綠色安全的降膽固醇藥物,其取代膽固醇制備脂質體是國內外研究熱點。
脂質體是由磷脂分散在水中形成的封閉囊泡結構,是優良的藥物運輸載體,可用于包埋親水性和疏水性活性成分,具有靶向、緩釋、降低毒性和提高藥物穩定性等作用。但其自身穩定性易受外界環境如pH、溫度、離子強度等影響。殼聚糖是一種天然的高分子生物材料,其在酸性溶液中呈現陽離子性質,可通過靜電相互作用與帶負電的脂質體結合,在脂質體表面形成一層保護膜;此外疏水相互作用、氫鍵、范德華力等多種相互作用力的存在使殼聚糖修飾脂質體的結構變得更加豐富而復雜[6]。劉瑋琳等[7]發現以殼聚糖修飾的脂質體比未修飾的脂質體穩定,且高濃度殼聚糖修飾脂質體穩定性更好。帥武平等[8]考察了不同相對分子量的殼聚糖對脂質體性質的影響,得到較高相對分子質量殼聚糖修飾的脂質體具有更好的穩定性和抗血清能力,同時其細胞毒性要小于陽離子脂質體。嚴佳蕾等[9]研究了不同濃度殼聚糖修飾脂質體對包載姜黃素的效果,發現0.4%的殼聚糖對姜黃素脂質體保護效果最佳。
殼聚糖修飾脂質體對于提高體系穩定性,降低藥物的泄漏率具有重要意義,但目前對植物甾醇脂質體的研究較少,殼聚糖修飾植物甾醇脂質體的研究也鮮見報道。本實驗通過乙醇注入法制備植物甾醇脂質體,并以不同濃度殼聚糖對其進行修飾、優化配比,考察了pH、溫度、離子強度等對CS-PLs穩定性的影響,并通過模擬人體胃腸環境探究了脂質體的消化穩定性。
1 材料與方法
1.1 材料與試劑
植物甾醇(>95%):武漢遠成共創科技有限公司;大豆卵磷脂(70%)、殼聚糖(脫乙酰度≥95%):aladdin試劑公司;胃蛋白酶、胰酶:Sigma-Aldrich公司;無水乙醇、鹽酸、氫氧化鈉、膽鹽等試劑均為分析純:國藥集團化學試劑有限公司。
1.2 儀器與設備
DF-101S集熱式恒溫加熱磁力攪拌器:鞏義市予華儀器有限責任公司;T18高速分散機:IKA公司;R-3旋轉蒸發儀:瑞士Buchi公司;pH計:上海奧豪斯儀器有限公司;Nano-ZS粒度儀:英國Malvern公司;Turbiscan Lab穩定性分析儀:法國Formulaction公司;JEM-2100透射電鏡:日本電子株式會社。
1.3 方法
1.3.1 CS-PLs的制備
采用乙醇注入法[10]制備PLs,將大豆卵磷脂與植物甾醇按4∶1的比例溶于無水乙醇中,使磷脂濃度為40 mg/mL,超聲溶解。在高速分散(10 000r/min)條件下,按有機相與水相比例為1∶5,將卵磷脂植物甾醇混合液緩慢注入水中,繼續分散2 min,旋轉蒸發去除乙醇,加水稀釋至原水相含量,得到PLs。
殼聚糖溶液的制備:稱取0.2 g殼聚糖粉末溶于100 mL 1%乙酸水溶液中,40 ℃水浴攪拌溶解,過濾除去不溶物,置于4 ℃冰箱中水化過夜,取出后稀釋備用。
分別將PLs加入等體積不同濃度的殼聚糖溶液中,調節pH至3.5,在10 000 r/min下高速分散2 min,得到CS-PLs。
1.3.2 CS-PLs理化性質表征
1.3.2.1 粒徑與Zata電位測定
樣品用去離子水稀釋至一定濃度后,采用動態光散射技術測定植物甾醇脂質體平均粒徑、多分散系數(Polydispersity index,PdI)和Zeta電位。
1.3.2.2 CS-PLs穩定性分析
采用多重光散射技術(掃描波長880 nm),分析不同環境下脂質體的穩定性。將制備好的樣品振蕩搖勻,倒入樣品池中,測定脂質體的穩定性指數TSI(Turbiscan Stability Index)。測試樣品加入量為15~20 mL,測定溫度為25 ℃,測定時間為1 h,掃描間隔為25 s。
1.3.2.3 CS-PLs形態觀察
取制備好的CS-PLs樣品1 mL,用去離子水稀釋至磷脂質量濃度為0.8 mg/mL,滴至專用銅網上,濾紙吸干多余脂質體;用3%磷鎢酸進行負染色,并用濾紙輕輕吸干多余染液,自然揮干,透射電鏡下觀察脂質體微觀結構。
1.3.3 CS-PLs體外消化穩定性
1.3.3.1 消化液配制
參照Liu等[11]報道的模擬胃腸消化液的配制方法并加以改進。胃液儲備液(Simulated gastric fluid, SGF)的配制:取2 gNaCl溶于800mL去離子水中,用0.1 mol/LHCl調節其pH至2.0,定容至1 L,4 ℃儲藏備用。腸液儲備液(Simulated intestinal fluid, SIF)的配制:取6.8 gKH2PO4溶于800 mL去離子水中,用0.1 mol/LNaOH調節pH至7.0,定容至1 L,4 ℃儲藏備用。胃蛋白酶和胰酶分別用胃腸儲備液溶解,3 000 r/min離心取上清液。
1.3.3.2 體外模擬胃腸消化
胃消化:將10 mL脂質體與9 mLSGF混合于50 mL離心管,調節pH至2.0,在37 ℃恒溫水浴搖床上,以95 r/min轉速平衡10 min,加入1 mL胃蛋白酶(80 mg/mL),開始消化。
腸消化:將膽鹽溶于SIF(20 mg/mL)中,攪拌溶解。取10 mL脂質體與9 mLSIF膽鹽混合液于50 mL調節pH至7.0,在37 ℃恒溫水浴搖床上,以95 r/min 轉速平衡10 min,然后加入1 mL胰酶(160mg/mL),開始消化。
分別在15、30、60、120、180 min取樣測定消化后脂質體粒徑、電位大小。
2 結果與分析
2.1 不同濃度殼聚糖修飾PLs的制備
以不同濃度的殼聚糖溶液修飾PLs,所得CS-PLs中殼聚糖質量濃度分別為0、0.1、0.2、0.3、0.4、0.6、0.8 mg/mL。如表1所示,當pH為3.5時,低濃度的殼聚糖對脂質體粒徑和PdI影響較小;當殼聚糖質量濃度達到0.3 mg/mL以上時,脂質體中會出現較大顆粒,且多分散性變差。未添加殼聚糖脂質體粒徑較小,由于磷脂帶負電,脂質體也呈負電位。而殼聚糖表面帶正電荷,隨著殼聚糖的加入,殼聚糖吸附在磷脂膜上,使脂質體電位由負轉正,且殼聚糖濃度越高,脂質體電位越大。當殼聚糖質量濃度達到0.3 mg/mL時,殼聚糖吸附達到飽和,繼續提高殼聚糖濃度會增加脂質體修飾層厚度,導致粒徑增加,而電位變化不顯著。因此,選擇0.3 mg/mL殼聚糖為最佳質量濃度修飾PLs,分析CS-PLs的穩定性影響因素。

表1 不同濃度殼聚糖修飾LPs的平均粒徑、PdI和Zeta電位
由圖1可知,通過激光粒度儀測定乙醇注入法制備的PLs粒徑為70.4 nm,PdI為0.377,粒徑分布范圍廣,并有較多大顆粒存在。經0.3 mg/mL殼聚糖修飾后,脂質體粒徑雖有所增加,達到76.73 nm,但PdI降低到0.246,且粒徑分布更集中,大顆粒較少。CS-PLs的透射電鏡測定結果如圖2所示,脂質體呈規則圓球狀,粒徑為60~70 nm,較激光粒度儀測定結果偏小,這可能是由于透射電鏡樣品制片時脫水而引起[12]。

圖1 殼聚糖修飾前后LPs粒徑分布

圖2 CS-PLs透射電鏡圖
2.2 CS-PLs穩定性影響因素
電位是評定脂質體穩定性的重要指標之一,脂質體表面所帶電荷越高,顆粒間靜電斥力越大,脂質體越穩定。除此之外空間位阻、顆粒尺寸和流變性等也常用于評價脂質體的穩定性。穩定性分析儀通過檢測樣品在靜置過程中粒子的遷移,可較真實地反映脂質體的穩定性變化;TSI越小,反應乳液體系越穩定。杭鋒等[13]通過測定不同溫度下超高溫滅菌乳的TSI,構建了乳品貨架期加速實驗數學模型,并預測了超高溫滅菌乳的貨架期。黃波等[14]以TSI為指標,優化了微乳液超聲條件。本實驗以脂質體的粒徑、電位為主要指標,并通過測定其TSI值,綜合評價了脂質體在不同環境下的穩定性。
2.2.1 pH對CS-PLs穩定性影響
新鮮制備的PLs,加入殼聚糖后,分別調節pH至2.0、3.0、4.0、5.0、6.0、7.0,經高速分散后,測定CS-PLs穩定性。用相應pH的去離子水稀釋脂質體,測定其粒徑與電位。
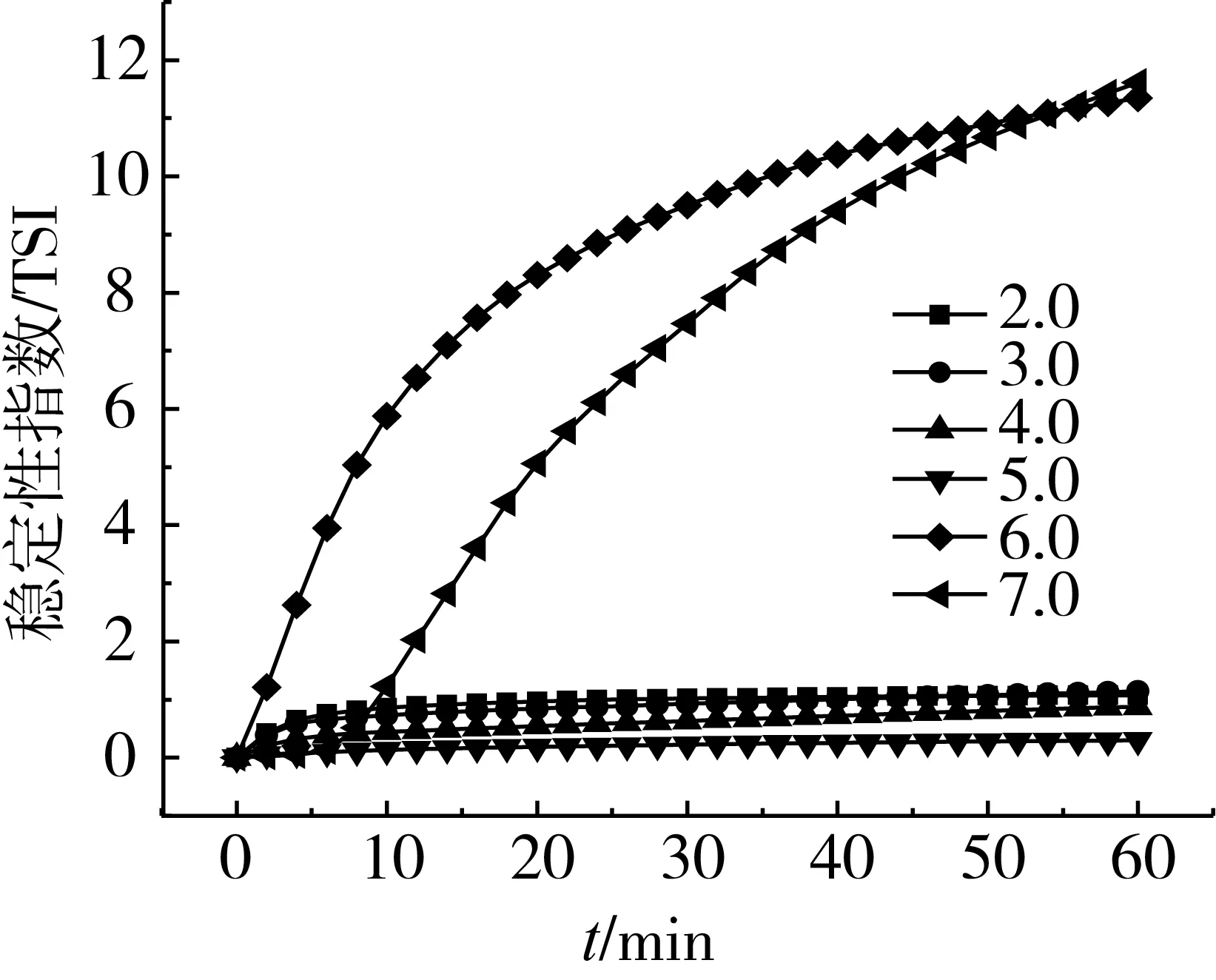
圖3 pH對CS-PLs穩定性指數影響
表2 pH對CS-PLs穩定性影響

pH平均粒徑/nmPdIZeta電位/mV物理穩定性2.078.18±1.760.271±0.02143.6±1.27穩定3.078.35±0.430.252±0.00560.4±0.44穩定4.085.96±1.060.293±0.02257.7±1.76穩定5.0133.87±3.780.893±0.02939.9±0.87穩定6.03 193.67±419.000.869±0.16323.8±0.50分層7.02 709.63±1 586.830.964±0.06215.2±0.31分層
如表2所示,當pH為2~4時,CS-PLs粒徑均在100 nm以下,并表現出良好的分散性;當pH≥5時,CS-PLs粒徑開始增大,且多分散性也開始變差。由圖3可知,隨著pH增大,CS-PLs穩定性反而增強,當pH達到6時,CS-PLs大量聚集,出現沉淀,其TSI均在10以上。與Sonvico等[15]的研究結果相似,即當pH從2.5增加到5時,卵磷脂-殼聚糖納米粒的粒徑和電位變化較小,當pH大于5時,納米粒電位顯著下降,且出現聚集。Liu等[16]等以卵磷脂-殼聚糖納米粒包載胰島素,發現當pH由2增加到5.5時,納米粒粒徑和胰島素包埋率逐漸增加,當pH為6時則出現沉淀。分析其主要原因可能是由于殼聚糖的等電點為6.5左右,當pH接近6時,CS-PLs表面弱的靜電相互作用不足以維持結構穩定,顆粒開始聚集,并出現沉淀。
2.2.2 溫度對CS-PLs穩定性影響
新鮮制備的CS-PLs,用穩定性分析儀分別在25、30、40、50、60 ℃下測定穩定性,每個樣品掃描時間為12 h,掃描間隔10 min,取出樣品后測定脂質體粒徑與電位。
溫度是影響脂質體穩定性的重要因素之一。如表3所示,隨著溫度的升高,CS-PLs粒徑逐漸增大,多分散性變差,但其電位、外觀無顯著變化。由圖4可見,在常溫環境下,CS-PLs的TSI仍在1以下,穩定性良好;經加熱后,CS-PLs的TSI迅速上升,其主要是由于在加熱條件下,脂質體分子運動更加劇烈,加速了磷脂分子層的水解與氧化,結構破壞[17]。而約2 h后,TSI又呈現緩慢下降趨勢,其可能是殼聚糖充分溶脹,重新自組裝成穩定顆粒,提高了CS-PLs穩定性。

表3 溫度對脂質體穩定性影響

圖4 溫度對CS-PLs穩定性指數影響
2.2.3 離子強度對CS-PLs穩定性影響
新鮮制備的CS-PLs,分別加入10、25、50、100、150、200 mmol/L的NaCl和CaCl2,調節脂質體的離子強度,37 ℃水浴攪拌10 min,通過穩定分析儀測定脂質體的穩定性。并分別用對應濃度的NaCl和CaCl2溶液稀釋脂質體,測定其粒徑和電位。
如表4所示,NaCl濃度對CS-PLs穩定性有顯著影響,當濃度為10 mmol/L時,脂質體粒徑為87.14 nm,多分散性較好;隨著NaCl濃度的加大,鹽離子的存在會屏蔽脂質體表面電荷,使脂質體電位逐漸降低,粒徑顯著增大,穩定性變差。曹金娜等[18]也發現當NaCl濃度大于20 mmol/L時,脂質體穩定性較差。如圖5所示,穩定性分析也表現出相似結果。

圖5 NaCl濃度對CS-PLs穩定性指數影響
表4 NaCl濃度對CS-PLs穩定性影響

NaCl濃度/mmol/L平均粒徑/nmPdIZeta電位/mV物理穩定性1087.14±0.520.307±0.0341.2±0.98穩定25197.55±7.690.578±0.0237.9±1.93分層501 358.67±59.970.608±0.1529.6±0.55分層1001 361.67±245.490.720±0.4924.5±0.78分層1501 241.03±440.110.677±0.0620.2±0.80分層2001 786.24±841.120.964±0.06219.0±0.87分層
對于陰離子脂質體,Ca2+可以在脂質體之間形成“鹽橋”,增加磷脂膜疏水性,導致脂質體的失穩[19]。經殼聚糖修飾后,CS-PLs表面帶正電荷,加入Ca2+并未引起脂質體的聚集。如表5所示,CS-PLs對CaCl2表現出較好的耐受性,在200 mmol/LCaCl2的環境下也能維持穩定。鹽離子的存在也會影響脂質體表面電荷,隨著離子強度的增加,脂質體電位逐漸降低。如圖6所示,穩定性分析顯示,不同離子強度下,CS-PLs的TSI均在1以下,當CaCl2濃度為100 mmol/L時,脂質體的TSI最小為0.4,比未添加Ca2+的脂質體表現出更好的穩定性,其可能原因是由于金屬離子的作用使酰基鏈的排列更加緊密,降低了磷脂膜的流動性,從而提高CS-PLs穩定性[20]。

圖6 CaCl2濃度對CS-PLs穩定性指數影響
表5 CaCl2濃度對脂質體穩定性影響

CaCl2濃度/mmol/L平均粒徑/nmPdIZeta電位/mV物理穩定性10106.83±13.760.373±0.0638.07±2.29穩定25100.10±10.960.440±0.0825.57±0.74穩定5092.07±9.930.376±0.0622.10±2.42穩定100102.63±17.460.380±0.1319.43±0.68穩定150102.17±4.100.493±0.0918.40±1.25穩定200116.81±27.910.398±0.0417.37±1.55穩定
2.3 CS-PLs體外消化穩定性
由圖7可知,在模擬胃環境中,PLs與CS-PLs隨著消化時間的延長,粒徑均略有增加,經3 h消化后,其平均粒徑大小均能維持在120 nm以下,說明兩種脂質體在酸性環境均能保持良好的穩定性。由于加入的胃蛋白酶對脂質體沒有影響,故測得模擬胃液中兩種脂質體在不同消化時間段電位無顯著差別。在強酸性環境下,PLs所帶負電荷被中和,電位增加為-10 mV左右,而CS-LS自身帶正電荷,大量H+的存在屏蔽了殼聚糖表面所帶電荷,電位下降到30 mV。

圖7 模擬胃消化環境下脂質體粒徑、電位變化

圖8 模擬腸消化環境下脂質體粒徑、電位變化
在模擬腸液中,因加入的胰酶中含有一定量的胰脂肪酶,可水解脂質體中的磷脂,破壞了脂質體的結構。如圖8所示,PLs在模擬腸液中,粒徑先增大,然后逐漸降低,磷脂分子層的破壞造成脂質體粒徑增大,而腸液中含有大量膽鹽,在37 ℃條件下,大的顆粒會重新自組裝成微膠束,粒徑減小。Liu等[21]以大豆磷脂和牛奶磷脂制備脂質體,在體外腸消化過程中也得到了相似的結果。PLs經殼聚糖修飾后,脂質體表面包裹了一層保護殼,降低了脂質體與胰脂肪酶的接觸機會,從而可有效減輕脂質體的破壞程度[22]。由結果可知,CS-PLs在中性環境中穩定性較差,在模擬腸液環境中會形成沉淀物,但消化15 min后,混合物粒徑也逐漸降低,且較PLs具有更小的粒徑。
3 結論
本研究通過粒徑、電位等的測定,確定了殼聚糖修飾PLs的最佳質量濃度為0.3 mg/mL;且發現pH、溫度、鹽粒子種類及其濃度均對CS-PLs穩定性影響較大;所以選擇適宜的制備工藝和儲藏條件對維持脂質體穩定具有重要意義。在模擬胃環境中殼聚糖修飾前后PLs均表現出良好的穩定性,而模擬腸環境中,經修飾后的PLs粒徑更小更穩定。本研究對CS-PLs在不同條件下的穩定性進行了探討,為CS-PLs的進一步研究和應用提供參考。

