黑果枸杞無菌苗愈傷組織誘導體系的建立
李琳 杜倩 梁素鈺


摘要:? 以黑果枸杞為主要研究對象,利用組織培養技術,研究不同濃度的植物生長激素對黑果枸杞愈傷組織形成的影響,及不同外植體器官對愈傷組織誘導分化的影響,同時對其野生資源保護和利用提供技術支持。研究結果表明:最佳愈傷組織誘導培養基為MS + 2,4D 0.4 mg/L + 6-BA 0.2 mg/L;黑果枸杞根、莖、葉誘導愈傷組織率均高于98%,但莖和葉的誘導時間較短為15天。
關鍵詞:? 黑果枸杞;? 愈傷組織誘導;? 外植體
中圖分類號:? ?S 567. 9, S 603. 6? ? ? ? ? ? ? ? ? 文獻標識碼:? ?A
黑果枸杞(Lycium ruthenicum) 為茄科 (Solanceae) 枸杞屬 (Lycium)多年生灌木,富含花青素、類胡蘿卜素、維生素等多種營養成分,還含有豐富的Fe、Zn、Se等微量元素[ 1 - 5 ]。近年來,黑果枸杞藥用價值及營養保健作用被廣泛傳播,市場需求量激增,野生黑果枸杞的價格飛速上漲,巨大的經濟利益使得銷售者不顧生態環境延續性,開展了毀滅性采摘,從而導致野生黑果枸杞資源破壞嚴重[ 6 - 7 ]。目前對黑果枸杞的醫藥研究主要集中在化學活性成分及活性成分提取方面[ 8 - 14 ]。因此,本研究選用種子萌發20天的黑果枸杞無菌苗子葉為外植體,探究不同植物生長激素對愈傷組織誘導的影響,然后選取最優配比對黑果枸杞子葉、下胚軸、胚根等不同外植體器官進行愈傷組織誘導研究,建立黑果枸杞愈傷組織誘導體系,為今后進一步優化黑果枸杞無菌苗組培快繁體系奠定基礎。
1 材料與方法
1. 1 材料
本研究選用的黑果枸杞種子購買于青海省寧夏市。
1. 2 方法
1. 2. 1 種子的消毒
將黑果枸杞種子浸于蒸餾水中,于4℃冷藏過夜后,棄去浮于上方的干癟種子,并將其反復沖洗多次,去除果肉等雜質,以免消毒不徹底導致種子萌發過程中真菌感染。將沖洗后的種子用75%酒精和NaClO進行消毒,消毒時間分別為30 s和5~10 min,換用消毒劑時用無菌水沖洗3~5次,最后用無菌水沖洗3~5次,待用。
1. 2. 2 黑果枸杞無菌苗的種植
將消毒后的黑果枸杞種子播種于1/2MS培養基上,在組織培養室中進行培養。培養條件為:溫度25℃,光照時間12 h/天,光照強度2 000~2 500 lux。
1. 2. 3 愈傷組織誘導培養基的選擇
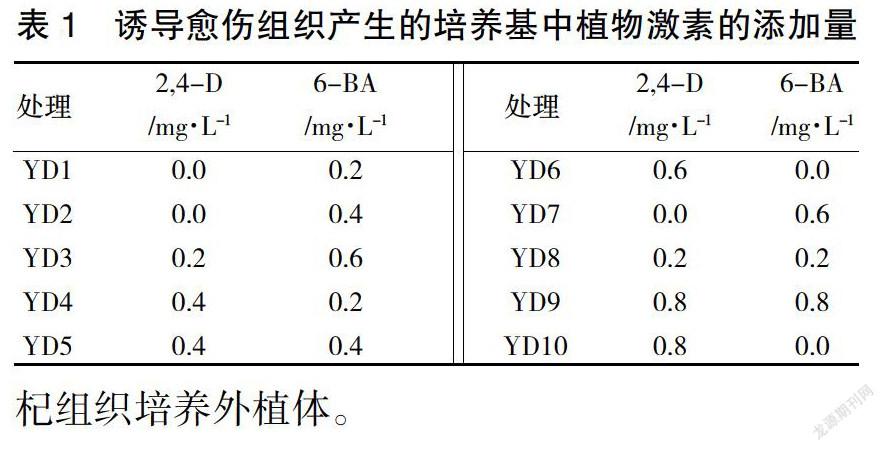
以黑果枸杞無菌苗子葉為外植體,用剪刀將葉片剪成0.5 cm的小塊,葉片的正面朝上接種到以MS基本培養基,在培養基上添加不同濃度2,4-D(0、0.2、0.4、0.6、0.8 mg/L)和6-BA(0、0.2、0.4、0.6、0.8 mg/L)誘導愈傷組織(表1),每個培養瓶接種5塊外植體,每6個培養瓶為一個處理,每處理重復3次。20天后統計形成愈傷組織的百分率,進行愈傷組織誘導培養基的篩選。
1. 2. 4 不同外植體類型對愈傷組織誘導和分化的影響
為找到最適合黑果枸杞組織培養的外植體,本研究將萌發10天無菌苗的子葉、下胚軸、根作為外植體接種到篩選出的最優愈傷組織誘導培養基中,3周后統計愈傷組織數,選擇出最適黑果枸杞組織培養外植體。
2 結果與分析
2. 1 愈傷組織誘導培養基的選擇
愈傷組織在添加10種不同激素配比的誘導培養基上(3次重復)培養3周后,均誘導出愈傷組織(表2),YD4、YD5、YD6的誘導率高于98%,YD7、YD9、YD10上的誘導率90%以上,YD8誘導率83%左右,YD3誘導率71.11%,而YD1、YD2誘導率低于10%,顯著低于其他梯度。YD6的愈傷組織增殖最快,但愈傷組織呈現為水浸狀;YD4、YD5培養基中誘導出的愈傷組織增殖較快,形成淡黃色質地疏松的愈傷組織團;YD1、YD2、YD7雖然誘導出愈傷組織,但為深綠色顆粒狀緊密愈傷組織團;YD7愈傷組織褐化;YD3、YD8、YD9的愈傷組織上誘導的愈傷,顏色為淡黃色、質地緊密呈顆粒狀,YD9愈傷組織少許褐化。
單獨使用6-BA,低濃度下對誘導愈傷作用較小,而高濃度下能夠誘導愈傷,但愈傷組織長勢不好,發生褐化;單獨使用2,4-D能誘導出愈傷組織,但是愈傷組織呈水浸狀,高濃度下發生褐化。說明了黑果枸杞誘導愈傷組織對2,4-D敏感,2,4-D濃度0.4 mg·L-1配合低濃度6-BA誘導愈傷組織效果最好。
2. 2 不同外植體器官對愈傷組織誘導和分化的影響
將黑果枸杞萌發10天的無菌種子苗的子葉、下胚軸、胚根作為外植體,分別接種到2.1中確定的最適愈傷誘導培養基MS + 0.4 mg/ml 2,4D + 0.2 mg/ml 6-BA中,3周后統計愈傷組織數(表3)可知:黑果枸杞種苗下胚軸、子葉、胚根都表現了極高的愈傷組織誘導率,其中胚根誘導出愈傷組織的時間最短為10天,子葉及下胚軸均為15天,但是胚根誘導形成的愈傷組織經過多次繼代,愈傷組織逐漸褐化,幾乎無法分化出叢生芽,而子葉和下胚軸誘導形成的愈傷組織能夠正常誘導分化出叢生芽,但是由于下胚軸誘導出的愈傷組織體積較小,在規模化培養中產量低于子葉誘導的愈傷組織,因此工廠化組培快繁體系應選用子葉為外植體為最佳。
3 結論與討論
3. 1 喬永旭[ 15 ]以子葉、下胚軸、胚根3種器官為外植體誘導愈傷組織研究表明:黑果枸杞下胚軸誘導率最高,與本研究不一致,該現象可能是由于選取的植物生長素不同,及生長素與分裂素比例差異造成的。植物組織培養過程中常用的生長素有2,4D,NAA、IAA等,生長素具有促進細胞延長、誘導愈傷組織形成等作用,而常見的細胞分裂素6-BA、KT等能夠促進植物細胞的分裂與膨大。當植物生長素與細胞分裂素的比值低時,有利于叢生芽誘導,當比值高時,有利于生根誘導。
3. 2 高濃度的細胞分裂素會導致玻璃化苗的出現,尤其是6-BA濃度與玻璃化苗的發生呈顯著正相關,因此在植物組織培養中6-BA的濃度不易過高。本研究結果表明:適于黑果枸杞愈傷組織誘導培養基的6-BA濃度在0.4 mg/L為宜。褐化是植物組織培養中常出現的顯現,褐化產物對植物組織細胞中的許多酶產生抑制作用,從而導致植物材料逐漸死亡。研究表明:多種植物組織培養外植體的選擇、培養條件等因素有關。外植體的選擇以幼芽為佳,老齡外植體和根尖均有一定程度的褐化現象。此外,培養過程中溫度過高、光照時間過長、光照強度過大也是造成褐化的主要原因。
3. 3 本研究中組織培養基最佳愈傷組織誘導培養基為MS + 2,4D 0.4 mg/L + 6-BA 0.2 mg/L;黑果枸杞下胚軸、子葉、胚根誘導愈傷組織率均高于98%,但莖和葉的誘導時間較短為15天。
參考文獻
[1] 藺定運,? 李煒,? 甘青梅,? 等.? 黑果枸杞果實色素的初步研究[J].? 中國食品添加劑,? 1995(2):? 5 - 9.
[2] 陳亮,? 張煒,? 陳元濤,? 等.? 響應曲面法優化黑果枸杞多糖的超聲提取工藝[J].? 食品科技,? 2015,? 40(1):? 220 - 227.
[3] 任小娜,? 陳志梅,? 曾俊,? 等.? 黑果枸杞中原花青素提取條件的優化與含量測定[J].? 食品與發酵工業,? 2015,? 41(1):? 147 - 150.
[4] 韓愛芝,? 白紅進,? 耿會玲,? 等.? 響應面法優化超聲輔助提取黑果枸杞葉片總黃酮的工藝研究[J].? 西北林學院學報, 2013,? 28(1):? 114 - 118, 122.
[5] 馬繼雄.? 道地藥材黑果枸杞的應用研究進展及青海的發展前景[J].? 青海師范大學學報:? 自然科學版,? 2012, 28(3):? 53 -56,? 85.
[6] 甘青梅,? 駱桂法,? 李普衍, 等.? 藏藥黑果枸杞開發利用的研究[J].? 青海科技,? 1997(1):? 17 - 19.
[7] 馮建森,? 劉志虎.? 酒泉市野生黑果枸杞資源及利用[J].? 林業實用技術,? 2013(2):? 62 - 64.
[8] 浩仁塔本,? 趙穎,? 郭永盛,? 等.? 黑果枸杞的組織培養[J].? 植物生理學通訊,? 2005(41)5:? 631.
[9] 馬彥軍,? 程艷青,? 張榮梅.? 黑果枸杞組織培養快繁技術研究[J].? 林業科技通訊,? 2015(5):? 26 - 28.
[10] 楊寧,? 李宜珅,? 陳霞,? 等.? 黑果枸杞的組織培養和快速繁殖[J].? 西北師范大學學報(自然科學版),? 2:? 84 - 88.
[11] 孫曉紅,? 位書磊,? 宋強,? 等.? 黑果枸杞的葉片分化與快速繁殖[J].? 植物生理學報,? 2015(5):? 653 - 658.
[12] 李冬杰.? 植物生長調節劑對黑果枸杞愈傷組織誘導、 增殖及分化的影響[J].? 河北林業科技,? 2016(4):? 1 - 5.
[13] 冀菲,? 唐曉杰,? 程廣有.? 黑果枸杞組培繁殖培養基選擇[J].? 北華大學學報(自然科學版),? 2016,? 17(4):? 537 - 538.
[14] 王祎,? 趙彤彤,? 楊魏,? 等.? 紅松成熟合子胚愈傷組織誘導的適宜培養條件[J].? 森林工程,? 2015,? 31(2):? 5 - 7.
[15] 喬永旭.? 黑果枸杞高頻再生體系的建立[J].? 中藥材,2015,? 38(10):? 2 031 - 2 034.
Establishment of Callus Induction of Non-bacterial Seedling
of Lycium ruthenicum
(The Key Laboratory of Forest and Forestry Ecological Engineering in Heilongjiang Province,? Heilongjiang Forest Engineering and Environment Research Institute,? Heilongjiang Harbin 150081)
Abstract This study selected Lycium ruthenicum as the main research object, using tissue culture technology, the effects of different concentrations of plant growth hormone and different explants on callus formation were studied, which could provide technical support for its protection and utilization of the wild. The results showed that the optimal callus induction medium was MS + 2,4D 0.4 mg·L-1 + 6-BA 0.2 mg·L-1. The callus rate of root, stem and leaf was more than 98%, but the induction time of stem and leaf was 15 days shorter.
Key words Lycium ruthenicum;? Callus induction;? Explant

