25份鳶尾屬植物基因組DNA C值的流式測定
林 峰, 肖月娥, 周翔宇, 唐 穎, 高步紅
(1. 南京林業大學,江蘇南京210037; 2. 上海植物園,上海200231; 3. 上海辰山植物園,上海201602)
核基因組大小是指單套染色體組的DNA含量,C值指生物體不復制的單倍體細胞核(無論倍性水平)的DNA總含量。Greilhuber和Bennett[1]為了區分與理解兩者的關系,提出了“1C值”、“1CX值”的概念,分別對應整倍體和一倍體的基因組大小。對于二倍體生物,1C=1CX;對于多倍體,1C>1CX。基因組大小對許多研究領域至關重要,包括研究植物的分類、進化、規劃基因組測序等方面[2]。測定基因組大小的方法主要有3種:基因組測序法、孚耳根微顯影(Feulgen microdensitometry)以及流式細胞術(Flow Cytometry,FCM),FCM因方便、快速、可靠而成為首選方法。該法的樣品制備通常只需要幾分鐘,不需要昂貴的試劑,分析速度快,即測即得,在以往研究中被廣泛應用[3]。
鳶尾屬(IrisL.)屬鳶尾科(Iridaceae),也是鳶尾科中最大和最復雜的屬。據統計目前已知的鳶尾屬植物共計300余種。鳶尾屬植物生長的氣候帶以北溫帶為主,分布區域集中在亞洲、歐洲及北美洲。我國也是鳶尾屬植物的分布中心之一,已知的種有64個,變種13個,此外還有1個亞種和6個變型主要分布于西南、西北和東北。該屬植物具有廣泛的生物活性,包括抗炎類豐富,抗氧化劑和癌癥化療防護性能。據報道,鳶尾屬大約有二百多個化合物,其中包括黃酮、異黃酮及其苷類、萜類和芪苷類。目前,該屬植物在國內外已被廣泛研究和應用。研究內容包括分類[4]、育種[5]、生理[6]、生化[7]、種質資源[8]等各個方面。
根據DNAC值庫(http://data.kew.org/cvalues)[9]查詢,國外已報道了38份、共計35種鳶尾草植物C值的檢測結果,占該屬6%,國內尚無鳶尾屬相關檢測的報道。本研究以25 份鳶尾屬嫩葉材料為基礎,利用流式檢測手段對其進行基因組大小檢測,旨在為鳶尾屬的基因組學、細胞生物學和種質資源研究提供研究基礎。
1 材料與方法
1.1 材料
1.1.1待測樣品與標樣 內標玉米(Zeamays‘CE-777’)、番茄(LycopersiconesculentumL. ‘Stupicke polni tyckove rane’)由捷克共和國科學院植物研究所分子細胞遺傳學與細胞術實驗室的Dolezel教授惠贈,與25份鳶尾一同在上海辰山植物園科研苗圃栽培。本試驗均使用播種后1~3個月的嫩葉為材料。
1.1.2儀器與試劑 流式細胞儀型號為Influx (美國BD公司);濾網、熒光染料、鞘液、培養皿、試劑均購自南京博巧生物技術有限公司。
1.2 方法
1.2.1解離液與熒光染料配置 選用LB01為解離液,其配方為(15 mmol·L-1Tris,2 mmol·L-1EDTA Na2,0.5 mmol·L-1四鹽酸精胺,80 mmol·L-1KCl,20 mmol·L-1NaCl,0.1%(v/v)TritonX-100,pH=7.0~8.0)。碘化丙啶(propidium iodide,PI) 配置至終濃度為50 μg·mL-1,藥品均于4℃冰箱保存。
1.2.2細胞核懸液制備與DNA特異性染色 向塑料培養皿中加入1 mL(LB01)解離液,先放入1.5 g左右的樣品嫩葉,再放入0.5 g左右的番茄嫩葉(或玉米嫩葉1.5 g左右),用鋒利的刀片快速切碎,將培養皿擺成斜面,使液體和切碎的材料流至皿底半弧側,用槍頭輕吸打液體,吸取培養皿中的解離液(棄去碎材料)于1.5 mL EP管,用400目濾網過濾,并置于冰中孵育5 min。離心:轉速1 100 r·min-1,溫度4℃,時間5 min。吸除上清液,再加入150 μL冰解離液。在250 μL解離液中加入0.5 μL PI儲備液,使終濃度達100 μg·mL-1,再加入終濃度為10 μg·mL-1的RNase,避光,在冰箱孵育3~5 min。上機檢測:低速(上樣速度約500~1 000個顆粒·秒-1)、收集10 000個顆粒。
1.2.3確定對照與處理熒光強度大致范圍 采用番茄、玉米作為內標,在上機檢測中,先分別以兩種內標單獨上機檢測,初步確定內標的相對熒光強度范圍,保存檢測模板,在同一檢測模板下,隨機選取三個鳶尾,確定其相對熒光強度范圍,作下記錄,結合機器的調節條件及便于識別,本試驗所有的內標峰均為P1峰,樣品峰為P2峰(如圖1、圖2)。
1.2.4兩種內標的采用 由于樣品與內標的C值大小相差太小或者太大,將造成峰形的重疊或者無法同時呈現在一張圖上,25份鳶尾均分別采用了番茄、玉米嫩葉為內標,其中13種鳶尾采用番茄、9種鳶尾采用玉米為內標,其余3種則分別采用上述兩種嫩葉內標。
1.3 數據分析
熒光染料PI的激發波長為488 nm,收集通道為FL2(670±30 nm)、檢測PI的發射熒光強度。變異系數(coefficient of variation,CV)控制在5%以內。使用BD Influx自帶軟件FACSTM Sortware 1.0.0.650 進行分析。番茄1C基因組大小為958 Mbp[10],玉米1C基因組大小為2 655 Mbp[11],根據公式[12]:待測樣本的細胞核DNA含量(=對照樣本細胞核DNA含量×(待測樣本G0/G1峰熒光強度/對照樣本G0/G1峰熒光強度)。每個樣本做3~6次平行試驗,選取CV值最小的3次結果進行計算,使用SPSS 19進行統計分析。
2 結果與分析
2.1 基因組C值的分析
如圖1所示,P1峰代表番茄的相對熒光強度,P2分別代表樣品的相對熒光強度:編號1A~1F的直方圖中,P2峰分別代表:華夏鳶尾2 (Iriscathayensis)、野鳶尾(白花)(I.dichotoma)、喜鹽鳶尾(I.halophila)、扇形鳶尾(I.wattii)、鳶尾7(I.tectorum)、鳶尾6(I.tectorum)。如圖2所示,PI峰代表玉米的相對熒光強度,P2分別代表樣品的相對熒光強度:編號2A~2F的直方圖中,P2峰分別代表:扇形鳶尾(I.wattii)、鳶尾7(I.tectorum)、鳶尾6(I.tectorum)、馬藺(I.lactea)、膜苞鳶尾1(I.scariosa)、鳶尾4(I.tectorum)。
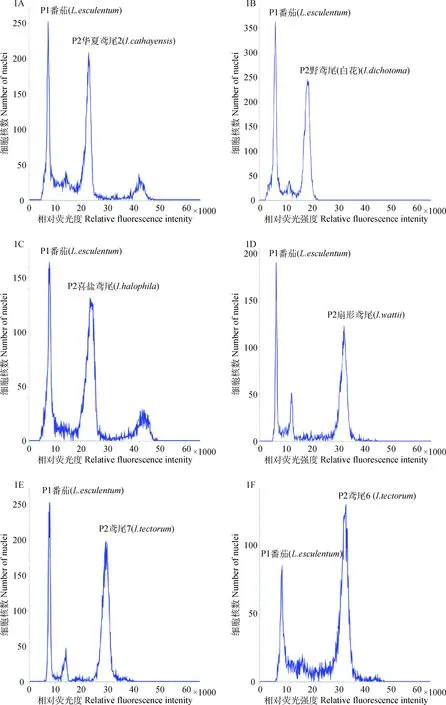
圖1 番茄與6種鳶尾樣品混合樣品流式細胞儀測定結果Fig.1 Test results of Lycopersicon esculentum and Iris samples mixed samples using FCM注:P1峰:番茄內標;P2峰:鳶尾樣本Note:Peak1:L.esculentum;Peak2:Iris samples

圖2 玉米與6種鳶尾樣品混合樣品流式細胞儀測定結果Fig.2 Test results of Z.mays and Iris samples mixed samples using FCM注:P1峰:玉米內標;P2峰:鳶尾樣本Note:Peak1:Z.mays;Peak2:Iris samples
2.2 與同屬物種C值的比較
全世界鳶尾屬植物約有300種,目前僅38份共計35 種的C值被測定,1C值范圍在4.00~28.20 pg之間,其中4.00~8.00 pg的有16種,8.01~13.00 pg的有17種,大于12.00 pg的有5種,分別占已測種的42.1%、44.7%和13.2%,鳶尾種間C值差異較大。本研究計算得到的結果見表1、表2。最大的1C值為膜苞鳶尾1(6.77 pg)、最小的為小鳶尾(2.62 pg)。單因素方差分析表明,25份鳶尾材料被分成15組,組間有顯著性差異(P<0.05),鳶尾的C值大小差異性較大,這與此前報道的同屬植物C值差異大的情況吻合。
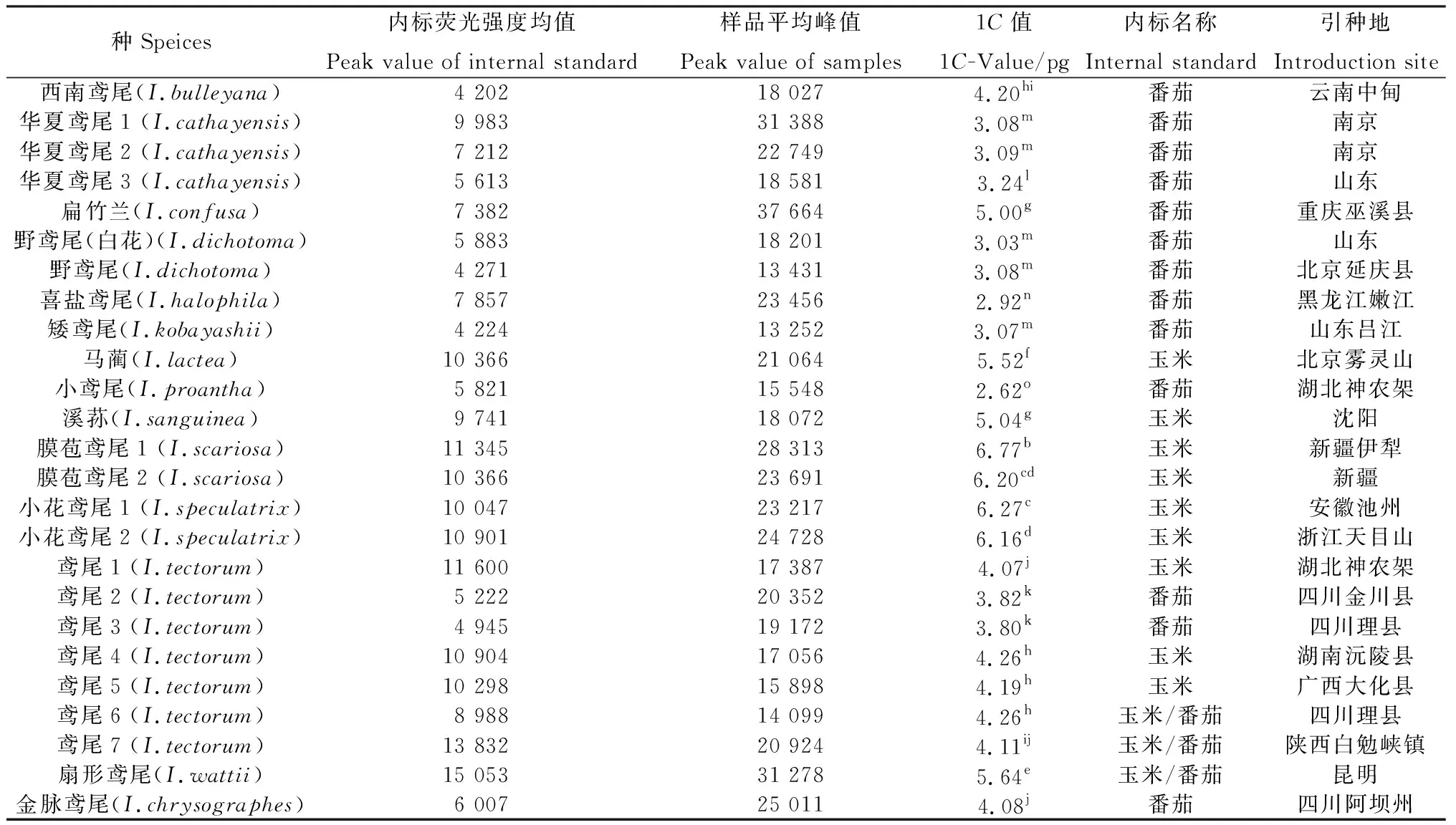
表1 25份鳶尾屬植物的C值Table 1 Genomic C values of 25 Iris samples
注:同列不同小寫字母表示差異顯著(P<0.05),下同
Note:Different lowercase letters in same column indicate significant difference at the 0.05 level,the same as below
2.3 種鳶尾采用兩種內標的比較
由于本次試驗采用兩種內標,為了驗證兩種內標的可靠性,選擇了扇形鳶尾及鳶尾 6、鳶尾 7為代表,分別以玉米與番茄作內標,并計算1C值大小,方差分析結果表明,用兩種內標測定的C值無顯著性差異(表2),即番茄或玉米均可作為鳶尾屬植物的內標。

表2 兩種內標分別測定3種鳶尾屬植物的C值Table 2 Genomic C values of3 Iris samples by 2 different Internal standard
注:同列不同小寫字母表示差異顯著(P<0.05)
Note:Different lowercase letters in same column indicate significant difference at the 0.05 level
3 討論
方差分析表明,25份鳶尾屬的DNAC值可分為15組,組間具有顯著差異,同一種鳶尾、來自不同引種地的樣品之間也存在顯著性差異;如三份華夏鳶尾,其中引種地同為南京的兩份無顯著性差異,而與引種地為山東的鳶尾有顯著性差異,1C值為3.08~3.24 pg。兩份引種地同為新疆的膜苞鳶尾1C值分別為6.20 pg、6.77 pg;兩份小花鳶尾1C值分別為6.27 pg、6.16 pg,也都具有顯著性差異。7份鳶尾的1C值變化范圍從3.80~4.26 pg不等。以上材料組間雖然有顯著性差異,但是1C值相差并不大,差距在±0.50 pg以內。兩份野鳶尾則無顯著性差異,1C值分別為3.03 pg和3.08 pg。Hanson等[13]測試了2份萱草狀鳶尾(I.tubergeniana),其1C值分別為9.39 pg和11.03 pg;兩份替代鳶尾(I.vicaria) 的1C值分別為8.46 pg和15.03 pg;兩份白邊鳶尾(I.albomarginata) 1C值分別為10.18 pg和18.83 pg,可見,同一種的鳶尾很可能C值大小不一。基因組大小的變化可能歸因于染色體片段的擴增和缺失導致重復序列拷貝數的變化[14]。Knight[15]等綜述了與植物DNA含量變化相關的因素,例如物種多樣性、海拔、緯度、溫度、降水、種子質量等。本次的25份鳶尾引種自湖北、四川、北京等14個省市(自治區),引種地之間的氣候、海拔、降水等差異較大,很可能導致其1C值間的顯著性差異。
FCM測定基因組大小的要求一個已知的基因組參考標準,內部標準(內標)可以防止因儀器漂移或染色不均勻而導致的誤差[16]。本次實驗均采用內標進行測定。在前處理過程中,若以番茄為內標,由于鳶尾屬的葉片比番茄硬、厚,可先切好鳶尾的葉片后再加入番茄葉片切碎,且鳶尾屬植物的葉片需要多放一些。若以玉米為內標則可以遵循1:1的原則,放入面積相似的葉片同時切碎即可。在上機檢測中,要關注液流變化,確保儀器一直處于在最佳狀態;可以在FSC或FL2設置閾值,盡量保持內標峰與樣品峰高度一致。
在檢測基因組大小的試驗中,通常使用1種內標[17],本次試驗待測的植物樣品較多,為了使樣品峰和內標峰不重疊、距離適中、CV值小,使用了玉米和番茄兩種內標,且挑選了其中的3種鳶尾屬植物,采用了雙標進行驗證,方差分析表明,用兩種內標分別測得的基因組DNAC值無顯著性差異,數據結果可靠,單內標通常需要3~6次重復,而兩種內標只需要兩次測定即可相互驗證,該方法可以更加高效。
4 結論
本試驗基于流式細胞儀術測得25份鳶尾屬的DNAC值,鳶尾屬植物的C值變化較大,DNA 1C值最大的為6.77 pg,最小的為2.62 pg。流式細胞術通過測定DNA含量和基因組大小,可預測該品種的未知染色體數目,從而使基因和基因組分析更有效,該技術也可為鳶尾屬植物資源的收集、鑒定、保護和育種等提供理論依據。

