鳥苷酸激酶OsGK1對水稻種子發育至關重要?
李景芳 田云錄 劉喜 劉世家 陳亮明 江玲 張文偉 徐大勇 王益華,* 萬建民
?
鳥苷酸激酶OsGK1對水稻種子發育至關重要?
李景芳1田云錄1劉喜1劉世家1陳亮明1江玲1張文偉1徐大勇2王益華1,*萬建民1
(1南京農業大學 作物遺傳與種質創新國家重點實驗室/農業部長江中下游粳稻生物學與遺傳育種重點實驗室/長江流域雜交水稻協同創新中心/江蘇省現代作物生產中心,南京 210095;2連云港市農業科學院 江蘇 連云港 222000;*通訊聯系人,E-mail: yihuawang@njau.edu.cn)
【目的】對水稻粉質皺縮突變體進行表型分析及基因克隆,為闡明水稻淀粉合成機制以及胚的發育奠定基礎。【方法】來自粳稻品種滇粳優1號的MNU(N-甲基-N-亞硝基脲)誘變突變體庫。本研究考查了突變體籽粒的理化性狀,利用掃描電鏡和半薄切片觀察了淀粉顆粒的結構;構建了與N22的F2群體,通過圖位克隆及轉基因互補驗證確定目標基因;通過qRT-PCR以及GUS活性染色對進行組織表達分析;免疫印跡分析了突變體中淀粉合成相關基因以及線粒體基因的蛋白變化。【結果】籽粒粉質皺縮,千粒重顯著下降;胚乳中淀粉顆粒變小變圓,排列松散,不能形成正常的復合淀粉顆粒;突變體中總淀粉、直鏈淀粉含量均顯著下降,脂肪含量顯著上升,突變體淀粉的糊化特性發生明顯改變。編碼一個線粒體和質體雙定位的鳥苷酸激酶(guanylate kinase),命名為OsGK1。在各器官中組成型表達,并在花后6 d的胚乳中表達水平最高。突變體胚乳中淀粉合成相關蛋白水平顯著降低,尤其是AGPS2b和PHOI。此外,突變體的胚發育嚴重受損,導致種子純合致死;線粒體定位的AOX積累顯著增強,而野生型中幾乎檢測不到,表明線粒體呼吸途徑受損。【結論】由于OsGK1的功能缺陷,導致水稻種子中線粒體和造粉體發育異常,進而產生了胚致死以及胚乳粉質皺縮的表型,因此OsGK1對水稻種子的發育至關重要。
水稻;粉質皺縮胚乳;鳥苷酸激酶;種子發育;淀粉合成
水稻(L.)是世界一半以上人口的主要食物,提高水稻產量和品質是水稻遺傳改良最主要的目標[1]。胚乳作為水稻籽粒的可食用部分,其發育直接影響稻米的產量和品質。水稻成熟胚乳中主要含有淀粉、貯藏蛋白、脂質等成分,其中,淀粉含量最高,約占胚乳干質量的70%。因此,淀粉的合成量很大程度上決定了稻米的產量,同時淀粉含量、組成和結構對稻米的品質起著決定性作用。因此,深入研究淀粉的合成及其調控機制對提高稻米產量、改良稻米品質具有重要的意義[2-4]。
谷類作物中淀粉在胚乳造粉體(一種特化的質體)中合成[5]。稻米中的淀粉分為直鏈淀粉和支鏈淀粉。直鏈淀粉是由α-1,4-糖苷鍵連接組成的線性分子,而支鏈淀粉是線性鏈上具有高度分支的α-1,6-糖苷鍵的葡聚糖分子。支鏈淀粉分子具有明顯的簇狀結構,占儲存淀粉的65%~85%[6]。高等植物中淀粉的生物合成主要通過4類酶:ADP葡萄糖焦磷酸化酶(ADP glucose pyrophosphorylase, AGPase)、淀粉合酶(starch synthase, SS)、淀粉分支酶(starch branching enzyme, SBE)以及淀粉脫分支酶(debranching enzyme, DBE)[6-8]。此外,有證據表明歧化酶(disproportionating enzyme, DPE)[9-11]和α-葡聚糖磷酸化酶(α-glucan phosphorylase, PHO)[12,13]也參與了該過程。
鳥嘌呤核苷酸(guanosine monophosphate, GMP)是許多化學反應的主要能源,也是DNA、RNA和一些信號分子如環磷酸鳥苷(cyclic guanosine monophosphate, cGMP)的結構單元,cGMP是多種激素誘導的胞內第二信使,參與調解許多生化反應過程,如通過控制細菌的活動來調解植物的免疫響應[14,15]。高等植物中GMP的生物合成通過兩種途徑實現:一種是利用氨基酸和其他小分子的從頭合成途徑;另一種是通過預先形成的鳥嘌呤和鳥苷的補救途徑。合成的GMP隨后可以被磷酸化為鳥苷二磷酸(guanosine diphosphate, GDP)和鳥苷三磷酸(guanosine triphosphate, GTP)。GDP和GTP是植物進化過程中保守的重要能量分子,驅動細胞中許多重要的酶促反應。在蛋白質合成過程中尤為重要,多肽鏈上每添加1個氨基酸需要消耗2分子GTP,因此GTP在細胞分裂旺盛的部位分布較高[16-19]。雖然高等植物中GMP的合成過程與動物及微生物相似,但高等植物中上述途徑的調控網絡比動物中更加復雜。這種增加的復雜性源自植物細胞中多種質體的存在,其可以分化成各種類型的細胞器,例如葉綠體、造粉體和有色體等[15,20]。
鳥苷酸激酶(guanylate kinase, GK)是鳥嘌呤代謝通路中的關鍵酶,催化(脫氧)GMP磷酸化形成(脫氧)GDP。GK在第二信使cGMP(cGMP→GMP→GDP→GTP→cGMP)的循環中也起重要作用,調節鳥嘌呤核苷酸在信號轉導途徑中各組分的供應[21]。目前,對動物和微生物中GK的生物化學、遺傳學的調控已經開展了許多研究[22-27]。人類GK在用于治療癌癥和病毒感染的作用引起了極大關注[22, 23]。同樣地,高等植物中GK的功能也引起了研究者的關注[20, 28-31]。水稻GK突變體()具有溫度依賴性,在20℃時葉片中不含有葉綠體而表現白化,而在30℃時葉色正常。編碼一個包含285個氨基酸的蛋白,同時定位于質體和線粒體。中基因的突變導致第162位纈氨酸被異亮氨酸代替,從而抑制了早期質體遺傳系統中質體轉錄本的翻譯,導致葉綠體分化受阻。因此,OsGK1/V2在葉片早期發育過程中調控質體翻譯體系的建立[30]。細菌和動物中的研究表明GK定位于細胞質中,能夠為許多基本的細胞學過程提供所需的鳥嘌呤。但植物中同樣存在這種胞質定位的鳥苷酸激酶(cytoplasm guanylate kinase, cGK),對擬南芥cGK的RNA干擾植株進行表型分析表明,cGK對植物生長發育不可或缺,但并非葉綠體發育所必需[31]。上述研究表明植物系統中存在兩種類型的GK,在水稻中只有pt/mt(plastid target/ mitochondria target) GK是葉綠體分化所必需,但GK與水稻胚乳中的質體-造粉體的關系未見報道。
本研究以從粳稻品種滇粳優1號的甲基亞硝基脲(1-methyl-1-nitrosourea, MNU)處理突變體庫中篩選到的粉質胚乳突變體為材料,對其籽粒的理化性狀進行測定,并對胚乳淀粉結構進行觀察。通過圖位克隆及轉基因互補發現,編碼OsGK1蛋白。借助細胞學、生物信息學手段,以及免疫印跡等實驗,闡述OsGK1與造粉體發育的關系。為深入解析水稻胚乳中淀粉合成及胚發育提供參考。
1 材料與方法
1.1 材料
是在粳稻品種滇粳優1號MNU突變體庫中篩選得到的一份穩定遺傳的粉質皺縮胚乳(floury and shrunken endosperm)突變體。選擇雜合單株與秈稻品種N22配制雜交組合用于基因的圖位克隆。材料種植于南京農業大學實驗基地。
1.2 掃描電鏡觀察
參照Kang等[32]的方法,用刀片將成熟的種子橫向截斷,后續樣品的制備由南京農業大學生命科學學院電鏡實驗室完成,采用日立S-3000N電子掃描顯微鏡觀察和拍照記錄。
1.3 胚乳半薄切片觀察
取灌漿10 d的胚乳,參照Peng等[33]所述方法切成1 μm厚度的薄片。切片用0.05% I2-KI溶液染色后,在Zeiss AX10熒光顯微鏡下觀察和拍照。
1.4 成熟種子理化指標測定
成熟種子去殼后磨成糙米粉并過篩(孔徑為0.15 mm),50℃下烘干至恒重。總淀粉含量使用Megazyme總淀粉測定試劑盒測定;直鏈淀粉含量按照農業部標準NY147-88測定;總脂肪含量使用FOSS公司Soxtec 2050全自動脂肪測定儀測定。每個樣品重復3次,取平均值。支鏈淀粉鏈長分布的測定參照Satoh等[13]的方法進行。
配制0~9 mol/L梯度濃度的尿素溶液,用乙酸調節pH值至6.0。在1.5 mL 離心管中準確稱取20 mg糙米粉,分別加入1 mL上述尿素溶液,渦旋振蕩均勻后室溫放置24 h。隨后8 000×下離心20 min,靜置1 h之后計算各離心管中可溶部分的體積,淀粉顆粒的膨脹體積=總體積(1 mL)-可溶部分體積。每個樣品重復3次,取平均值。
準確稱取3.0 g烘干的米粉,加入25 mL蒸餾水混合均勻,使用RVA (Rapid Visco Analyzer, 瑞典波通公司)快速黏度分析儀測定黏度特性。
1.5 FSE2基因的圖位克隆
分單株收取/N22 F1植株上的F2種子,并從中選取與突變體表型一致的粉質皺縮籽粒。由于種子純合致死,將極端個體浸水24 h后利用CTAB法提取種子DNA,用于基因定位。InDel標記來自RiceVarMap (http://ricevarmap.ncpgr.cn/)。PCR體系包括DNA模板1 μL,前后引物(2 μmol/L)各1 μL,dNTPs(10 mmol/L) 0.03 μL,r0.1 μL,10×緩沖液 1 μL,ddH2O 5.9 μL。產物用8%聚丙烯酰胺凝膠電泳,0.1% AgNO3染色,0.4%甲醛溶液(/)顯色。
突變體種子純合致死,無法誘導出愈傷組織,因此利用雜合植株分離的透明種子進行轉基因互補試驗。提取T0代轉基因植株葉片的DNA,分別進行雜合位點和轉基因陽性(前引物位于基因編碼區,后引物位于載體序列,片段大小為883 bp)的PCR檢測。收獲雜合背景的轉基因陽性植株上的種子(T1代),單粒播種,發芽長苗后提取幼苗DNA檢測突變位點(引物F/R,野生型為429 bp,突變體為359 bp),當突變位點純合而種子表現透明視為互補。
1.6 RNA提取以及qRT-PCR
使用TIANGEN公司的植物總RNA提取試劑盒,提取不同組織的總RNA。反轉錄得到cDNA后,使用SYBR Premix ExTM(TaKaRa),在ABI PRISM 7500HT儀器上擴增,進行qRT-PCR分析,以水稻基因作為內參。反應體系包括cDNA模板8.0 μL(約50 ng),2×SYBR Premix ExII 10 μL,前后引物(10 μmol/L)各0.8 μL,50×ROX參比染料0.4 μL。采用2法進行計算。
1.7 氨基酸序列比對等生物信息分析
在NCBI網站(http://www.ncbi.nlm.nih.gov/)搜索并下載不同物種鳥苷酸激酶的同源蛋白,使用MEGA 5.0軟件進行氨基酸序列的比對和分析。利用SignalP 4.1 Server (http://www.cbs.dtu.dk/services/ SignalP/) 和TargetP 1.1 Server(http:// www. cbs. dtu. dk/services/TargetP/)進行OsGK1定位信號預測。
1.8 GUS染色
GUS工作液含50 mmol/L磷酸緩沖液(pH 7.2),0.1% Triton X-100,2 mmol/L K3Fe(CN)6,2 mmol/L K4[Fe(CN)6]·3H2O,10 mmol/L EDTA,2 mmol/L X-Gluc。加入適量配制好的GUS染液于15 mL離心管中,將待測轉基因樣品浸入,放入37℃培養箱過夜后用100%乙醇脫色5 h,然后拍照記錄。
1.9 TTC染色
取種子20粒,去除穎殼,30℃清水浸種24 h后,用吸水紙除去籽粒表面水分,放入10 mL試管中,加入10 mL 5% TTC染液(TTC粉末溶解于pH=7.0磷酸緩沖液中),35℃黑暗下2 h染色完畢,用蒸餾水沖洗3次。野生型和突變體各3個重復。
1.10 SDS-PAGE及Western blotting
提取成熟種子胚乳總蛋白,進行SDS-PAGE凝膠電泳。電泳結束后利用濕轉設備(Bio-Rad公司)將蛋白轉印到孔徑為0.45 μm的聚偏二氟乙烯膜(polyvinylidene fluoride,PVDF膜),然后將PVDF膜在5%脫脂牛奶(PBST溶解)中封閉1 h;再移至新的封閉液中加入一抗(1∶1000)孵育2 h;PBST漂洗PVDF膜3次,每次5 min;將PVDF膜轉移至封閉液稀釋的二抗溶液(1∶5000)中孵育1 h;PBST漂洗PVDF膜5次,每次5 min。采用化學發光法(ECL)曝光。內參抗體為ACTIN單克隆抗體(Sigma公司)。
2 結果與分析
2.1 fse2突變體的表型分析
與野生型相比,突變體胚乳表現為粉質、皺縮。對成熟種子橫切面觀察發現突變體不透明部分主要是內胚乳(圖1-A~C)。利用掃描電鏡對種子內胚乳橫截面觀察,野生型中淀粉顆粒充實度高,排列緊密,相互擠壓呈規則的多面體晶體形狀(圖1-E),而突變體中淀粉顆粒排列松散,變圓變小(圖1-F)。制備半薄切片并且通過I2-KI染色觀察發育胚乳中復合淀粉粒的形態,在野生型花后10 d的胚乳中,每個造粉體內部能產生多個獨立的淀粉顆粒(starch granule),這是水稻典型的復合淀粉粒結構(compound starch grain)(圖1-G~H)。而突變體中,復合淀粉粒變小,其中的淀粉顆粒數目顯著降低;還存在許多小的、零散分布的單粒淀粉粒(圖1-I~J)。因此,對于水稻的造粉體發育具有重要作用。此外,與野生型相比,成熟種子的千粒重降低了約35.3%(圖1-K),同時,的粒長和粒寬均較野生型極顯著增加,而粒厚則極顯著減小(圖1-B、D、L)。

A,B,D—滇粳優1號(DJY)與fse2的成熟種子的外觀表型;A,DJY(左),fse2(右)。B和D,DJY(上),fse2(下)。C—DJY(左)與fse2(右)種子的橫切面。E,F—DJY(E)和fse2(F)成熟種子橫切面的SEM觀察。G~J—花后10 d I2-KI染色的DJY(G,H)和fse2(I,J)胚乳半薄切片。K—DJY和fse2的千粒重比較,n=3;L—DJY和fse2的粒長、粒寬和粒厚,n=20。所有數值為平均值±標準差;**野生型與突變體間的差異達0.01顯著水平(t測驗)。
Fig. 1. Phenotypic comparison of mature seeds of wild type andmutant.
2.2 fse2與野生型種子理化特性的比較
相對于野生型,突變體成熟籽粒中總淀粉含量和直鏈淀粉含量顯著降低,分別下降11.67%、15.28%(圖2-A、B),而脂肪含量增加58.25%(圖2-C)。此外,胚乳淀粉中支鏈淀粉鏈長分布發生明顯改變,其聚合度(degree of polymerization, DP)為9~12和16~29的鏈長比例明顯下降,而DP 為13~15的鏈長比例顯著升高(圖2-D)。RVA譜分析發現,突變體淀粉的黏度曲線與野生型具有極顯著差異(圖2-E)。突變體淀粉的最高黏度(peak viscosity, PKV)出現的時間早于野生型,其崩解值(breakdown viscosity, BDV)、消減值(setback viscosity, SBV)、冷膠黏度(cool pasting viscosity, CPV)等都極顯著低于野生型(表1)。

A~C—滇粳優1號(DJY)和fse2胚乳中總淀粉(A)、直鏈淀粉(B)和脂肪(C)含量的測定,n=3,取平均值±標準差,采用t測驗,**P<0.01;D—DJY和fse2支鏈淀粉鏈長分布;E—DJY和fse2淀粉的RVA譜分析;F—DJY與fse2米粉的膨脹體積比較(n=3);G—DJY與fse2的尿素膨脹。
Fig. 2. Physicochemical characteristics of mature seeds ofand its wild type.
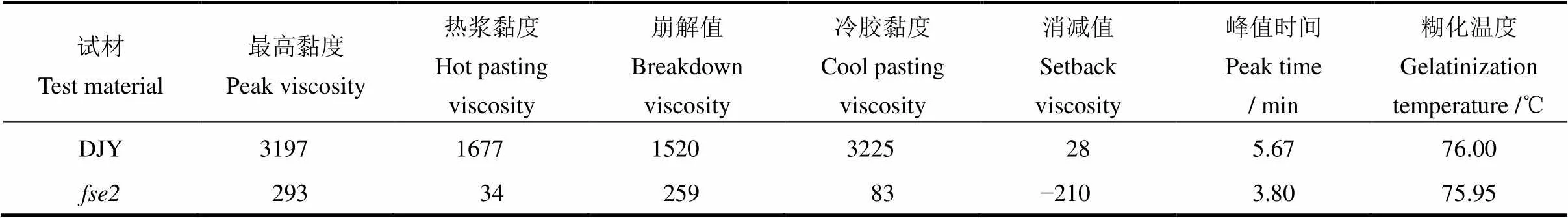
表1 野生型和突變體fse2淀粉的RVA譜特征分析
對野生型和突變體米粉的凝膠特性測定表明,突變體米粉較野生型米粉更難溶于尿素(圖2-F、G)。野生型米粉在4 mol/L尿素中明顯開始溶解,而米粉幾乎無變化,直至5 mol/L時米粉才出現輕微的溶解。當尿素濃度達到9 mol/L時野生型米粉已接近完全溶解,而米粉膨脹體積與野生型在6 mol/L尿素中的膨脹體積相當(圖2-F、G),說明的支鏈淀粉結構發生了顯著變化。綜上所述,突變顯著改變了胚乳淀粉的理化性質。

表2 fse2遺傳分析
2.3 FSE2基因的圖位克隆
種子純合致死,雜合植株上所結種子透明胚乳與粉質胚乳分離比符合3∶1(c2<3.84)(表2),表明由一對隱性核基因控制。從與N22配制的雜交組合的F2種子中,挑選出350個與突變體表型一致的隱性極端個體進行基因定位,將定位于第3染色體短臂的標記LJF3-16與LJF3-17之間約106 kb區域內(圖3-A)。利用水稻數據庫(http://rice.plantbiology.msu.edu/)查詢該區間,預測存在11個開放讀碼框(open reading frame, ORF)。對這11個ORF的基因組測序發現,突變體中第1外顯子上存在3個SNP,并且包含70 bp的缺失(圖3-B、C)。實時PCR檢測發現,花后10 d種子中的表達水平約為野生型的13.33%(圖3-E)。基因組全長3608 bp,包含4個外顯子和3個內含子(圖3-B),編碼序列長858 bp,編碼一個含有285個氨基酸的鳥苷酸激酶,C端包含一個GuKc功能結構域(圖3-D),我們將該基因命名為。通過數據庫比對發現,不同植物中的鳥苷酸激酶均含有GuKc結構域,并具有較高的蛋白序列相似性,且均含有鳥苷酸激酶催化位點(圖4)。在突變體中,由于70 bp缺失導致蛋白翻譯提前終止,編碼一個僅有68個氨基酸的短肽,但只有N端20個氨基酸與野生型一致(圖3-D),缺失了GuKc結構域及其催化位點(圖3-D),因此很可能是OsGK1的功能喪失突變體。
為進一步確定就是的突變基因,將構建好的CaMV 35S啟動子驅動全長cDNA的載體,轉化雜合體植株分離出的透明種子愈傷。對轉基因陽性且背景雜合的T0代植株上的透明種子(T1)發苗提取DNA并進行PCR鑒定。從圖3-F~H中可以看出,在轉基因雜合家系CP-1的#3和#4種子及CP-2的#3和#7種子,具有純合的突變體背景,且為轉基因陽性,說明它們是轉基因互補的種子。綜上所述基因的突變導致了的突變表型。
2.4 FSE2的組織表達分析
實時熒光定量PCR顯示,在各器官中呈組成型表達,在葉片和葉鞘中表達量較高(圖5-A)。此外,在胚乳發育的整個過程中也有表達,并且在花后6 d達到峰值(圖5-B)。同時,我們構建了啟動子驅動基因的表達載體轉化到日本晴中,對轉基因陽性植株不同組織的GUS染色發現,在根、葉、葉鞘、小花均能檢測到GUS活性(圖5-C~F),同時發育種子中也能檢測到GUS的活性,且在花后6 d表達量最高。這些與熒光定量的結果相吻合(圖5-G~L)。
2.5 FSE2突變影響了胚的正常發育
種子的萌發實驗表明,野生型的種子吸脹后胚能正常萌發生長,而突變體幾乎不能萌發(圖6-A)。進一步利用TTC法測定種子活力發現,野生型的胚能夠染成紅色,而突變體種子的胚幾乎不能著色(圖6-F),推斷突變體胚的正常發育受到了影響。因此,我們切開吸脹后的胚發現,突變體的胚無明顯的結構分化,而野生型中結構分化明顯,顯示中胚發育的缺陷(圖6-B、C)。同時,發育中期種子胚的橫切面也觀察到了相同的結果(圖6-D、E)。蛋白結構分析表明,在OsGK1的N端包含線粒體和葉綠體的定位信號,且前人的研究已經證實該蛋白能夠在線粒體和質體雙定位[31]。因此,我們推測的線粒體中缺乏有功能的OsGK1蛋白,導致線粒體功能障礙引起胚致死。因此,對突變體種子中線粒體蛋白進行了免疫印跡分析,結果表明中線粒體CytC(cytochrome c biogenesis C)和COX2 (cytochrome c oxidase subunit 2)的積累量超過野生型,而AOX(alternative oxidase)則在突變體中嚴重過量積累。此外,線粒體NADH9(NADH dehydrogenase subunit 9)亞基的蛋白水平略有下降(圖6-G)。上述結果表明突變體中線粒體的正常功能受損,這可能是導致胚發育缺陷的原因。
2.6 FSE2突變影響了淀粉的合成

A―FSE2位點的圖位克隆,FSE2定位在第3染色體短臂標記LJF3-16與LJF3-17之間約106 kb區域內,包含11個預測基因;B―Os03g0320900基因結構和突變位點,序列中存在3處單堿基替換(紅色三角)和70 bp的缺失(紅色方框)。引物F/R用于鑒定轉基因家系CP-1、CP-2中透明種子的遺傳背景;C―PCR鑒定FSE2基因中70 bp的缺失;D―FSE2蛋白的定位信號及結構域,在fse2中共有68個氨基酸,但只有N端20個氨基酸與野生型保持一致(虛線左邊);mTP―線粒體轉運肽;cTP―葉綠體轉運肽;aa―氨基酸;E―FSE2在DJY和fse2發育種子中(開花10 d后)的相對表達量;F―具突變體背景的陽性轉基因種子(CP-1 #3和CP-2 #7)恢復為正常表型,CP-1和CP-2為具有雜合突變體背景的轉基因陽性家系,標尺為1 cm;G,H―CP-1家系(G)和CP-2家系(H)后代透明種子的PCR鑒定。G和H中上圖均為轉基因陽性鑒定結果,下圖均為遺傳背景檢測結果,紅色星號表示純合突變體背景的陽性轉基因種子。DJY―滇粳優1號。
Fig. 3. Map-based cloning of.
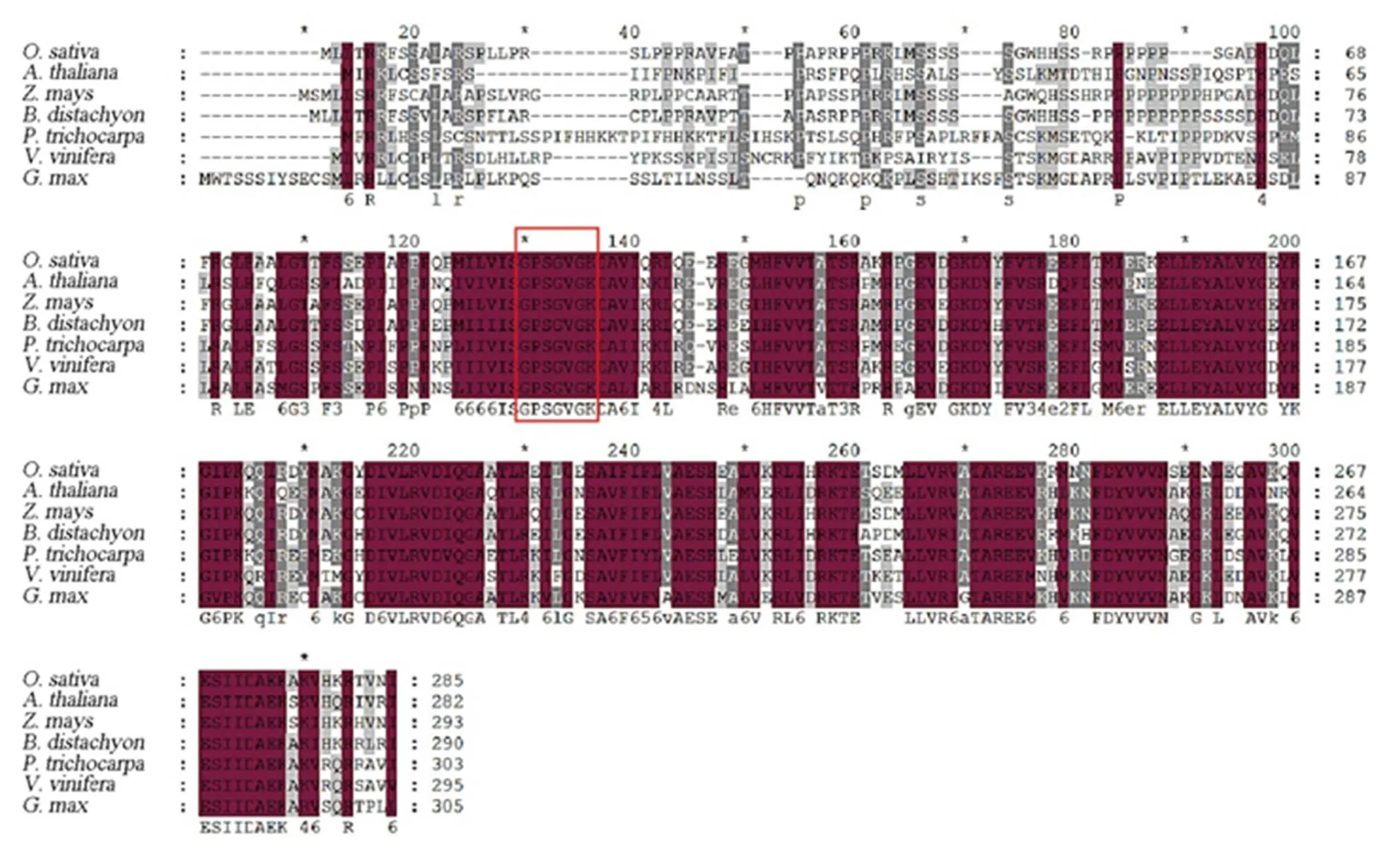
紅色方框區域代表鳥苷酸激酶催化位點;GenBank蛋白質登錄號:水稻,XP_051628708.1;擬南芥,NP_566276.1;玉米,NP_001149581.1;二穗短柄草,XP_003561683.1;毛果楊,XP_006380050.1;葡萄,XP_002279802.1;大豆,XP_003542897.2。 The red box indicates the catalytic site of GK; GenBank protein accession number are as follows O. sativa, XP_051628708.1; A. thaliana, NP_566276.1; Z. mays, NP_001149581.1; B. distachyon, XP_003561683.1; P. trichocarpa, XP_006380050.1; V. vinifera, XP_002279802.1; G. max, XP_003542897.2.
Fig. 4. Protein sequence alignment of FSE2 and its homologs.
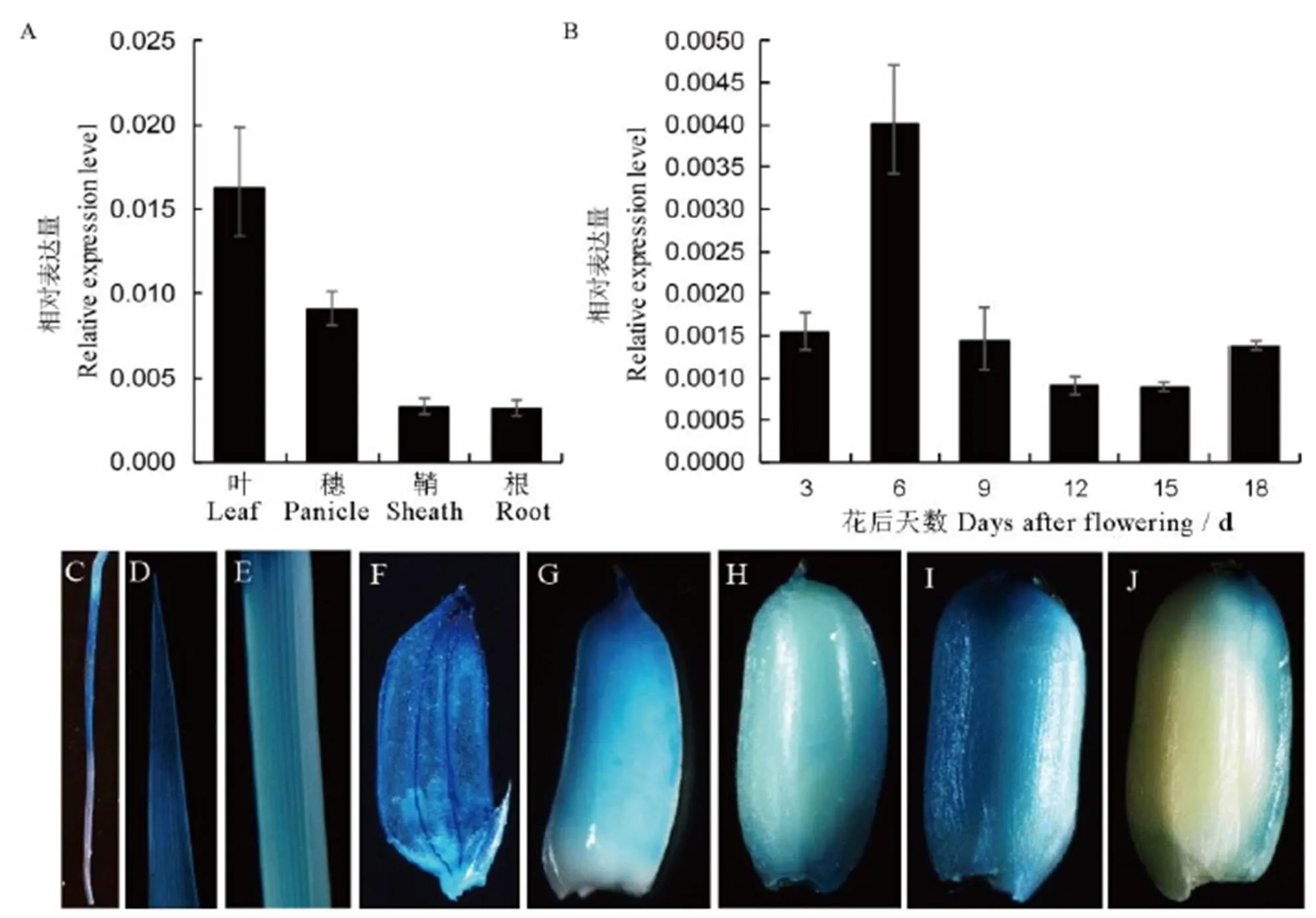
A—FSE2在葉、穗子、鞘、根中的表達量;B—FSE2在花后3、6、9、12、15和18 d的發育胚乳中的表達量;C~F—根(C)、葉(D)、鞘(E)、小花(F)的GUS染色;G~J—開花后6(G)、9(H)、12(I)和15 d(J)的發育胚乳的GUS染色。
Fig. 5. The expression patterns of.
由于突變體種子皺縮,具有明顯的淀粉合成缺陷。因此,對胚乳中淀粉合成相關蛋白進行了免疫印跡分析。突變體中胞質AGPase亞基(AGPS2b)蛋白水平顯著降低,大量研究表明AGPS2b的突變會產生粉質皺縮的胚乳[34-36]。質體磷酸化酶(PHOⅠ)的蛋白水平也明顯下降,PHOⅠ水平降低會產生不同程度的粉質胚乳,其中包括種子皺縮[13]。同時,3個支鏈淀粉合成相關基因(,,)及胞質PPDKB的蛋白水平也均顯著低于野生型(圖6-H)。這些結果表明胚乳中的淀粉合成發生了明顯改變。因此,突變同樣引起了質體(造粉體)的功能缺陷,顯著降低了部分淀粉合成相關蛋白的積累,導致淀粉合成劇減,造成種子皺縮表型。

A—野生型和突變體fse2種子萌發后2 d的表型;B,C—野生型和突變體fse2種子吸脹后的胚(30℃下吸脹9 h),比例尺為1 mm;D,E—花后15 d野生型和突變體的胚,比例尺為1 mm;F—TTC法測定種子活力;G—Western blotting檢測野生型和突變體成熟種子中的線粒體相關蛋白含量。CytC―細胞色素c合成酶C;COX2―細胞色素c氧化酶亞基2;NADH9―NADH脫氫酶亞基9;ATPβ―ATP合酶F0亞基6;AOX―交替氧化酶;H—Western blotting檢測野生型和突變體成熟種子中淀粉合成相關酶蛋白含量,AGPL2―腺苷葡萄糖焦磷酸化酶大亞基2;AGPS2b―腺苷葡萄糖焦磷酸化酶小亞基2b;PPDKB―胞質丙酮酸磷酸雙激酶B;PHOⅠ―質體磷酸化酶Ⅰ;BEⅠ―淀粉分支酶Ⅰ;BEⅡb―淀粉分支酶Ⅱb;SSⅡa―淀粉合酶Ⅱa;G,H中以ACTIN作為內參。DJY―滇粳優1號。
Fig. 6. The abnormal development of embryo and endosperm in themutant.
3 討論
淀粉是人類和畜牧業最主要的能量來源之一,同時也是重要的工業原料。水稻種子中積累了大量的淀粉,其主要功能是為種子萌發和幼苗生長提供能量,同時這些數量可觀的淀粉也成為人類日常飲食的主要初級能量來源。水稻中淀粉積累水平直接影響水稻產量,同時種子中直鏈淀粉和支鏈淀粉的結構和比例決定了稻米的品質。因此,深入研究水稻淀粉合成的關鍵基因及調控網絡,對種子的生長發育具有重要的生物學意義與育種應用價值。通過物理和化學等誘變方法,人們已經篩選獲得了大量水稻胚乳異常突變體,主要有暗胚乳(dull endosperm)、糯性(waxy)、粉質(floury)、皺縮(shrunken)等表型,它們是解析胚乳發育過程中淀粉合成調控路徑的優良材料。本研究通過篩選滇粳優1號MNU突變體庫,獲得一份粉質皺縮突變體,通過圖位克隆及轉基因互補證明/基因的突變導致了種子的粉質表型。
前人研究表明V2/OsGK1是葉綠體和線粒體雙定位的蛋白,參與葉綠體分化過程中質體向核信號轉導的過程。表現出葉片淡綠,在早期的葉片發育過程中,的突變并不影響NEP(Nuclear-encoded plastid RNA polymerase)途徑,而是主要影響葉片發育后期的質體基因的表達,質體中的、、的轉錄水平受到強烈抑制,從而影響了水稻質體的發育,進而導致葉色變異[24,30]。但是對于OsGK1/V2在水稻種子發育中所扮演的角色還未有報道。
在突變體中,由于蛋白翻譯的提前終止,僅正確翻譯20個氨基酸,突變蛋白不僅喪失了鳥苷酸激酶的功能結構域GuKc,導致突變體中的鳥苷酸激酶的酶活性的喪失,而且突變蛋白的葉綠體和線粒體的定位信號也都出現不同程度的缺失,可能喪失了在植株體內的正確定位。因此,極有可能是鳥苷酸激酶功能喪失突變體。線粒體為植物生長代謝提供了主要的能量來源,線粒體的功能障礙會影響種子的正常生長發育。在本研究中,TTC染色表明突變體的種子活力大大降低,并且純合致死。突變體中AOX過量積累,在野生型中則基本沒有積累。AOX屬于末端氧化酶,催化抗氰呼吸,說明突變體中交替途徑(alternative pathway)增強。線粒體交替呼吸途徑不經過線粒體復合體Ⅲ和復合體Ⅳ,不產生ATP或產生1個ATP,其余能量以熱能形散失,P/O比為1,而細胞色素途徑P/O比為2或3。細胞色素氧化酶的略微增加可能是由于主呼吸鏈受到抑制而出現的反饋機制[37-39]。線粒體NADH9也有所降低,這些都表明突變體中線粒體功能受損,影響了胚的發育,導致種子萌發過程受阻。對胚乳中淀粉合成關鍵基因的蛋白印跡分析表明,突變體中PHOI、BEI、SSIIa、BEIIb(質體定位)的蛋白水平均顯著下降,而PHOI和BEIIb功能的削弱都能導致籽粒粉質皺縮[13];突變體胚乳嚴重粉質皺縮[34-36],中AGPS2b的含量也明顯降低。因此,我們推測由于突變蛋白不能正確靶向到胚乳造粉體以及其酶活性的喪失,導致了造粉體發育的異常,產生粉質皺縮的胚乳。
此外,由于線粒體功能障礙將導致能量供應不足,進而影響突變體胚和胚乳的發育。如玉米突變體種子胚致死或者苗期致死、種子皺縮、籽粒變小,編碼一個PPR(pentatricopeptide repeat)蛋白,通過影響線粒體的正常編輯引起線粒體功能障礙,使玉米胚和胚乳的發育受到影響。其在水稻中的同源基因()的突變體(_)籽粒變小、堊白、種皮皺縮,種子的生長發育極其緩慢,甚至產生致死表型[40]。因此線粒體的正常功能對種子發育極其重要。
種子胚發育的缺陷大多伴隨著胚乳發育的異常,如玉米、、和突變體中胚和胚乳的發育都有缺陷且純合種子致死[41-44];水稻中缺少OsWDR5a胚和胚乳發育出現缺陷,表型為胚胎發生終止,突變體種子純合致死,種子皺縮[45]。但在水稻MPK1功能喪失突變體中,成熟種胚變小且純合致死,種子胚乳卻表現為透明[46]。因此,種子胚和胚乳之間的發育可能不存在必然的聯系。Huang等[47]指出基因突變導致胚胎早期發育模式異常,早期胚乳中游離核數目減少,糊粉層分化受到影響,造成種子純合致死,胚乳出現堊白,且在胚和胚乳中都有表達,共同調控二者的早期發育。本研究中經網站(RiceXPro)預測在胚和胚乳中都有表達,推測該基因可能同時影響了胚和胚乳的正常發育,但二者的具體調控機制還需要進一步的實驗探究。
綜上所述,的突變導致種子中胚和胚乳的發育都受到了嚴重的阻礙,說明鳥苷酸激酶對植物體的生長發育至關重要,能夠調控胚和胚乳的正常生長發育。
謝辭:感謝農業部長江中下游粳稻生物學與遺傳育種重點實驗室/長江流域雜交水稻協同創新中心/江蘇省現代作物生產中心對本研究給予資助。
[1] Khush G S. What it will take to feed 5.0 billion rice consumers in 2030., 2005, 59(1): 1-6.
[2] Zhou Z, Robards K, Heliwell S, Blanchard C. Composition and functional properties of rice., 2002, 37(8): 849-868.
[3] Demirkesen I, Sumnu G, Sahin S. Image analysis of gluten-free breads prepared with chestnut and rice flour and baked in different ovens., 2013, 6(7): 1749-1758.
[4] Patindol J, Wang Y J. Fine structures and physicochemical properties of starches from chalky and translucent rice kernels., 2003, 51(9): 2777-2784.
[5] Martin C, Smith A M. Starch biosynthesis., 1995, 7(7): 971-985.
[6] Nakamura Y. Towards a better understanding of the metabolic system for amylopectin biosynthesis in plants: Rice endosperm as a model tissue., 2002, 43(7): 718-725.
[7] Hirose T, Terao T. A comprehensive expression analysis of the starch synthase gene family in rice (L.)., 2004, 220(1): 9-16.
[8] Ball S G, Morell M K. From bacterial glycogen to starch: Understanding the biogenesis of the plant starch granule., 2003, 54(1): 207-233.
[9] Colleoni C, Dauvillée D, Mouille G, Morell M, Samuel M, Slomiany M C, Lienard L, Wattebled F, d’Hulst C, Ball S. Biochemical characterization of theα-1,4 glucanotransferase supports a direct function in amylopectin biosynthesis., 1999, 120(4): 1005-1014.
[10] Dauvillée D, Chochois V, Steup M, Haebel S, Eckermann N, Ritte G, Ral J P, Colleoni C, Hicks G, Wattebled F O, Deschamps P, d’Hulst C O, Liénard L, Cournac L O, Putaux J L O, Dupeyre D, Ball S G O. Plastidial phosphorylase is required for normal starch synthesis in., 2006, 48(2): 274-285.
[11] Dong X, Zhang D, Liu J, Liu Q Q, Liu H, Tian L, Jiang L, Qu le Q. Plastidial disproportionating enzyme participates in starch synthesis in rice endosperm by transferring maltooligosyl groups from amylose and amylopectin to amylopectin., 2015, 169(4): 2496-2512.
[12] Schupp N, Ziegler P. The relation of starch phosphorylases to starch metabolism in wheat., 2004, 45(10): 1471-1484.
[13] Satoh H, Shibahara K, Tokunaga T, Nishi A, Tasaki M, Hwang S K, Okita T W, Kaneko N, Fujita N, Yoshida M, Hosaka Y, Sato A, Utsumi Y, Ohdan T, Nakamura Y. Mutation of the plastidial a-glucan phosphorylase gene in rice affects the synthesis and structure of starch in the endosperm., 2008, 20(7): 1833-1849.
[14] Pfeilmeier S, Saur I M, Rathjen J P, Zipfel C, Malone J G. High levels of cyclic-di-GMP in plant-associated Pseudomonas correlate with evasion of plant immunity., 2016, 17(4): 521-531.
[15] Zrenner R, Stitt M, Sonnewald U, Boldt R. Pyrimidine and purine biosynthesis and degradation in plants., 2006, 57: 805-836.
[16] Green R, Noller H F. Ribosomes and translation., 1997, 66: 679-716.
[17] Sumita K, Lo Y H, Takeuchi K, Senda M, Kofuj S, Ikeda Y, Terakawa J, Sasaki M, Yoshino H, Majd N, Zheng Y X, Kahoud E R, Yokota T, Emerling B M, Asara J M, Ishida T, Locasale J W, Daikoku T, Anastasiou D, Senda T, Sasaki A T. The lipid kinase PI5P4Kβ is an intracellular GTP sensor for metabolism and tumorigenesis., 2016, 61(2): 187-198.
[18] Caro L G, Palade G E. Protein synthesis, storage, and discharge in the pancreatic exocrine cell. An autoradiographic study., 1946, 20(3): 473-495.
[19] Havel P J. Control of energy homeostasis and insulin action by adipocyte hormones: Leptin, acylation stimulating protein, and adiponectin., 2002, 13(1): 51-59.
[20] Stasolla C, Katahira R, Thorpe T A, Ashihara H. Purine and pyrimidine nucleotide metabolism in higher plants., 2003, 160(11): 1271-1295.
[21] Gaidarov I O, Suslov O N, Abdulaev N G. Enzymes of the cyclic GMP metabolism in: I. Cloning and expression of the gene for guanylate kinase., 1993, 335(1): 81-84.
[22] Brady W A, Kokoris M S, Fitzgibbon M, Black M E. Cloning, characterization, and modeling of mouse and human guanylate kinases., 1996, 271(28): 16734-16740.
[23] Stolworthy T S, Krabbenhoft E, Black M E. A novel Escherichia coli strain allows functional analysis of guanylate kinase drug resistance and sensitivity., 2003, 322(1): 40-47.
[24] Beck B J, Huelsmeyer M, Paul S, Downs D M. A mutation in the essential gene(encoding guanylate kinase) generates a requirement for adenine at low temperature in., 2003, 185(22): 6732-6735.
[25] Gentry D, Bengra C, Ikehara K, Cashel M. Guanylate kinase ofK-12., 1993, 268(19): 14316-14321.
[26] Konrad M. Cloning and expression of the essential gene for guanylate kinase from yeast., 1992, 267(36): 25652-25655.
[27] Ray B D, Jarori G K, Raghunathan V, Yan H, Rao B D N. Conformations of nucleotides bound to wild type and Y78 F mutant yeast guanylate kinase: Proton two-dimensional transferred NOESY measurements., 2005, 44(42): 13762 13770.
[28] Kumar V. Cloning and sequence analysis of lily and tobacco guanylate kinases., 2000, 27(1): 45 49.
[29] Kumar V, Spangenberg O, Konrad M. Cloning of the guanylate kinase homologues AGK-1 and AGK-2 fromand characterization of AGK-1., 2000, 267(2): 606-615
[30] Sugimoto H, Kusumi K, Tozawa Y, Yazaki H, Kishimoto N, Kikuchi S, Iba K. Themutation inhibits translation of plastid transcripts for the plastid genetic system at an early stage of chloroplast differentiation., 2004, 45(8): 985-996.
[31] Sugimoto H, Kusumi K, Noguchi K, Yano M, Yoshimura A, Iba K. The rice nuclear gene,, is essential for chloroplast development and encodes a novel type of guanylate kinase targeted to plastids and mitochondria., 2007, 52(3): 512-527.
[32] Kang H G, Park S, Matsuoka M, An G. White-core endospermin rice is generated by knockout mutations in the C-type pyruvate orthophosphate dikinase gene (OsPPDKB)., 2005, 42(6): 901-911.
[33] Peng C, Wang Y, Liu F, Ren Y, Zhou K, Lv J, Zheng M, Zhao M, Zhao S, Zhang L, Wang C, Jiang L, Zhang X, Guo X, Wan J M.encodes a CBM48 domain-containing protein involved in compound granule formation and starch synthesis in rice endosperm., 2014, 77(6): 917-930.
[34] Nishi A, Nakamura Y, Tanaka N, Satoh H. Biochemical and genetic analysis of the effects ofmutation in rice endosperm., 2001, 127(2): 459-472
[35] Ohdan T, Francisco P B Jr, Sawada T, Hirose T, Saltoh H, Nakamura Y. Expression profiling of genes involved in starch synthesis in sink and source organs of rice., 2005, 56(422): 3229-3244.
[36] Akihiro T, Mizuno K, Fujimura T. Gene expression of ADP-glucose pyrophosphorylase and starch contents in rice cultured cells are cooperatively regulated by sucrose and ABA., 2005, 46(6): 937-946.
[37] Finnegan P M, Soole K L, Umbach A L. Alternative mitochondrial electron transport proteins in higher plants. //Day D A, Millar A H, Whelan J. Plant Mitochondria: From Genome to Function. The Netherlands: Springer, 2004: 163-230.
[38] Selinshi J, Hartmann A, Kordes A, Deckers-Hebestreit G, Whelan J, Scheibe R. Analysis of post-translational activation of alternative oxidase isoforms., 2017, 174(4): 2113-2127.
[39] Zhang Y F, Suzuki M, Sun F, Tan B C. The mitochondrion-targeted PENTATRICOPEPTIDE REPEAT78 protein is required formature mRNA stability and seed development in maize., 2017, 10(10): 1321-1333
[40] Li X J, Zhang Y F, Hou M M, Sun F, Shen Y, Xiu Z H, Wang X, Chen Z L, Sun S S, Small I, Tan B C.encodes a pentatricopeptide repeat protein required for mitochondrialtranscript editing and seed development in maize () and rice ()., 2014, 79(5): 797-809.
[41] Liu Y J, Xiu Z H, Meeley R, Tan B C.encodes a pentatricopeptide repeat protein that is required for mitochondrial RNA editing and seed development in maize., 2013, 25(3): 868-883.
[42] Yang Y Z, Ding S, Wang H C, Sun F, Huang W L, Song S, Xu C, Tan B C. The pentatricopeptide repeat protein EMP9 is required for mitochondrialandtranscript editing, mitochondrial complex biogenesis and seed development in maize., 2017, 214(2): 782-795.
[43] Cai M J, Li S Z, Sun F, Sun Q, Zhao H, Ren X, Zhao Y, Tan B C, Zhang Z, Qiu F.encodes a mitochondrial PPR protein that affects the-splicing ofintron 1 and seed development in maize., 2017, 91(1): 132-144.
[44] Ren X M, Pan Z Y, Zhao H L, Zhao J L, Cai M J, Li J, Zhang Z X, Qiu F Z. EMPTY PERICARP11 serves as a factor for splicing of mitochondrialintron and is required to ensure proper seed development in maize., 2017, 68(16): 4571-4581.
[45] Jiang P F, Wang S L, Jiang H Y, Cheng B J, Wu K Q, Ding Y. The COMPASS-like complex promotes flowering and panicle branching in rice., 176(4): 01749.2017. DOI:10.1104/pp.17.01749.
[46] Minkenberg B, Xie K, Yang Y N. Discovery of rice essential genes by characterizing a CRISPR-edited mutation of closely related rice MAP kinase genes., 2017, 89(3): 636-648.
[47] Huang X, Peng X, Sun M X. OsGCD1 is essential for rice fertility and required for embryo dorsal-ventral pattern formation and endosperm development., 2017, 215(9): 1039-1058.
The Guanylate Kinase OsGK1 is Essential for Seed Development in Rice
LI Jingfang1, TIAN Yunlu1, LIU Xi1, LIU Shijia1, CHEN Liangming1, JIANG Ling1, ZHANG Wenwei1, XU Dayong2, WANG Yihua1,*, WAN Jianmin1
(1,;Lianyungang Academy of Agricultural Science,,;*Corresponding author, E-mail: yihuawang@njau.edu.cn*)
【Objective】In this study, the phenotype of the floury and shrunken endosperm mutantwas analyzed. Isolation of the responsible gene will lay a foundation for elucidating the mechanism underlying starch synthesis and embryo development in rice. 【Method】was obtained from the mutant library ofcultivar Dianjingyou 1 induced with N-Nitroso-N-methylurea. In this study, the physiochemical properties ofendosperm were investigated and the structure of starch grains was observed. An F2population derived fromand N22 was constructed,then the underlying gene was determined by map-based cloning and complementation tests. qRT-PCR and GUS staining were used to analyze the expression of. Western blotting was performed to analyze the protein levels of starch synthesis related genes and mitochondrial genes in the mutant. 【Result】Compared with the transparent endosperm of wild type,displayed a floury and shrunken endosperm,significantly declined 1000-grain weight, smaller and loosely packed irregular compound starch grains. Total starch and amylose content decreased significantly, while the lipid content increased obviously in, and the gelatinization characteristics ofwere changed notably.encodes a guanylate kinase named OsGK1, which is dual-targeted to both mitochondria and plastids.was constitutively expressed in various organs with the highest level in developing endosperm at 6th day after flowering. The protein levels of most of the starch synthesis related genes in the mutant endosperm were significantly decreased, especially AGPS2b and PHOI. In addition, the homozygous seeds ofwere lethal and the development ofembryos was severely arrested. The accumulation of mitochondria AOX was notably elevated, while almost undetectable in the wild type, indicating the mitochondrial respiratory chain was impaired. 【Conclusion】Due to the functional defects of OsGK1, the development of mitochondria and amyloplasts are abnormal, leading to the embryo lethality and a floury and shrunkenendosperm.
rice (L.); floury and shrunken endosperm; guanylate kinase; seed development; starch synthesis
Q343.5; S511.01
A
1001-7216(2018)05-0415-12
10.16819/j.1001-7216.2018.8003
2018-01-15;
2018-03-17。
國家重點研發項目七大農作物育種專項(2016YFD0100101-08);江蘇省科技支撐計劃資助項目(BE2015363,BE2017368);江蘇省農業科技自主創新資金資助項目[CX(16)1029]。

