食管癌術后早期腸內營養與腸外營養預防相關感染效果對比分析
林秋香
食管癌是一種臨床中常見的惡性腫瘤,患者在疾病的困擾下,出現嚴重的進食困難,并且該疾病的持續時間長,進而影響患者的營養攝入情況,導致患者出現營養不良、身體免疫力較差等現象[1]。因此,在術后必須要給予患者營養支持,而營養支持的措施若是采取不當則很容易在術后發生感染,對患者的術后恢復造成嚴重的不良影響[2]。文章擇取60例食管癌患者,探討食管癌術后早期腸內營養與腸外營養在預防感染效果上的價值。
1 資料與方法
1.1 基線資料
納入研究的60例食管癌術后患者的病例資料,源于我院2015年2月—2017年3月就診患者,分為對照組(采用腸外營養治療)和實驗組(采用早期腸內營養治療)。對照組患者中,男性患者18例(60.00%),女性患者12例(40.00%),患者的年齡在41~73歲,平均年齡(52.63±6.61)歲。實驗組患者中,男性患者19例(63.33%),女性患者11例(36.67%),患者的年齡在42~74歲,平均為(52.51±6.43)歲;所有患者中,中下段食管癌共有34例;上段食管癌共有26例;所有患者均采用食管癌根治性切除術,其中經左胸主動脈弓下吻合手術的患者共有12例;經左胸主動脈弓上吻合手術的患者共有18例;經腹部與右胸頂吻合手術的患者共有27例;經右胸、腹、頸切口手術的患者共有3例。手術時間在80~140 min;平均時間(112.42±5.61)min;術中輸血量在220~550 ml,平均(384.65±23.45)ml。所有患者均于術后病理診斷確診為食管鱗狀細胞癌;其中病理分期Ⅰ期的患者共有12例;病理分期為Ⅱa期的患者共有23例;病理分期為Ⅱb期的患者共有25例;本次研究均經過患者或家屬知情同意,并簽署知情同意書。兩組患者資料輸入SPSS 21.0軟件核實,組間對比差異無統計學意義(P>0.05)。
1.2 方法
腸外營養支持:對照組采用應用全靜脈腸外營養支持,常規配置營養液,靜脈滴注,每日的總能量為30 kcal/kg。
早期腸內營養支持:實驗組在術中給予患者鼻十二指腸管置入,于患者鼻翼處進行固定,常規配置營養液緩慢輸入,應用少量多次的方式來進行;在術后2 d給予鼻飼溫鹽水,術后3 d給予患者鼻飼營養液;首次量為25 ml/h,之后每日增加20 ml,最大量為2 000 ml/d,注入物根據患者的實際需求為主;而在對患者行術后腸內營養的過程中需要注意以下幾點:(1)將床頭抬高30°~45°,避免營養液反流和誤吸的發生;(2)控制營養液的滴注速度,根據患者的耐受能力由慢至快,初始時的滴注速度保持在40~60 ml/h;若患者沒有出現不適的情況,則可以每12 h增加250 ml,最大滴注速度不能超過125 ml/h;(3)在使用管道輸入營養液或注射器注入藥物的過程中,每隔8 h需要使用25~50 ml無菌生理鹽水或溫開水進行管道沖洗,避免出現管道堵塞的情況發生;(4)注入腸內營養液的溫度需要保持在37℃左右,避免溫度過低患者出現腹痛、腹瀉;防止溫度過高損傷患者腸道黏膜;(5)注入腸內營養液時做好患者的臨床癥狀觀察,若出現了相關癥狀(惡心、嘔吐、腹痛、腹瀉等),則需要立刻排查原因,并及時采取有針對性的解決措施;兩組患者的治療時間均為10 d。
1.3 指標觀察
(1)術后肺部感染的發生率;(2)治療前、后血清白蛋白(ALB)、血紅蛋白(Hb)、丙氨酸轉氨酶(ALT)以及天冬氨酸轉氨酶(AST)水平;(3)術后排氣時間;(4)體質量下降情況[3]。
1.4 統計學方法
將文中涉及的數據輸入SPSS21.0軟件檢驗,采用(均數±標準差)表示血清白蛋白、血紅蛋白、丙氨酸轉氨酶、天冬氨酸轉氨酶水平、術后排氣時間、體質量下降情況,用t檢驗。用n(%)表示感染率,進行χ2檢驗。若P<0.05,差異有統計學意義。
2 結果
2.1 肺部感染情況對比
如表1所示,實驗組患者術后肺部感染的發生率為10.00%(3/30);對照組患者肺部感染的發生率為33.33%(10/30);組間對比差異有統計學意義(P<0.05)。
2.2 兩組患者治療前后各指標水平
如表2所示,治療前,各項指標組間對比差異無統計學意義(P>0.05);治療后,實驗組的治療效果(ALB、Hb、ALT以及AST水平指標對比)與對照組相對比優勢明顯,組間對比差異有統計學意義(P<0.05)。
2.3 兩組患者術后排氣時間與體質量下降情況
采用不同術后營養方式進行治療后,30例實驗組患者術后排氣時間以及體質量下降分別為:(67.4±5.14)h與(1.8±0.4)kg;30例對照組患者術后排氣時間以及體質量下降分別為:(90.7±7.4)h與(2.5±1.3)kg;實驗組患者在術后排氣時間與體質量下降情況治療效果的優勢明顯,組間對比差異有統計學意義(P<0.05)。
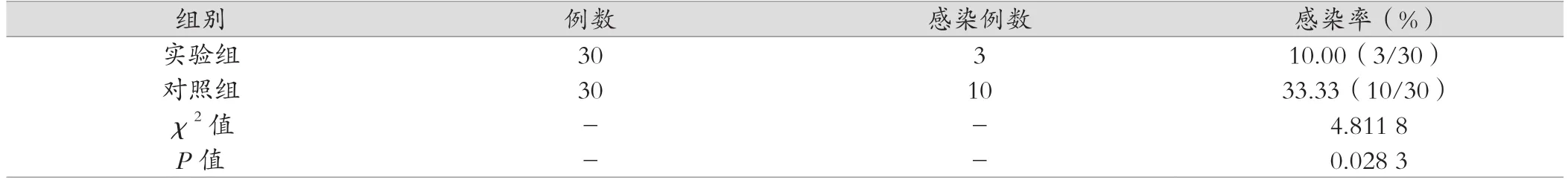
表1 兩組患者術后肺部感染發生率對比[n(%)]
表2 兩組患者治療前后觀察指標水平對比 ( ±s)

表2 兩組患者治療前后觀察指標水平對比 ( ±s)
組別(n=30) ALB(g/L) Hb(g/L) ALT(U/L) AST(U/L)治療前 治療后 治療前 治療后 治療前 治療后 治療前 治療后實驗組 47.1±8.3 39.6±7.4 101.7±16.6 99.4±13.7 29.4±4.8 33.0±6.3 22.8±5.2 28.3±3.6對照組 46.6±8.2 35.4±6.2 101.5±15.5 90.1±10.3 27.7±4.2 42.6±8.5 21.5±5.9 32.8±2.6 t值 0.234 7 2.382 9 0.048 2 2.971 9 1.459 9 4.969 8 0.905 4 5.550 3 P值 0.815 3 0.020 5 0.961 7 0.004 3 0.149 7 0.000 0 0.369 0 0.000 0
3 討論
由于受到疾病的影響,食管癌患者術前往往存在長期無法進食的情況;而在手術后,由于手術具有一定的創傷性,術后切口不利于患者咳嗽、進食,因此必須要采用營養支持的方式[4-6]。尤其是對于食管癌手術患者,手術會導致患者胃腸道出現麻痹,對患者腸道對于營養物質的吸收造成一定的影響。根據相關研究表明,小腸的蠕動、消化與吸收功能通常會在消化道手術后6~12 h后恢復,腸道黏膜的營養物質30.00%來自于腸系膜動脈血液供應,剩下的部分來自于腸腔內營養物質[7-8]。營養支持主要包含了腸內營養支持與腸外營養支持,其中腸外營養雖能夠達到營養補充的效果,但長期使用很容易使得患者的腸道處于靜息的狀態,從而導致患者出現胃障礙、組織壞死以及感染嚴重的現象。早期腸內營養屬于一種新型的營養方式,在術中既能夠行置管,能夠為患者提供充足的營養,同時還能夠有效促進患者代謝的合成,刺激胃腸激素與免疫球蛋白的分泌,以此來提高患者的免疫功能,降低高代謝與腸源性感染的發生率,提高患者的免疫力[9]。此外,腸內營養支持經門靜脈系統吸收(與腸外營養相比),可以更好的促進患者機能的恢復,保證患者的機體器官進行正常的調節,有效提高患者腸胃對于營養物質的吸收功能,降低機體蛋白質尤其是清蛋白的分解,從而促進患者機體免疫力的提高[10];同時,腸內營養支持可以避免腸道細菌引發感染與炎癥反應,且腸內營養劑中的谷氨酰胺、不飽和脂肪酸等營養物質也能夠有效改善患者的免疫功能;而刺激腸道激素與免疫球蛋白激素則能夠進一步提高患者機體的免疫力,從而降低感染的發生率[11]。此外,腸外營養的費用較高,容易引發患者出現不同程度的不良反應與感染癥狀;而早期腸內營養的費用更為低廉,可以保證患者治療過程中的安全性;但食管癌術后的患者容易出現鼻腔腫痛等一系列不適的癥狀;因此,在采用早期腸內營養的過程中,還需要采用一定的護理干預,以此來減少患者的不適感。
在本次研究中:30例實驗組患者中,共有3例患者出現肺部感染的情況;30例對照組患者中,共有10例患者出現肺部感染的情況,實驗組患者術后肺部感染的發生率為10.00%(3/30)低于對照組患者肺部感染的發生率為33.33%(10/30);組間對比差異有統計學意義(P<0.05);且在相關指標水平中,治療前兩組患者各項指標差異無統計學意義(P>0.05),治療后,實驗組患者ALB、Hb、ALT以及AST水平分別為:(39.6±7.4)g/L;(99.4±13.7)g/L;(33.0±6.3)U/L;(28.3±3.6)U/L;對照組患者ALB、Hb、ALT以及AST水平分別為:(35.4±6.2)g/L;(90.1±10.3)g/L;(42.6±8.5)U/L;(32.8±2.6)U/L;實驗組患者臨床指標的改善情況優勢明顯,組間對比差異有統計學意義(P<0.05);此外,治療后,實驗組患者術后排氣時間以及體質量下降情況均低于對照組;由此可見,實驗組采用早期腸內營養患者的康復效果優于采用腸外營養支持的對照組患者,組間差異具有統計學意義(P<0.05)。其中,術后早期腸內營養能夠降低患者感染發生率的主要原因包含了以下幾點:(1)術后早期腸內營養能夠有效維持患者腸道黏膜的功能與結構,阻止腸道細菌與內毒素穿越腸黏膜,從而造成患者出現全身炎癥反應;(2)各項營養物質可以有效改善患者的免疫功能,進而改善機體腸壁通透性,可以抑制炎癥反應(避免術后內毒素血癥與腸道細菌易位),對細胞免疫功能有很好的促進作用,進而提高機體抗應激能力,改善患者的抗感染的能力;(3)早期腸內營養可以改善機體的免疫功能,刺激患者腸道激素分泌和免疫球蛋白的分泌[12]。
綜上所述,相比于腸外營養支持,早期腸內營養可降低術后感染的發生率,安全性高。

