超高壓對大豆球蛋白抗原性及結構的影響
趙益菲,布冠好*,陳復生
大豆富含營養物質,大約含有40%的蛋白質[1]。大豆蛋白由于其良好的營養價值和功能特性,已被作為一種蛋白原料廣泛應用于食品工業中[2]。然而,大豆是八大致敏食物成分之一,其中兩種儲藏蛋白β-伴大豆球蛋白和大豆球蛋白被認為是主要的致敏性蛋白[3-4]。而大豆球蛋白的含硫氨基酸是β-伴大豆球蛋白的3~4 倍[5],從營養學方面講,大豆球蛋白更具研究意義。大豆球蛋白即大豆11S球蛋白,是一種六聚體蛋白質,每個亞基單位均含有一個酸性鏈(A鏈)和堿性鏈(B鏈),除了存在于G4亞基中的酸性鏈A4之外,大豆球蛋白的每個亞基都通過單個二硫鍵相互連接成一個環[6]。大豆易過敏的消費者必須避免攝入大豆及其衍生產品,但是由于其用途的廣泛性,避免攝入大豆及豆制品具有一定困難;所以通過一定的加工手段降低或消除大豆蛋白的過敏原性具有重要的實際意義。
消費者對食品安全問題的需求,以及營養損失對食品感官質量的不利影響促使了非熱技術的出現。超高壓作為一種非熱加工技術,能修飾蛋白質中的二、三、四級結構,即其中的氫鍵、離子鍵、疏水鍵等非共價鍵[7]會被影響,從而改變抗原結構,導致蛋白質的致敏性發生改變。Hu Chunqiu等[8]研究了高壓誘導花生蛋白質的構象變化,其結果表明隨著壓力的增大,花生過敏原對免疫球蛋白(immunoglobulin,Ig)E結合能力下降。Li Huijing等[9]報道超高壓處理后大豆蛋白的抗原性降低了50%以上(300~500 MPa,20 min),與未處理蛋白相比,超高壓處理后的蛋白質具有較高的疏水性。Hildebrandt等[10]證明卵蛋白經超高壓處理(400~700 MPa、20 min)后,其免疫反應性隨著壓力的增加而降低,蛋白質結構和功能特性(包括發泡和乳化)的變化與壓力的大小呈正相關。
目前,作為一種新型的加工技術,超高壓技術已經有一定的相關研究[11-12],但其對大豆球蛋白的影響研究較少。因此,本實驗以脫脂豆粉為原料,利用堿溶酸沉法提取大豆球蛋白,以壓力、時間以及蛋白質量濃度為單因素,對大豆球蛋白進行超高壓處理,利用間接競爭酶聯免疫吸附測定(enzyme-linked immunosorbent assay,ELISA)實驗及免疫印跡法對大豆球蛋白的免疫活性進行定性和定量分析,研究超高壓對大豆球蛋白結構特性的影響,以期為食品加工過程中選擇合適的超高壓條件來降低大豆蛋白致敏性提供參考。
1 材料與方法
1.1 材料與試劑
脫脂大豆粉(蛋白質量分數52.36%) 河南省鯤華生物技術有限公司;牛血清白蛋白(albumin bovine serum,BSA)、3,3’,5,5’-四甲基聯苯胺(tetramethylbenzidine dihydrochloride,TMB)單組分顯色液 北京索萊寶科技有限公司;大豆球蛋白標準抗原(glycinin 3171)、酶標二抗(HRP標記的羊抗兔IgG) 美國Sigma公司;凝膠配制試劑盒 武漢博士德生物工程有限公司;其他試劑均為市售分析純。
1.2 儀器與設備
LGJ-18高速冷凍離心機 上海安亭科學儀器廠;pH計 意大利HANNA公司;HHP-600-3L超高靜壓處理裝置 包頭科發有限公司;DYY-6D型電泳儀 北京市六一儀器廠;Multiskan FC酶標儀 美國賽默飛世爾儀器有限公司。
1.3 方法
1.3.1 大豆球蛋白的提取
參考Thanh等[13]的方法提取大豆球蛋白,并根據Liu Chun[14]和宋佳[15]等的方法對其進行優化。室溫下,脫脂大豆粉用pH 8.5、0.03 mol/L Tris-HCl溶液浸提,料液比為1∶15(m/V),45 ℃下攪拌1 h后,高速冷凍離心機4 ℃ 10 000 r/min離心20 min,取上清液。然后向上清液中加入NaHSO3和CaCl2固體,使其濃度分別為0.01 mol/L和5 mmol/L,采用1 mol/L HCl和1 mol/L NaOH溶液調節pH值至6.4,4 ℃冷沉過夜。10 000 r/min離心20 min,將沉淀物和上清液分離。將沉淀物溶于pH值為7.0的磷酸鹽緩沖液中,4 ℃透析2 d,每3 h換一次水,冷凍干燥保存備用。
1.3.2 大豆球蛋白的超高壓處理
將提取的大豆球蛋白用磷酸鹽緩沖液(pH 7.0)稀釋至設定的蛋白質量濃度,并置于(耐高溫高壓)無菌均質袋(8 cm×10 cm)中,以真空包裝機密封,不留氣泡。壓力設置為100~600 MPa時,蛋白質量濃度為5 mg/mL,加壓時間為20 min;加壓時間設定為5~30 min時,蛋白質量濃度為5 mg/mL,壓力為500 MPa;蛋白質量濃度設置為5~50 mg/mL時,加壓時間為20 min,壓力為500 MPa。分析不同條件下大豆球蛋白的抗原性、經不同壓力處理之后的免疫活性和結構。
1.3.3 大豆蛋白抗原性的測定
蛋白抗原性的具體測定采用間接競爭ELISA方法,具體參考文獻[16-17]。
標準抗原包被酶標板→樣品抗原與一抗混合→洗滌→封閉液封閉→洗滌→與一抗混合的樣品加入酶標板→洗滌→加入羊抗兔二抗→洗滌→TMB顯色→濃硫酸終止反應→酶標儀顯示結果。
1.3.4 大豆球蛋白免疫原性的測定
采用免疫印跡法檢測大豆球蛋白的免疫原性[18]。將超高壓后的樣品經十二烷基硫酸鈉-聚丙烯酰胺凝膠電泳(sodium dodecyl sulfate-polyacrylamide gel electrophoresis,SDS-PAGE)之后,用硝酸纖維素膜進行轉膜,轉膜完成后37 ℃下封閉1 h;漂洗干凈后,4 ℃一抗孵育硝酸纖維素膜18 h,二抗室溫避光孵育膜2 h,最后進行膜顯色。觀察顯色情況,收集圖像進行免疫原性的分析。
1.3.5 大豆球蛋白分子質量的測定
將超高壓處理后的蛋白配制成2 mg/mL溶液,然后與上樣緩沖液按1∶1(V/V)的比例混合均勻。將樣品液置于沸水浴中煮沸4 min,使蛋白變性。取標準分子質量蛋白10 μL,用微量進樣器進樣,樣品進樣量為10 μL。在電泳外槽中加入電極緩沖液,接通電源,進行電泳。1.3.6 大豆蛋白質二硫鍵結構的測定
采用非還原性電泳測定大豆球蛋白二硫鍵結構,采用12%分離膠和5%的濃縮膠進行非還原型SDS-PAGE凝膠的配制。除了整個過程不添加β-巰基乙醇,實驗過程與SDS-PAGE步驟一致[19]。
1.3.7 大豆球蛋白二級結構的測定
稱取凍干后的樣品2 mg,按照1∶50(m/m)的比例加入溴化鉀,研磨成均勻粉末,壓成透明薄片。設定傅里葉變換紅外光譜儀的測定波數范圍為4 000~400 cm-1,分辨率為4 cm-1,掃描次數32 次[20]。最后利用Peak fit 4.12軟件分析蛋白質的二級結構。
1.3.8 大豆球蛋白表面疏水性的測定
將處理過的樣品蛋白溶于10 mmol/L磷酸鹽緩沖液(pH 7.0)中,使蛋白溶液的初始質量濃度為5 mg/mL,之后用同一磷酸鹽緩沖液逐步稀釋[21],每組壓力設6 種稀釋度,將20 μL 8.0 mmol/L 8-苯氨基-1-萘磺酸銨鹽(8-anilino-1-naphthalenesulfonic acid ammonium salt,ANS)溶液加至4 mL的樣品液中,混合均勻,晃動40 s 后,在激發波長390 nm、發射波長470 nm、狹縫5 nm的條件下測定其熒光強度。
1.4 數據統計與分析
采用SPSS 16.0軟件處理數據,每組實驗重復測定3 次,取其平均值,并進行鄧肯氏顯著性分析,P<0.05表示差異顯著。采用OriginPro 8.0軟件繪圖。
2 結果與分析
2.1 大豆球蛋白的SDS-PAGE圖
經Tris-HCl浸提和堿溶酸沉法提取的大豆球蛋白電泳結果如圖1所示,經凱氏定氮測得大豆球蛋白的蛋白質量分數為97.8%,大豆球蛋白各特征條帶與大豆分離蛋白中的大豆球蛋白部分相吻合,且A、B兩個亞基條帶清晰,提取純度較高,經Gel-pro analyzer凝膠定量分析軟件測定其蛋白純度為88.6%。
2.2 不同條件對大豆球蛋白抗原性的影響
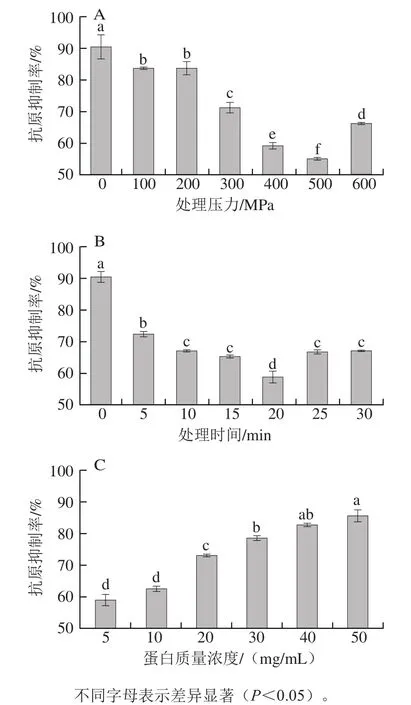
圖2 處理壓力(A)、處理時間(B)、蛋白質量濃度(C)對大豆球蛋白抗原性的影響Fig. 2 Effects of pressure (A), pressurization time (B), and protein concentration (C) on the antigenicity of glycinin
由圖2A、B可以看出,大豆球蛋白的抗原性隨著處理壓力的增加以及處理時間的延長先降低后升高,在壓力為500 MPa、加壓時間為20 min時,大豆球蛋白的抗原性從90.42%降低到54.77%,降低了35.65%;其原因可能是超高壓誘導大豆球蛋白發生了變性,導致其抗原決定簇的線性表位被改變或被破壞,不能被IgG抗體識別[22-23],從而不能誘發免疫反應,最終降低了大豆球蛋白的抗原性。而繼續增加壓力和延長時間對抗原性的抑制效果反而不明顯;可能是由于過大的壓力使蛋白質的結構再一次發生變化[24],導致過敏原的表位又暴露出來,所以抗原性反而增強。從圖2C可以看出,大豆球蛋白的抗原性隨著蛋白質量濃度的增加呈現上升的趨勢,其原因可能是底物蛋白質量濃度較高,致使作用到蛋白分子上的壓力減小。綜上所述,超高壓處理能對大豆球蛋白的抗原性產生影響。
2.3 超高壓處理對大豆球蛋白分子質量及免疫原性的影響
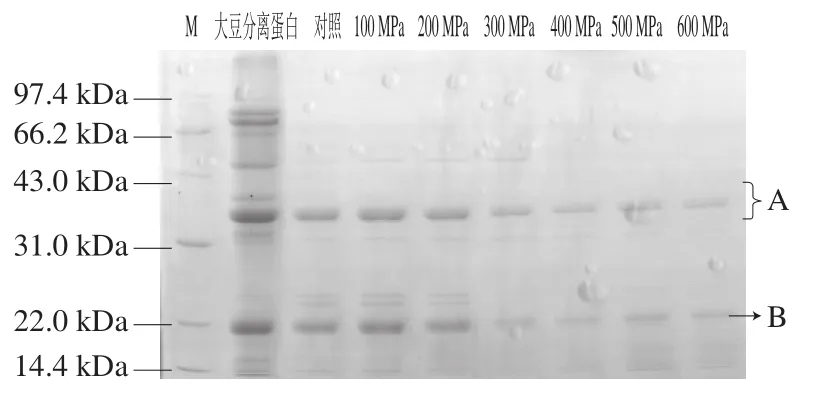
圖3 不同壓力條件下超高壓處理后樣品的SDS-PAGE圖譜Fig. 3 SDS-PAGE patterns of glycinin subjected to different high hydrostatic pressure levels

圖4 不同壓力條件下超高壓處理后樣品的免疫印跡圖Fig. 4 Western blot patterns of glycinin subjected to different high hydrostatic pressure levels
由圖3可知,隨著壓力的增加,大豆球蛋白的各個亞基條帶的密度逐漸降低,說明大豆球蛋白經超高壓處理后其亞基發生了解聚。由圖4可知,未經過超高壓處理的大豆球蛋白(對照)在其亞基位置處的免疫條帶灰度較強,呈現較強的陽性反應;經過超高壓處理的大豆球蛋白在其亞基處也均有免疫條帶,500 MPa處理20 min后其條帶的灰度明顯弱于對照組,但條帶并沒有完全消失,說明超高壓處理后大豆球蛋白免疫原性有一定程度的降低,但并不能完全消除。
2.4 超高壓處理對蛋白質二硫鍵的影響
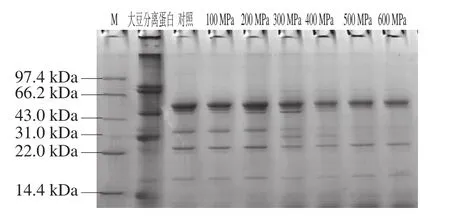
圖5 不同超高壓處理后樣品的非還原性電泳圖譜Fig. 5 Non-reduced SDS-PAGE of glycinin subjected to different high hydrostatic pressure levels
非還原性電泳與SDS-PAGE的區別是在整個實驗過程中沒有添加β-巰基乙醇(β-巰基乙醇是一種強還原劑,能使半胱氨酸殘基間的二硫鍵斷裂),不影響蛋白樣品中的二硫鍵,可以更好地反映蛋白空間結構的改變。由圖5可以看出,經過不同壓力處理的蛋白質樣品譜帶發生了顯著變化,大豆球蛋白的電泳圖譜在壓力100~200 MPa時條帶基本相同,蛋白質的結構沒有變化;當施加的壓力增加到300 MPa時,出現了新的條帶,說明在此處理壓力下,大豆球蛋白發生解聚,空間結構被破壞[25];而再增大壓力時,發現新出現的條帶又逐漸消失,其原因可能是新條帶經超高壓處理后,解聚為較小肽鏈,沒有進入到電泳圖譜中。根據以上實驗結果可以得出,超高壓處理會使蛋白質發生解聚,連接多肽鏈之間的疏水鍵斷裂,使蛋白質原本的高級空間結構解離成一個個單一的多肽鏈,甚至解聚為更小的肽鏈,進而可能引起大豆球蛋白的抗原性和免疫原性的變化[26]。
2.5 超高壓處理對大豆球蛋白二級結構的影響
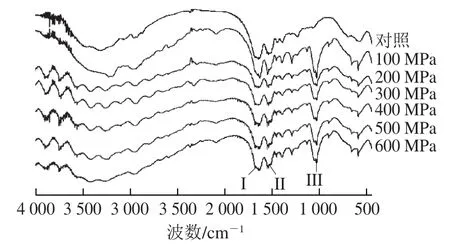
圖6 超高壓處理后大豆球蛋白的傅里葉變換紅外光譜圖Fig. 6 FTIR spectra of glycinin after high hydrostatic pressure treatment
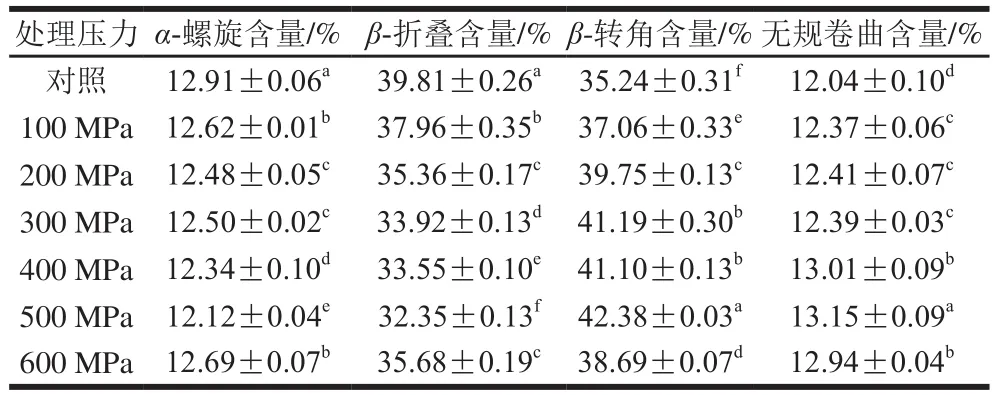
表1 超高壓處理后大豆球蛋白的二級結構含量Table 1 Secondary structure contents of glycinin after high hydrostatic pressure treatment
蛋白質的傅里葉變換紅外光譜一般有3 組特征吸收帶,分別是酰胺I(1 600~1 700 cm-1)、酰胺II(1 530~1 550 cm-1)和酰胺III(1 260~1 330 cm-1)[27]。圖6為超高壓處理后大豆球蛋白的傅里葉變換紅外光譜圖,其中酰胺I帶主要由C=O的伸縮振動引起的,同時也與N—H的平面扭曲和C—N的伸縮振動有關,酰胺I帶對于蛋白質的結構分析最為重要,它與其二級結構之間存在著一定的對應關系[28-29]。利用Peak fit 4.12軟件對超高壓產物的酰胺I帶進行去卷積二階導數擬合出的蛋白二級結構含量見表1。樣品中蛋白的二級結構主要以β-折疊和β-轉角為主,且超高壓處理主要改變了β-折疊和β-轉角的含量。與未經超高壓處理的大豆球蛋白相比,樣品的二級結構中α-螺旋和β-折疊含量減少,β-轉角和無規卷曲含量有所增加,說明超高壓導致大豆球蛋白的二級結構發生了變化。其可能的原因是超高壓使樣品原有的高級結構解聚,肽鏈被打斷,部分肽鏈擴散開,部分α-螺旋和β-折疊結構在超高壓后轉變為無規卷曲。通過對二級結構含量的分析發現超高壓后的α-螺旋和β-折疊結構含量降低,這與Tang等[30]的結果相一致。由前面的圖2A結果可知,隨著壓力的增加,大豆球蛋白的抗原性先增加后降低,其抗原性下降可能是由于二級結構中α-螺旋和β-折疊含量降低,而無規卷曲含量增加,空間結構發生改變導致了抗原表位的掩蓋,進而使蛋白抗原性降低。
2.6 超高壓處理對蛋白質表面疏水性及空間結構的影響
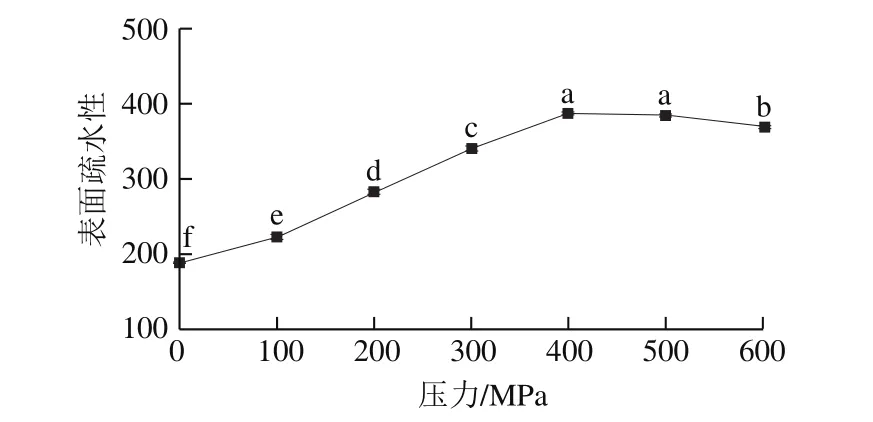
圖7 超高壓處理大豆球蛋白的表面疏水性Fig. 7 Surface hydrophobicity of glycinin after high hydrostatic pressure treatment
表面疏水作用是維持蛋白質三級結構的主要作用力,在維持蛋白質的三級結構的穩定和四級結構的形成中占有突出的地位[31]。蛋白質表面疏水性的變化可以反映蛋白質三級結構變化情況,由圖7可知,大豆球蛋白的表面疏水性隨著處理壓力增加而增大,表明蛋白質經超高壓處理后暴露出更多的疏水性區域,同時也說明大豆球蛋白的三級和四級結構經超高壓處理后發生了變化。蛋白質結構的變化會引起抗原性的變化,大豆球蛋白的空間構象表位經超高壓處理后被破壞,可能掩蓋其抗原表位,從而導致其抗原性減弱[32]。
3 結 論
超高壓作為一種新型的加工方式,能顯著影響大豆球蛋白的抗原性。研究結果表明,不同壓力、加壓時間、蛋白質量濃度均對大豆球蛋白的抗原性有明顯影響,其中在壓力500 MPa、處理時間20 min、蛋白質量濃度為5 mg/mL時其抗原性降低效果最好,與沒有高壓處理的蛋白相比下降了35.65%。傅里葉變換紅外光譜和熒光光譜分析結果表明超高壓處理后大豆球蛋白中α-螺旋和β-折疊有序結構含量降低,無規卷曲含量增加,且暴露出更多的疏水性區域,因此可能引起蛋白中的構象性表位被破壞或掩蓋,從而導致其抗原性降低。本研究深入分析了大豆球蛋白的抗原性與其結構變化的規律及相關性,為進一步探明超高壓影響大豆球蛋白過敏原的作用機理提供了參考,同時為食品加工過程中選擇合適的超高壓條件來降低大豆蛋白致敏性提供了一定的理論依據。

