血清LDL與2型糖尿病周圍神經病變的相關性研究
黃娟 胡維 熊丹
糖尿病是現代社會的高發病,我國的糖尿病患者約有1.1億,且發病患者呈低齡化趨勢[1]。有研究發現糖尿病患者機體長期處于高血糖的內環境中,易導致患者發生失明、腎衰竭和出現心血管疾病等,并隨著病情加重而威脅患者的生命質量[2]。糖尿病周圍神經病變(diabetic peripheral neuropathy,DPN)是其中常見的一種并發癥,有研究表明糖尿病患者中至少有10%在治療過程中發現DPN[3]。目前人們對糖尿病周圍神經病變的誘發機理未有明確定論。有研究發現氧化應激狀態貫穿于糖尿病的病程進展,對體內的生物大分子活性(如DNA、脂蛋白、脂質)造成較大的傷害,引起機體的生理功能紊亂,氧化應激在糖尿病患者中較為明顯,患者的丙二醛(malondialdehyde,MDA)等過氧化產物水平上升[4]。血清內低密度脂蛋白(low density lipoprotein,LDL)水平可反映患者體內的糖脂代謝水平[5]。張濤靜等[6]認為血清LDL可刺激巨噬細胞、中性粒細胞等分泌各類炎性因子,從而改變神經細胞的微環境,導致神經細胞功能異常。有研究發現LDL在糖尿病患者體內的氧化應激反應作用下形成糖脂混合物附著于血管內皮細胞,導致患者的毛細血管輸血功能異常,刺激DPN的發生及發展[7]。本研究擬探討血清中LDL與DPN發生的關系,以便為DPN的預防提供一定依據。
1 資料與方法
1.1 一般資料
選擇166例在2016年4月至2017年3月在我院接受治療的2型糖尿病(type 2 diabetes mellitus,T2DM)患者。將患者分為非DPN組(該組患者未發現DPN),94例,男性53例,女性41例,年齡范圍44.3~59.6歲,平均年齡(55.3±4.9)歲,糖尿病病程(7.4±2.3)年,體重指數(body mass index,BMI)為(25.3±3.5)kg/m2;DPN組(T2DM患者被診斷有DPN并發癥),72例,男性43例,女性29例,年齡范圍45.1~67.2歲,平均年齡(57.2±6.7)歲,糖尿病病程(8.4±2.7)年,BMI為(24.1±3.3)kg/m2,DM診斷流程參照中華醫學會2013年制定的中國T2DM防治指南[5]:空腹血糖(fasting plasma glucose,FPG)>7.0 mmol/L或餐后2 h血葡萄糖(2 hours postprandial blood glucose,2hPG)高于11.1 mmol/L。本研究受試者的排除標準為:受試者患有內分泌失調癥;受試者體內有心肺、肝腎等重要臟器衰竭、受試者近期服用激素類藥物;受試者患有高血壓。患者及家屬均知情并簽署知情同意書,且本研究經倫理委員會許可。2組患者的性別、年齡、BMI、糖尿病病程差異無統計學意義(P>0.05)。
1.2 檢測方法
稱量受試者身高與體重,測量3次去平均值。受試者均采集空腹靜脈血及尿液,通過全自動生化分析儀(PUZS-300,南京普朗醫療設備有限公司)檢測糖化血紅蛋白(hemoglobin A1c,HbA1c)、血肌酐(serum creatinine,Scr)、MDA、空腹C肽、尿素氮(blood urea nitrogen,BUN)、血鈣濃度、血磷濃度。血清中LDL含量檢測應用紫外分光光度儀(T6系列,北京普析通用儀器有限責任公司)。并記錄患者收縮壓(systolic blood pressure,SBP)及舒張壓(diastolic blood pressure,DBP)。
1.3 DPN評分標準
依據多倫多臨床評分系統(Toronto clinical scoring system,TCSS)[6]對受試者進行糖尿病周圍神經病變分級測試,測試前將房間溫度調整至25℃左右,并使受試者心理狀態穩定、放松。胼胝或傷口處不作為檢測部位。采用Semmes-Wein-stein法進行觸壓覺測試(檢測3次,受試測試回答均正確0分,出現1次錯誤1分,2次以上錯誤2分);通過音叉測試受試者振動覺靈敏度(檢測3次,受試測試回答均正確0分,出現1次錯誤1分,2次以上錯誤2分);使用Tip-Therm(Germany)涼溫覺檢查器(受試者溫度覺異常,2分;溫度感覺均正常,0分);通過壓力針測試受試者的疼痛(受試者針刺痛覺缺失,2分,針刺痛覺均存在,0分)。DPN分級標準為:無DPN 0~5分;輕度6~8分;中度9~11分;DPN,重度12~19分。糖尿病周圍神經病變分級測試專業醫務人員檢測。
1.4 統計學方法
采用SPSS 19.0軟件分析數據,采用Shapiro-Wilk檢驗數據的正態性,數據符合正態分布,用t檢驗分析計量數據。采用Pearson相關分析評估相關指標與血清LDL相關性。對自變量進行分組與轉換后,采用多因素Logistic逐步回歸分析DPN的相關因素。P<0.05表示差異有統計學意義。
2 結果
2.1 患者基本臨床資料比較
經統計學分析,DPN組患者的HbAlc含量、MDA、LDL水平顯著高于非DPN組患者(P<0.05);DPN組患者的空腹C肽水平顯著低于非DPN組患者(P<0.05);2組患者的血鈣濃度、血磷濃度、BUN水平、SBP、DBP差異無統計學意義(P>0.05),見表1。
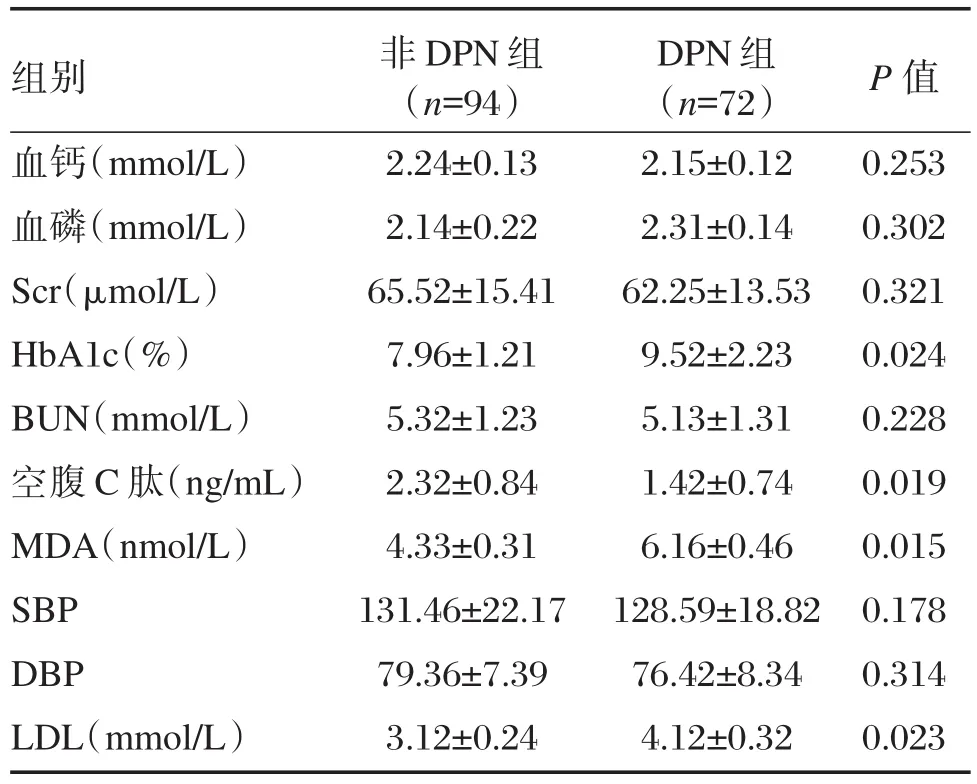
表1 非DPN組和DPN組患者基本臨床資料分析Table 1 The basic clinical data analysis of Non-DPN group and DPN group
2.2 血清LDL水平與臨床指標相關性
通過相關性分析血清LDL水平與患者臨床指標相關性,發現血清LDL水平與患者HbAlc、BUN呈正相關(P<0.05);與血鈣水平、血磷水平、Scr水平、空腹C肽呈負相關(P<0.05);與患者的SBP、DBP(P>0.05)無關,見表2。
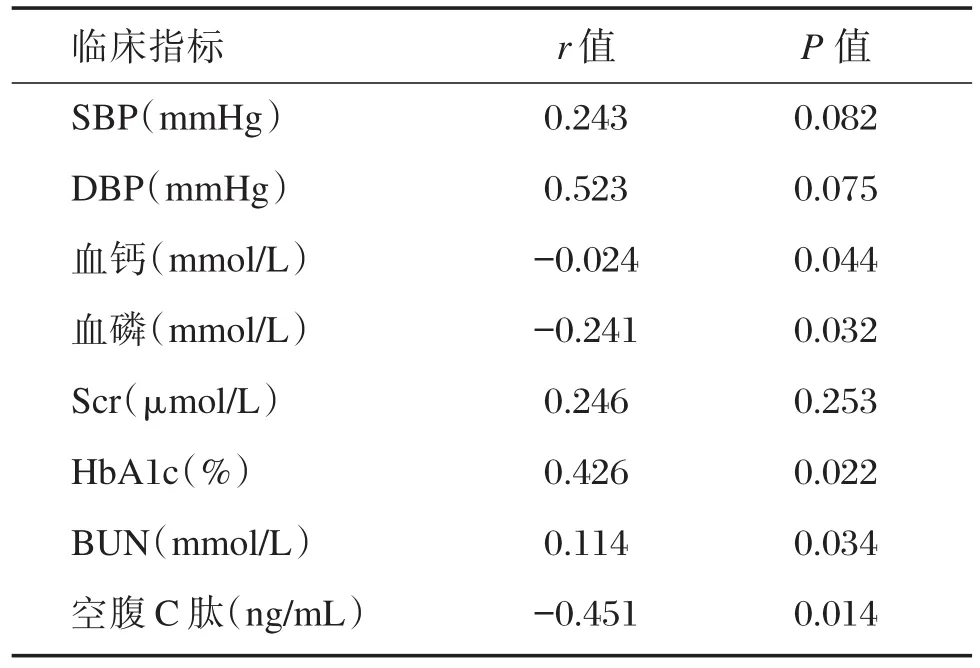
表2 血清LDL水平與患者臨床指標相關性分析Table 2 The correlation analysis of serum LDL levels and clinical indicators of patients
2.3 多元Logistic回歸分析DPN的影響因素
以DPN為因變量,以患者的血清LDL、Hb Alc、BMI、BUN、血鈣水平、血磷水平、Scr水平、空腹C肽為自變量,進行多因素Logistic逐步回歸分析,發現LDL、HbA1c與DPN呈正相關;空腹C肽與DPN呈負相關,見表3。
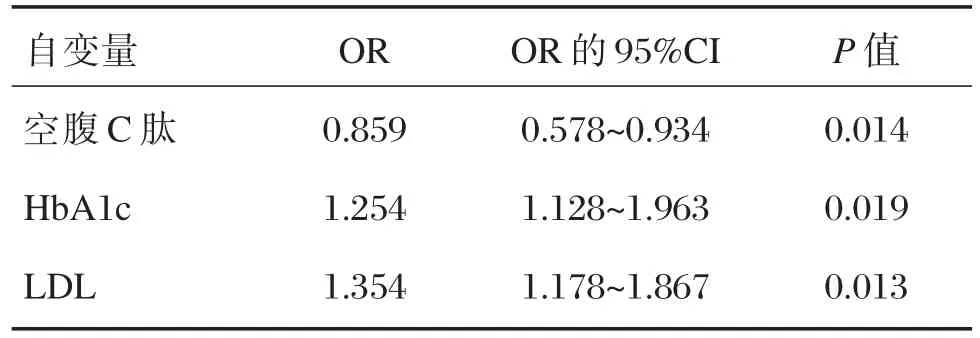
表3 多元logistic回歸分析LDL與DPN關系Table 3 Analysis of the relationship between LDL and DPN by multiple logistic regression analysis
3 討論
2型糖尿病患者由于血糖較高,體內的糖脂代謝異常,并誘發患者產生各類并發癥。DPN臨床癥狀表現形式較為復雜,易與其它疾病相混,因而臨床診斷較為困難[8]。DPN主要發生在感覺神經細胞和運動神經細胞,患者出現的癥狀可包括肢體出現局部瘙癢,手足運動遲緩麻木,嚴重時患者肌肉乏力、萎縮進而出現癱瘓癥狀,嚴重影響患者的生活質量[9]。沈娟等[10]發現患者的年齡、糖尿病病程與T2DM的發病有一定相關性,認為機體衰老時器官功能的調節隨之下降,對胰島B細胞分泌胰島素的能力產生影響。本研究發現2組的年齡、糖尿病病程差異無統計學意義,這可能是納入研究的患者個體差異導致的。MDA是體內脂類物質遭受自由基攻擊后斷裂形成的氧化產物[11]。本研究發現DPN組的MDA水平高于非DPN組患者,提示MDA水平與DPN的發生密切相關,可能是糖尿病患者體內的抗氧化能力下降,無法有效清除MDA,導致毛細血管功能障礙,供給神經細胞的營養因子相應減少,促使DPN的發生。因此,通過血清LDL-C水平評估DPN疾病程度有較高的臨床價值。
本研究發現血清LDL水平與患者HbAlc、BUN呈正相關。HbAlc、BUN在一定程度上反映患者的糖尿病嚴重程度,這表明血清LDL水平同樣可以作為反映糖尿病嚴重程度的指標。楊曉暉等[12]納入246例T2DM患者的臨床資料分析發現LDL和患者的HbA1c呈正相關,但與BUN無明顯相關性。這可能是由于血清BUN水平受患者的飲食、用藥情況等較多因素的影響,導致臨床檢測數據波動較大,提示研究前需對患者的臨床資料進行篩選,以減少對研究結果的影響因素。臨床數據經多因素Logistic逐步回歸分析糖尿病周圍神經病變的相關因素,發現該癥狀的發生與LDL、HbA1c與DPN呈正相關;空腹C肽與DPN呈負相關。血鈣和血磷水平和神經水平的興奮性密切相關,而胰島細胞分泌產生胰島素時可同時產生等量的C肽,空腹C肽可反映糖尿病患者的胰島素水平[13-15]。Edwards等[16]回顧性分析62例糖尿病患者后認為HbA1c、LDL-C水平是糖尿病患者并發癥增多的相關因素。這說明血清LDL水平與糖尿病患者的周圍神經病變密切相關,糖尿病患者的血糖異常誘發脂質代謝異常,血清LDL在相關氧化酶的催化作用下可能導致患者血清HbAlc、BUN的代謝進一步紊亂,加速神經組織病變,提示在對DPN的治療中需密切監測患者血清LDL水平,以便評估患者的預后,并實施合理的治療措施。由于本研究采用橫斷面設計方案探討血清LDL水平與DPN的相關性,并不能確定血清LDL水平是DPN的危險因素。因此,需進一步采用隊列研究的方式來論證LDL水平對DPN的作用。
綜上所述,本研究發現兼有周圍神經病變并發癥的2型糖尿病患者的血清LDL水平較單純2型糖尿病患者偏高,是糖尿病周圍神經病變的相關因素。血清LDL水平與患者相關糖脂代謝指標密切相關,需進一步研究其相關的分子機制。